肠道微生物对宿主适应性免疫的影响
刘艳 孙静 葛良鹏 马继登 张进威
(1. 重庆市畜牧科学院,重庆 402460;2. 四川农业大学畜禽遗传资源发掘与创新利用四川省重点实验室,成都 611130;3. 农业部养猪科学重点实验室 养猪科学重庆市重点实验室,重庆 402460)
哺乳动物出生后,其黏膜组织暴露于环境中,使得细菌、真菌、原生生物等微生物迅速地在宿主皮肤、口腔、呼吸道、尿生殖道和肠道等多个部位定植,形成了复杂的微生物群落,这些微生物被统称为共生微生物(commensal microbiota)[1],它们的数量是宿主细胞的10倍,且不同组织的共生微生物种类和丰度存在巨大差异,表现出不同的宿主-微生物互作模式(host-commensal interactions)[2]。在进化过程中,共生微生物与宿主形成了和谐的共生关系,对塑造免疫系统和诱导保护性免疫反应发挥了重要作用,从而维持宿主健康[3]。其中,肠道微生物种类最为丰富,研究领域也最广泛深入,它们以特殊的方式与宿主细胞相互作用。大多数肠道微生物属于非致病性微生物,与肠道细胞共生,通过参与先天性免疫和适应性免疫的发育和维持从而影响机体健康[4]。
适应性免疫主要由T细胞介导的细胞免疫和B细胞介导的体液免疫组成[5]。肠道微生物可以直接调节T细胞和B细胞的分化和活化[6],影响浆细胞分泌免疫球蛋白A(immuno-globulin-A, IgA)、IgG、IgM、IgD和IgE[7-8],筑成黏膜免疫的第一道屏障,保护机体免受感染。本文综述了肠道微生物及其对宿主早期免疫系统发育的影响,并对肠道微生物对细胞免疫和体液免疫的影响进行归纳总结,以期为肠道微生物对宿主适应性免疫的互作及其调控机制提供理论参考。
1 宿主肠道微生物概述
在多细胞生命出现之前,微生物群落在地球上居住了超过30亿年,宿主为不同的微生物提供了栖息地。研究表明,这些共生微生物有助于发育、先天性免疫和适应性免疫等,并且还有助于遗传变异以及物种的起源和进化[9]。多细胞生物的屏障表面存在共生微生物,这些微生物也影响着宿主许多生理过程[10-12]。哺乳动物的肠道微生物包括细菌、病毒、真菌等,其基因组包含约3×106个基因,大约是人类基因组的150倍[13]。哺乳动物胃肠道是暴露于环境的一个广泛界面,被数以万亿计的微生物定植(以细菌为主),种类超过1 000种,约为1-2 kg[14-16],其中结肠内微生物最为丰富,密度可达1012CFU/g[17]。物种、性别、年龄、饮食习惯等因素导致了不同个体间肠道微生物的组成差异[18]。近年来许多研究表明,肠道微生物稳态对维持宿主生理健康至关重要[19-20],肠道微生物紊乱(种类、结构、丰度等显著变化)会引起宿主罹患许多疾病的风险增加,如肥胖[21]、过敏[22]、炎症性肠病[23]和糖尿病[24]等。
2 肠道微生物与宿主早期免疫系统发育
2.1 微生物早期定植的“机会窗口”
目前的研究报告普遍认为,哺乳动物在妊娠期间子宫内环境保持无菌状态[25-26]。出生瞬间,环境微生物与幼崽体表接触产生定植并与宿主形成共生关系[27-29]。出生到断奶期间,被称为共生微生物定植的“机会窗口”[30-31]。在“机会窗口”的最初几小时,微生物迅速定植于幼崽皮肤及肠道;48 h左右,幼崽微生物密度(微生物数量)就能趋于成年水平[32-33]。然而,在“机会窗口”时期微生物丰度(即微生物种类)发展较缓,人类需要2-3年才能达到成年水平,小鼠需要3-4周[34]。在小鼠中,“机会窗口”在断奶前后就会关闭;在人类中,稳定的肠道微生物群落一般是在2-3岁时建立,目前还没有证据表明人类“机会窗口”关闭的确切时间[35]。
幼崽出生后,受到多种因素(分娩方式、喂养方式、抗生素使用和环境暴露[36-38]等)的影响,环境微生物选择性定植,伴随宿主的生长发育逐渐形成稳定的肠道微生物。母乳在“窗口”时期对幼崽微生物定植及抗原耐受具有重要作用[39]。母乳中的人乳低聚糖(human milk oligosaccharides, HMOs)可以促进特定代谢物(例如吲哚-3-乳酸)产生,对全身和肠道炎症产生抑制作用[40]。此外,在小鼠上已证实母乳中IgA有助于特定微生物在肠道黏膜定植,母乳中IgG可以防止侵袭性感染[41]。在“机会窗口”时期,微生物可以影响幼崽免疫系统发育,并对免疫反应和免疫病理产生长期影响[42]。例如,在断奶前接受抗生素或抗原转移抑制剂(通过肠道屏障)治疗的小鼠比断奶后接受微生物定植的无菌(germ-free, GF)小鼠,成年后对过敏和炎症性肠病(inflammatory bowel disease, IBD)的易感性增加[43-44]。
2.2 肠道微生物影响宿主早期免疫系统发育
许多研究表明,肠道微生物或其代谢产物会影响人类和小鼠的早期免疫系统发育[45-46]。幼崽出生前,母体肠道微生物及其代谢物,特别是短链脂肪酸(short-chain fatty acids, SCFAs),已被证实会影响后代的免疫发育[47-48]。有研究发现,在小鼠怀孕期间补充乙酸,不仅可以降低母体对过敏性气道疾病(allergic airway disease, AAD)的易感性,还可以抑制后代的过敏性气道疾病产生,究其原因是添加乙酸影响了母体及后代的调节性T细胞(regulatory T cells, Tregs)的增殖。肠道微生物对宿主免疫发育影响最显著的是肠道黏膜屏障,虽然隐窝结节(crypto patches, CP)和派尔氏结(peyer's patches , PPs)以及肠系膜淋巴结(mesenteric lymph nodes, MLNs)在产前已经形成[49],但出生后在肠道微生物的刺激下进一步促进了它们的发育[50],以及T和B细胞募集到固有层(lamina propria, LP)和PPs中,以便淋巴细胞进一步的分化与成熟[51]。出生后,若肠道微生物未能定植成功,肠道免疫功能将会受到损害,导致某些肠道疾病(如溃疡性结肠炎[52]、克罗恩病[53]等)的发病率增加。无菌小鼠出生后与常规小鼠相比表现出盲肠增大,肠上皮细胞(intestinal epithelial cells, IECs)周转动力学改变,淋巴器官发育不良[54]。肠道微生物成熟受限会导致免疫系统发育迟缓,从而增加小鼠对沙门氏菌的易感性[55]。部分肠道微生物可充当益生菌,对宿主健康有益[56]。尽管益生菌发挥生理功能的分子机制知之甚少,但现有研究已表明,益生菌主要通过以下几种方式发挥生理功能:(1)在肠腔内与肠道微生物(1级)生态系统互作或通过酶促活动;(2)与肠道黏液和肠上皮细胞(2级)在肠道屏障效应、消化过程、黏膜免疫系统、肠神经系统方面互作;(3)胃肠道外(3级)向外周组织器官传递信号分子,例如:肝脏、淋巴、大脑等[57]。在小鼠和猪的肠道内,单一益生菌菌种就可以影响早期宿主免疫系统的发育,这些益生菌在一定程度上可以促进肠上皮细胞的形态发育和功能完善[58-60],常见益生菌见表1。
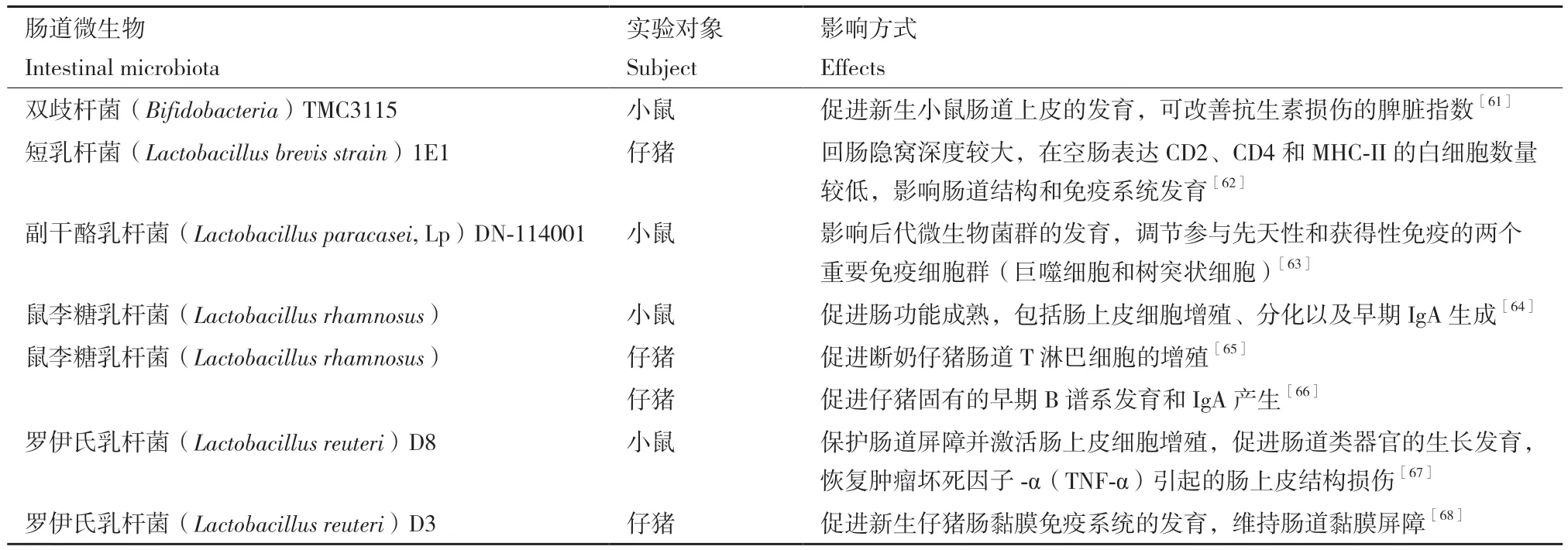
表1 肠道微生物对宿主早期免疫发育的影响Table 1 Effects of intestinal microbiota on host early immune development
3 肠道微生物与适应性免疫
宿主-微生物共生关系在长期的共同进化过程中已经建立起来,丰富多样的肠道微生物在宿主免疫系统的发育和成熟中起着至关重要的作用[69]。机体主要包含先天性免疫和适应性免疫,二者协同保护宿主免受外源病原体入侵和维持肠道稳态[70-71]。与先天性免疫系统不同的是,适应性免疫需要通过细胞表面受体识别特定的抗原[72]。尽管适应性免疫系统在第一次遇到抗原时需要一段时间对增殖和分化过程进行反应,但经历过抗原的记忆细胞可长期存活,并在遇到相同抗原时提供高效反应。适应性免疫系统主要包括B细胞介导的体液免疫和T细胞介导的细胞免疫。肠道微生物对适应性免疫具有重要意义,尤其是对幼龄动物肠道相关淋巴组织(gutassociated lymphoid tissue, GALT)的发育以及T细胞和B细胞的分化和成熟至关重要[73]。根据不同肠道微生物的定植生态位、抗原类型和代谢特性,CD4+T细胞的反应有很大差异,从而分化成不同的亚群[74]。此外,肠道微生物促进B细胞的持续多样化,影响T细胞依赖型和T细胞非依赖型抗体的产生(尤其是IgA)[74]。
3.1 肠道微生物与细胞免疫
肠道微生物和细胞免疫之间的相互作用非常复杂,微生物可以促进T细胞的分化,以快速响应来自外界环境的影响,从而启动适应性免疫反应[75]。
3.1.1 肠道微生物对CD8+T细胞的调控 CD8+T细胞可以将感染或患病细胞与健康细胞区分开来,在抗病毒和抗肿瘤免疫中起着关键作用[75]。肠道微生物代谢物,短链脂肪酸(short-chain fatty acids,SCFAs)(尤其是丁酸)可直接不依赖GPR41和GPR43,通过抑制组蛋白去乙酰化酶(HDACs)调节肠系膜淋巴结中CD8+CTLs和产生IL-17的CD8+T细胞的干扰素-γ(IFN-γ)和颗粒酶B(granzyme, B)的基因表达[76]。可变梭杆菌(Fusobacterium muta)定植肠道后,显著干扰适应性免疫,降低了CD8+T细胞数量[77]。11种混合菌群刺激机体免疫系统后[78],IFNγ+CD8+T细胞在肠道固有层中积累,显著干扰细胞免疫功能。IELs主要分为TCR+和TCR-两个亚群,前者类似于传统的T细胞,后者功能类似于固有淋巴样细胞(innate lymphoid cells, ILCs)。天然TCR+IEL包括TCRαβ+T细胞和TCRγδ+T细胞。在小鼠小肠中,50%-60%的IEL是TCRγδ+T细胞,而在人类中,主要是CD8αβ+IEL[79]。CD8+T细胞在早期宿主防御病原体入侵中起着重要作用。例如拟杆菌(Bacteroidales)可以与产生白介素-6(IL-6)的IEL,共同促进肠道上皮细胞增殖,有助于完善肠道屏障[80]。在病原体入侵的情况下,CD8γδ+IEL能在数小时内迅速迁移到肠道上皮细胞内,并与病原体直接接触的位置保持一致[81]。
3.1.2 肠道微生物对CD4+T细胞的调控 CD4+T细胞主要分布于肠道固有层中。肠道微生物激活CD4+T细胞后,由树突状细胞等细胞呈递抗原,引起特异性转录因子的表达,从而产生不同的CD4+T细胞亚群,例如T-bet Th1[82]、GATA-3 Th2[83]、RORγt Th17[84]和FOXP3 Treg[85]以及BCL6 TFH细胞[6](图1)。这些不同亚群的分布,动态地适应了微生物组成的变化,不同的肠道微生物对CD4+T细胞亚群存在不同作用。
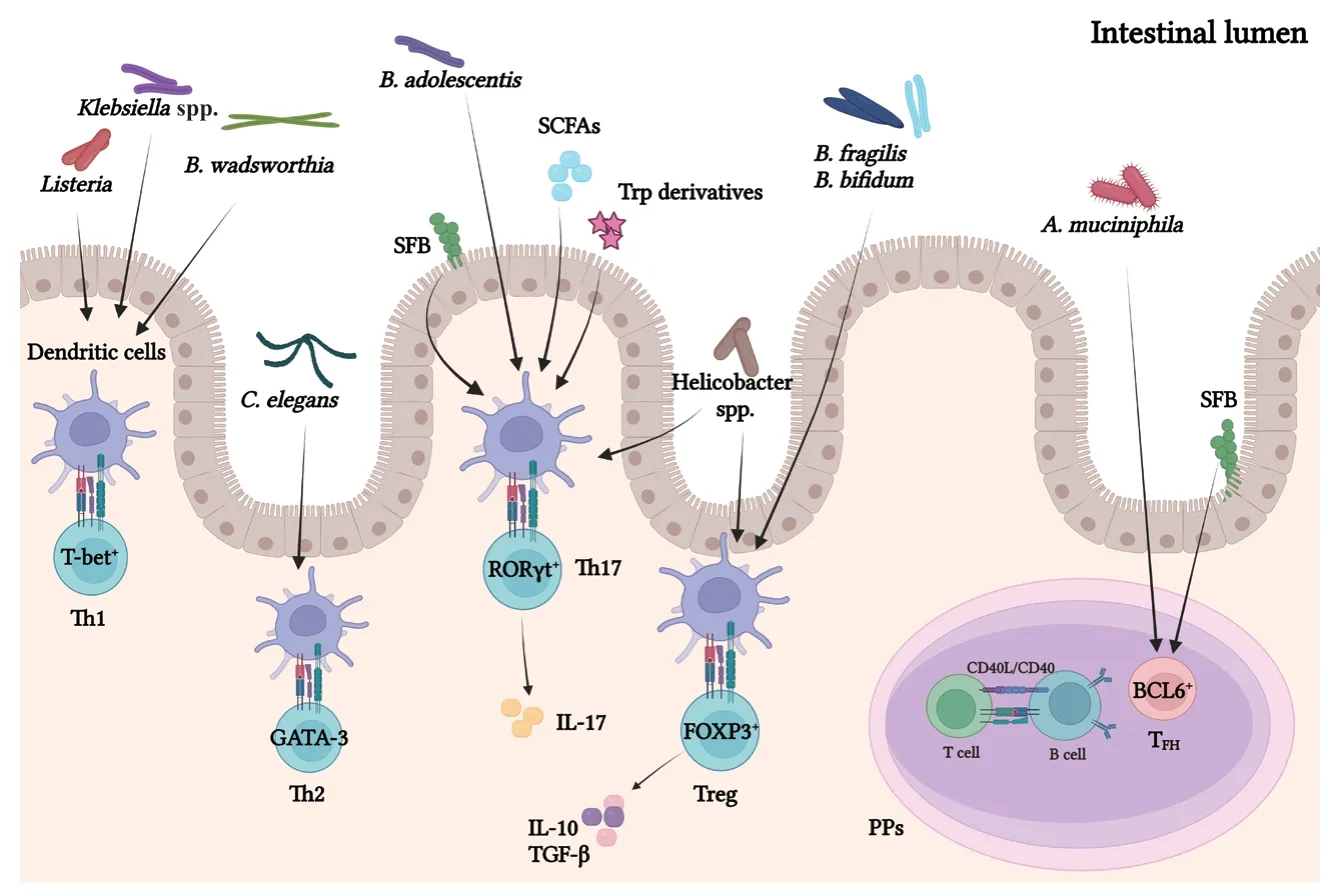
图1 肠道微生物对不同CD4+T细胞亚群的调控Fig. 1 Regulation of different CD4+T cell subgroups by intestinal microbiota
3.1.2.1 Th17细胞 适应性免疫应答依赖于将CD4+T辅助细胞分化为具有不同效应功能的亚群,产生白介素17(IL-17)的辅助性T细胞-17(Th17)是其中之一,Th17细胞参与对细胞外细菌和真菌的免疫清除,在肠黏膜免疫防御系统中起着关键作用[86],由于其在宿主保护和炎症紊乱中的作用不明确而被广泛研究。IL-6是肠道T细胞稳态的重要介质,树突状细胞可以产生IL-6和转化生长因子-β(transform growth factors, TGF-β),诱导Th17细胞与肠道微生物结合[87]。Th17细胞的增殖受到肠上皮细胞的负调控,肠上皮细胞在识别微生物后产生白介素25(IL-25),IL-25可以抑制固有层中白介素23(IL-23)的产生,而IL-23是T细胞在结肠内增殖所必需的,从而限制了Th17细胞增殖[88]。Th17细胞的增殖还受到分节丝状菌(Segmented filamentous bacteria, SFB)[89]、青少年双歧杆菌(B. adolescentis)[90]以及白色念珠菌(Candida albicans)[91]等肠道微生物的影响。此外,肠道微生物产生的次级胆汁酸[92]——3-氧代石胆酸(3-oxolithocholic acid),可以通过直接结合Th17细胞关键转录因子RORγt来抑制肠道Th17细胞的分化[93]。肠道Th17细胞有两个亚群:一个亚群有益于宿主的免疫系统,另一个会引起多种自身炎症性疾病[94]。两个亚群的炎症倾向在很大程度上是由引起它们分化的不同细菌决定的[50]。SFB诱导的Th17细胞是非炎症性的,而枸橼酸杆菌(Citrobacter)诱导的Th17细胞是炎症细胞因子的重要来源[95]。炎症性肠病(inflammatory bowel disease, IBD)患者的肠道微生物发生转移会增加Th17细胞的数量。因此,肠道Th17细胞的频率可以作为预测结肠炎模型中的疾病状态和严重程度的指标[91]。Th17细胞因其在IBD发病机制中的关键作用,被认为是控制肠道炎症和治疗IBD的可行靶标。潜在的靶向治疗策略包括抑制Th17细胞的分化和增殖,中和或抑制Th17细胞产生的细胞因子,抑制Th17细胞的迁移等[96]。
3.1.2.2 Th1细胞和Th2细胞 辅助性T细胞1(Th1)和辅助性T细胞2(Th2)和通过其独特的细胞因子和转录因子表达模式介导不同的免疫应答[97]。Th1主要引起细胞介导的免疫和吞噬细胞依赖性炎症,而Th2引起嗜酸性粒细胞积累和抗体诱导的反应,并抑制吞噬细胞[98]。Th1细胞通过阻止病原菌入侵、调节肠上皮细胞(IECs)的代谢和功能、促进IEC自我更新,是维持肠道稳态不可或缺的[99]。克雷伯氏菌(Klebsiella spp.)在肠道中可以诱导GF小鼠Th1细胞增殖[100],其诱导的Th1细胞分化由碱性亮氨酸拉链ATF样转录因子-3(Batf-3)依赖性树突状细胞和TLR信号通路所介导的[101]。一旦克雷伯氏菌在稳态失衡期间占主导地位,促进Th1细胞分化后可诱发严重的肠道炎症[102]。此外,嗜胆菌(B. wadsworthia)也可以促进Th1细胞增殖[103]。然而,单核增生李斯特菌(Listeria)感染无菌小鼠后,抑制Th1细胞分化,机体免疫受到抑制[104]。从传统的角度来看,最健康的免疫状态是在“细胞免疫”(接近Th1)和“体液免疫”(Th2)之间平衡的状态。GF小鼠淋巴细胞总数下调,导致细胞因子分泌减少,Th1/Th2比例失衡,并向Th2倾斜。但是,正常肠道微生物或特定肠道微生物的定植可以纠正这种免疫失衡[105]。比如,线虫(C. elegans)可以诱导Th2细胞转变为免疫反应效率更高的Th1细胞[106-107]。此外,乳酸杆菌(Lactobacillus)和脆弱芽孢杆菌(B.fragilis)通过影响Th2细胞活性来抑制Th1细胞活性,这表明肠道微生物可以同时影响Th1和Th2细胞[102]。
3.1.2.3 Tregs细胞和TFH细胞 表达转录因子(transcription factors, TF)Foxp3的Treg细胞是抑制肠道过度免疫反应和维持免疫稳态的重要组成部分[108]。Tregs靶向的多数免疫细胞,通过接触依赖机制、免疫调节细胞因子(如IL-10、TGF-β和IL-35)或靶细胞的代谢紊乱,以抗原特异性方式触发免疫耐受[109]。在宿主中,Treg细胞主要分为两个不同的亚群,一个是CD4+CD25+Foxp3+自然调节性T(natural regulatory T cells, nTregs)细胞,这些细胞从胸腺中未成熟的前体细胞分化而来,另一个亚群是诱导调节性T(induces natural regulatory T cells, iTregs)细胞,这些细胞主要是由肠道免疫生态位中的naïve T细胞重新产生的[109-110]。肠道微生物的存在促进naïve T细胞分化为具有不同于正常Treg细胞的T细胞受体的结肠Treg细胞,这些结肠Treg细胞提供了对肠道微生物的耐受性[111]。鞭毛蛋白是肠道中共生微生物表达的一种常见抗原,具有强大的IgA特异性反应,可阻止导致炎症和组织损伤的CD4+T细胞反应[112]。Treg细胞降低了肠道对鞭毛蛋白的IgA特异性反应,并允许鞭毛蛋白特异性CD4+T细胞的增殖。将Foxp3+T细胞转移到T细胞缺陷小鼠体内,可以恢复PPs生发中心的形成和肠道IgA的产生[113]。在结肠中,梭状芽胞杆菌(Clostridium)通过肠上皮细胞发出信号,从而介导结肠固有层产生分泌IL-10的Treg细胞[114]。现有的报道显示,脆弱双歧杆菌(B. fragilis)能够影响分泌IL-10的Treg细胞的产生[115]。此外,有报道证实婴儿双歧杆菌(Bifidobacterium)促进Treg细胞生成[116],乳酸杆菌(Lactobacillus)参与Treg细胞分化并影响其活性,干酪乳杆菌(Lacticaseibacillus casei)诱导Treg细胞发育和IL-10的分泌[117]。另一种乳酸杆菌菌株(L. murinus)已被证明可以调节小肠中的Treg细胞,从而减轻与结核分枝杆菌感染相关的肺部炎症[118]。Zhang等[119]报道,用青霉素抗生素氨苄西林治疗可减少Treg细胞增殖并解除Th1细胞对细菌感染的反应。微生物对TFH细胞数量和功能有一定影响,相反,TFH细胞也可以调节微生物的组成[120]。TFH细胞能够通过受体P2X7感知细菌ATP,进而塑造肠道微生物的组成[121]。SFB可以促进PPs中TFH细胞分化[122],黏蛋白菌(A.muciniphila)也可在PPs中诱导TFH细胞的分化[123](图1)。
3.2 肠道微生物与体液免疫
体液免疫由T细胞依赖型和非T细胞依赖型的B细胞组成,B细胞通过产生抵抗微生物入侵的抗体,保护宿主免受侵害[124]。T细胞依赖型的B细胞产生抗体与微生物抗原暴露有关[125]。肠道微生物可以增加具有抗炎功能的调节性B细胞(regulatory B cells, Bregs)的数量。肠道微生物定植后可以诱导树突状细胞(dendritic cells, DCs)和组织细胞产生IL-1β和IL-6,促进naïve B细胞向肠系膜淋巴结Bregs分化[126]。肠道微生物产生激活B细胞的Toll样受体(Toll-like receptors, TLRs),B细胞可以通过TLRs以及B细胞抗原受体(B-cell receptors, BCR)和CD40接收信号(图1),TLRs通过与这些受体连接协同作用,增强B淋巴细胞的适应性免疫功能[127]。B细胞的发育主要发生在骨髓中,祖细胞和前体B细胞通过V(D)J基因重排,形成高度多样的抗体库[29]。B细胞发育还发生在肠黏膜上,来自微生物的细胞外信号可以影响早期B胞发育和肠道免疫球蛋白谱[128]。
尽管B细胞在幼崽出生前就存在于肠道相关淋巴组织中,包括PPs和肠系膜淋巴结[129],但肠道微生物和肠道微生物代谢物(如短链脂肪酸),可以促进黏膜及全身其他部位的浆细胞分化[130],IgA是黏膜表面主要的分泌型抗体,在维持肠道稳态中起着关键作用[131]。
3.2.1 肠道微生物影响IgA的分泌 在黏膜组织产生的抗体中,IgA免疫球蛋白占近80%[132]。黏膜IgA+浆细胞可以通过T细胞依赖型和非T细胞依赖型两种机制产生。母乳是早期IgA的重要来源[133],其中的IgA成分既可以保护婴儿免受感染,也易于肠道微生物的定植。IgA发挥功能的机制包括与微生物抗原结合[112]、防止抗原凝集[134]以及中和病原细菌毒素[135]。机体受到抗原刺激以后,产生IgA的B细胞回到肠上皮,在那里产生IgA,然后通过上皮细胞基底外侧表达的聚合免疫球蛋白受体(poly-Ig receptor, pIgR)穿过肠上皮进入肠腔,与微生物形成共生关系,确保机体的健康水平[136-137]。由于物理距离上的接近,肠道微生物极大地影响了肠道IgA的分泌[138]。无菌动物IgA+浆细胞数量减少,IgA丰度降低。这可能是由于淋巴组织的发育受损,而淋巴组织是非T细胞依赖型的IgA产生的主要部位[139]。肠道中非T细胞依赖型的IgA是多反应性的,单个抗体能够以低亲和力结合多个靶点[140-141]。然而,大多数肠道IgA是T细胞依赖型的,特别是与细菌蛋白抗原结合的IgA。像SFB和黏液螺旋藻菌(Mucispirillum sp.)能够黏附在肠道上皮细胞表面的细菌,是T细胞依赖型IgA的有效诱导剂,通过增强肠道树突状细胞对抗原的摄取,从而提高了IgA的亲和力[140]。这种T细胞依赖型IgA主要通过B细胞,在PPs中以依赖CCR6的方式与和抗原结合的树突状细胞发生相互作用[142]。在志贺氏菌(Shigella)感染期间,抗原特异性IgA可以在黏膜层结合细菌并进行清除,避免细菌与上皮细胞进行接触造成宿主感染[143]。此外,IgA-细菌复合物还可以转移到PPs中,在PPs抑制炎症介质的产生,从而避免感染造成组织损伤[143]。
3.2.2 肠道微生物影响IgG、IgM、IgE、IgD的分泌 除了IgA外,IgM和一些IgG亚类以及IgE和IgD也结合肠道微生物,其中大多数依赖T细胞非依赖性途径[144]。在体液免疫应答中,IgM是最早出现的抗体,是机体抗感染系统的“先驱”[145]。与小鼠相比,人类肠道中有更丰富的IgM+浆细胞,这些浆细胞分泌的IgM抗体,有助于在黏液层中与IgA协同维持多样的共生微生物群落[146]。IgG可以与微生物特异性结合,并且可以通过识别细菌抗原直接与细菌相互作用,因此肠道微生物的定植可诱导具有低亲和力的IgG[147]。在肠道中还发现了相当数量的IgG2b和IgG3,这些抗体的产生依赖于通过B细胞的Toll样受体信号传导,但不依赖于T细胞的帮助[144]。无菌小鼠和新生小鼠的微生物刺激不足会导致黏膜B细胞的IgE类别转换增加,并以CD4+T细胞依赖的方式升高血清IgE水平,这一过程在出生后立即被常规肠道微生物定植逆转[148]。IgE水平升高会使肥大细胞表面结合IgE增多,可能导致机体过敏。如果在幼龄动物的“机会窗口”期,增加肠道微生物的丰富度,便可降低IgE的水平[149]。因此,生命早期存在一个需要微生物刺激来诱导免疫调节的关键窗口期[5]。与其他免疫球蛋白相比,IgD是罕见的,但最近有研究表明,IgD的类别转换优先发生在黏膜层,并依赖于多样化的肠道微生物[150]。
4 肠道微生物与适应性免疫系统的相互作用
肠道微生物可以通过多种途径在多个维度(空间和时间)上调节宿主的适应性免疫反应。肠道微生物和免疫系统在幼崽出生后便存在相互作用,肠道微生物影响免疫系统的发育,免疫系统反过来塑造了肠道微生物的组成[151]。
在小鼠中,适应性免疫系统的缺陷对微生物组成有很大影响,它们的完全缺失或功能缺陷会影响肠道微生物多样性及组成。B细胞在适应性免疫中起着关键作用,两种不同类型的B细胞缺陷小鼠,μMT和Jh基因缺陷小鼠(前者IgM重链跨膜区域缺失,后者在免疫球蛋白重链位点J段缺失)的肠道微生物组成存在差异。B细胞缺陷小鼠的梭状芽孢杆菌属(Clostridium spp.)较少,副球菌属(Paracoccus spp.)和乳球菌属(Lactococcus spp.)的细菌较多,血清脂多糖(lipopolysaccharide, LPS)浓度高于对照组小鼠。以上结果表明,适应性免疫系统中的B细胞存在缺陷时,肠道屏障完整性将会被破坏[152]。此外,Rag1基因缺陷小鼠的B和T细胞分化在早期就已经停止,因此缺乏成熟的T、B细胞,并无法与抗原受体的V(D)J基因片段进行重排。Rag1缺陷小鼠的微生物多样性明显低于同窝的对照组,并对机体代谢及免疫产生了影响[153-156]。缺失Rag2基因会导致肠道中缺乏IgA[157]。除了IgA,T细胞介导的细胞免疫也被认为可以塑造肠道微生物组成,但具体机制需要进一步研究。与外部因素对肠道微生物的影响相比,关于宿主免疫如何调节肠道微生物的信息有限。
综上所述,肠道微生物会影响宿主适应性免疫系统,而宿主适应性免疫系统反过来也影响肠道微生物的多样性和数量,二者相互促进、制约,共同维持机体稳态。
5 展望
肠道微生物与宿主形成不可分割的共生关系,与宿主适应性免疫系统相互作用,共同维持机体稳态。截至目前,大量报道利用无菌小鼠模型研究肠道微生物对肥胖[158]、过敏[159]、炎症性肠病[160]以及糖尿病[161]等疾病的影响。例如,有研究将热带念珠菌(C. tropicalis)接种于无菌小鼠上发现,与未感染的对照组相比,感染小鼠表现出更严重的结肠炎、肠道微生物组组成发生变化以及对葡聚糖硫酸钠诱导的结肠炎的敏感性增加[162]。然而,啮齿动物模型受到与人类重要生理和代谢差异的限制[163]。因此,需要更多与临床相关的人类胃肠道模型。猪(Sus scrofa)在解剖学、生理学、疾病发生等方面与人类极为相似,且具有廉价、易于管理、遗传学背景清晰、伦理问题极小等优势,具有与人类相似的解剖学、生理学和遗传学[164]。利用无菌猪作为研究模型可以排除背景微生物对实验的干扰,获得高重复性高敏感的研究结果,为探索“宿主-微生物互作”机制提供了合适且高效的大动物研究模型。
本研究团队已成功构建自主可控的无特定病原体(specific pathogen free, SPF)猪群体[165],建立了国内最大的无菌猪培育与应用平台[163]。基于无菌猪和SPF猪的研究发现,肠道微生物会影响仔猪骨骼肌的生长、发育和功能[166]以及仔猪黏膜免疫组织的发育和成熟[167];通过母体粪菌移植发现,肠道微生物可以改善无菌仔猪的肠道发育和屏障功能[168]。在未来的研究中,以无菌猪与无特定病原体猪为模型,结合单细胞和空间转录组等技术,探究共生微生物对免疫组织的细胞图谱及其空间基因表达的影响,以期从组织解剖学区域和细胞异质性的视角深度解析共生微生物对宿主适应性免疫的分子调控机制,有助于深刻理解“微生物-宿主互作”对宿主免疫反应的调控机制,为进一步系统阐释共生微生物对宿主的影响提供基础理论依据。