一种鉴别栽培柿品种SNP标记的新方法
梁晋军 朱溯远 张宇琴 张鹏飞 温鹏飞 杨运良
(1. 山西农业大学园艺学院,太谷 030801;2. 山西农业大学棉花研究所,运城 044000)
柿(Diospyros kaki Thunb.)作为重要的落叶果树,在我国栽培历史悠久,绝大多数柿品种为六倍体(2n=6X=90)[1]。在长期的引种、杂交、嫁接等自然选择及人工选择过程中,产生了丰富的柿种质资源,但也造成了“同物异名”或“同名异物”等种质资源混杂不清的现象[2]。尤其利用主栽品种作为骨干亲本在柿育种中应用,使得栽培种内柿品种间的遗传差异越来越小[3]。然而当前栽培柿种内遗传差异的鉴定比较复杂,缺少一种简单高效快捷的方法。
DNA分子标记的开发对植物分子遗传育种具有重要意义,它具有稳定遗传、不受取材部位限制和不受环境影响等优点[4]。前人也通过各种分子标记对柿种内进行亲缘关系分析,如SSR[5-8]、cpDNA[9-10]、ISSR[11]、SRAP[12-13]、RAPD[14],但这些分子标记全都比较复杂,需要大量筛选特异性高的引物,聚丙烯酰胺和琼脂糖凝胶电泳结果中可能出现由于距离较近无法分开,耗时、费力、准确性不高,未能简单应用于栽培柿种内遗传差异分析。目前柿属植物中仅有针对二倍体柿近缘种油柿和君迁子基因组的报道[15-17],而对六倍体柿基因组的研究缺乏,这在一定程度上限制了柿分子标记技术的开发,影响了分子辅助育种进程。
单核苷酸多态性(single nucleotide polymorphisms, SNP)在基因组中数量多、分布广、密度高、多态性丰富、检测迅速易于高通量分析[18],已在玉米(Zea mays L.)[19]、小麦(Triticum aestivum L.)[20]、水稻(Oryza sativa L.)[21]等作物遗传研究中广泛使用,目前在柿属植物中应用较少。有研究通过基因分型测序(genotyping by sequencing, GBS)分析鉴定柿的单核苷酸多态性标记,在筛选出的49个SNP位点中,有15个SNP被用于开发成竞争性等位基因特异性PCR(kompetitive allele specific PCR,KASP),已分析鉴别了32份柿子品种[22]。杜改改等[23]和王艺儒等[24]分别以禅寺丸柿雌雄花芽和小果甜柿果实的转录组数据对其SNP位点进行分析,一定程度上丰富了柿的SNP引物来源。
核糖体nrDNA ITS(internal transcribed spacer)序列进化速率较编码区快,是植物基因中进化较快的DNA片段,具有基因内保守而基因间存在一定变异的特点,因此nrDNA ITS序列能提供丰富的信息位点[25]。随着分子技术快速发展,ITS序列成为重要分子标记,因此常被用于植物属间及种间的系统发育关系和遗传多样性分析[26-28]。Qi等[29]分析了我国5种常见柴胡(Bupleurum L.)ITS的变异,基于ITS区域的单核苷酸多态性(SNP),设计了5对特异性引物,并将这些引物用于等位基因特异性PCR技术,建立了一种可靠的分子鉴定方法。Park等[30]通过ITS序列分析了中国水仙(Narcissus tazetta var. chinensis)和精选水仙品种的遗传差异发现,从中国、韩国和日本采集的水仙,无论是单花还是重花,都具有非常密切的亲缘关系。刘达等[31]对玄参属(Scrophularia L.)种间ITS序列的遗传多样性进行分析,将两个不同组的玄参属植物区分开来。朱玲等[32]利用ITS序列构建系统发育树,将90份新疆野苹果(Malus sieversii(Ledeb.)M.Roem.)和外类群西洋李(Prunus domestica L.)基本分成了3个大分支。
六倍体栽培柿品种由于其杂交亲本的差异,SNP杂合位点处可能存在5∶1、4∶2、3∶3、2∶4和1∶5五种情况。前人对六倍体栽培柿这一特性的研究还较少。本研究以18份主要栽培柿为试材,利用柿种内ITS杂合位点不同碱基峰图面积比例分析其在遗传上的差异性和相似性,以期总结出一种应用于栽培柿种内简单有效的SNP分子标记新方法,为六倍体栽培柿的鉴定提供新技术,同时为该种质的收集、利用及推广应用提供参考。
1 材料与方法
1.1 材料
试验材料包括18个栽培柿品种(包括中国涩柿和日本甜柿),均于2022年采集自山西省运城市(表1)。采集新鲜嫩叶,经液氮速冻后,-80℃保存,用于后续试验。
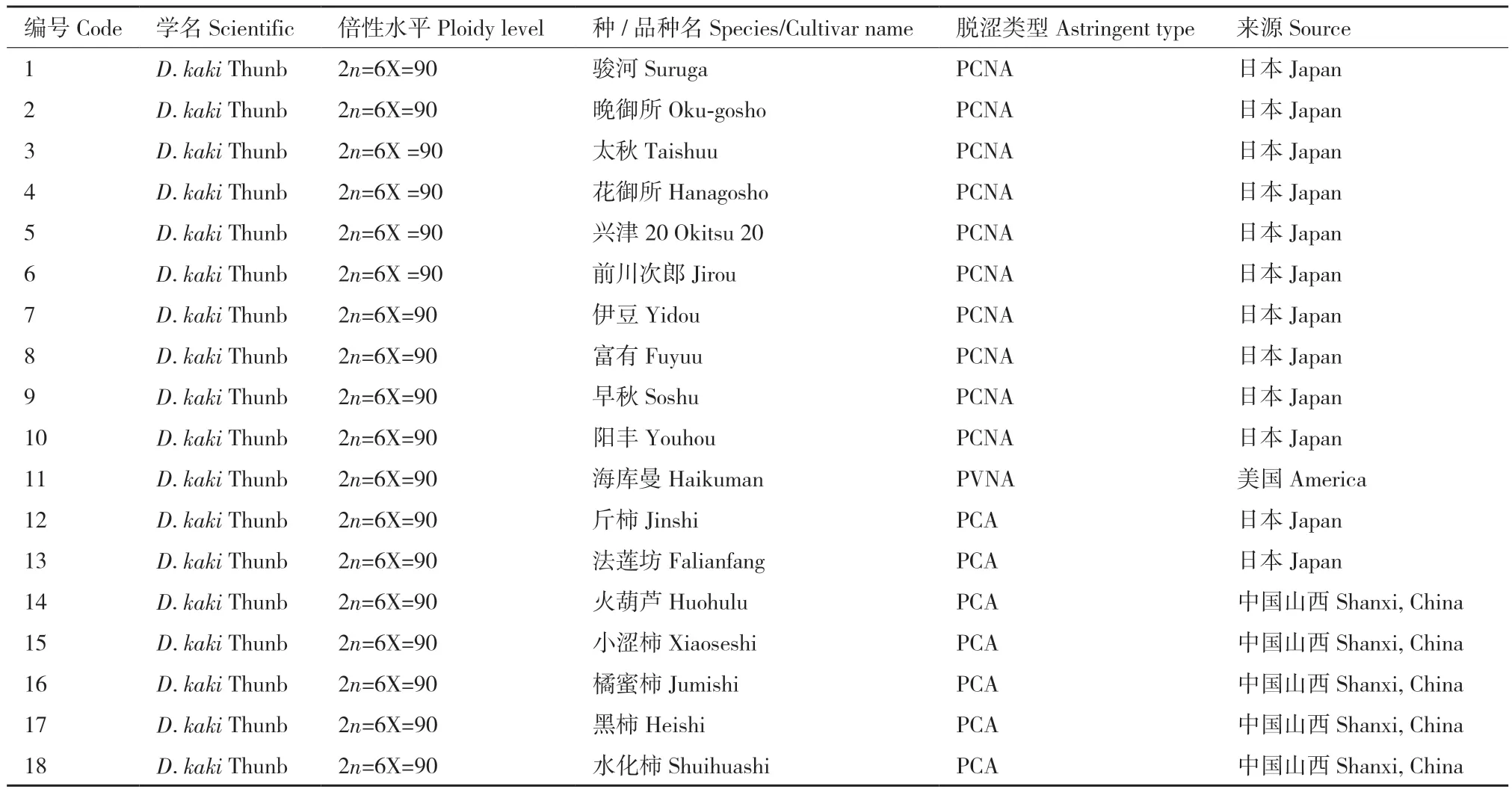
表1 试验材料Table 1 Materials in the experiment
1.2 方法
1.2.1 PCR扩增、测序 采用改良的CTAB法[33]从柿叶中提取植物总DNA。反应总体积为40 μL,包括2×PFU PCR MasterMix 20 μL(中科瑞泰生物科技有限公司)、引物ITS-F(ITS 5)(5'-GGAAG-TAAAAGTCGTAACAAGG-3')1.6 μL、ITS-R(ITS 4)(5'-TCCTCCGCTTATTGATATGC-3')1.6 μL(由上海生工生物有限公司合成)、模板DNA 1.6 μL和ddH2O 15.2 μL。
PCR扩增程序为94℃ 5 min;94℃ 30 s,53℃30 s,40个循环;72℃ 5 min,4℃保温。
PCR产物通过Gillgreen(北京华越洋生物科技有限公司)染色的2.0%琼脂糖凝胶电泳检测。利用琼脂糖凝胶DNA回收试剂盒(天根生化科技有限公司)回收纯化扩增产物,所得产物送上海生物工程有限公司进行双向测序。
1.2.2 酶切验证试验 应用Sau96 I限制性内切酶(NEB公司,马萨诸塞州伊普斯威奇,美国)对扩增出的ITS区进行特异酶切。酶切反应体积为15 μL,内含6 μL PCR产物,2 U Sau96 I和2 U rCutSmartTMBuffer,酶切时间为4 h,反应温度为37℃。酶切产物通过Gillgreen染色的2.0%琼脂糖凝胶电泳检测。
1.2.3 数据分析 应用DNAMAN软件[34]对所获得的ITS序列进行序列手工校对,并依据NCBI上已有的ITS序列(KU378723.1)确定边界,用Chromas软件[35]观测峰图,ImageJ软件测定测序峰图面积和酶切电泳图亮度[36]。
2 结果
2.1 基于ITS序列杂合位点碱基峰图面积差异进行栽培柿种内聚类分析
通过对柿种内ITS区进行测序分析,结果表明,柿种内无任何长度差异,均为730 bp。18个栽培柿品种相似性99.26%,栽培柿种内的差异位点仅有6个,且6处位点均存在杂合现象(双峰),即在同一位点处同时存在峰图面积不同比例的2个碱基。六倍体栽培柿品种由于其杂交亲本的差异,SNP杂合位点处杂合子碱基比例存在差异,本试验测序结果在杂合位点处的2个碱基峰图面积比例出现2∶1、1∶1和1∶2三种情况。
利用Chromas软件对ITS区测序峰图观察发现,18个栽培柿品种在ITS区出现杂合现象的6个位点分别在151、168、205、278、279和622位点,且同一位点的杂合情况也存在差异,在151和278位点处,碱基C和T的杂合现象有2∶1、1∶1、1∶2三种,在168和205位点处碱基C和T的杂合现象只有1∶1,在279位点处碱基C和T的杂合现象只有1∶2,622位点处则是碱基A和G的杂合现象,杂合情况为1∶2。
利用柿种内ITS区的杂合位点现象可将18个栽培柿品种分为11类,将分出的类别用“D”来表示(表2)。D1、D2和D3没有杂合位点出现(图1-A)。D4和D5在279位点都出现杂合现象,D4只有一个杂合位点,即在279位点C∶T=1∶2;D5在278、279位点分别出现C∶T=1∶1和C∶T=1∶2的杂合情况(图1-B)。D6、D7在151位点都出现C∶T=2∶1的杂合现象(图1-C)。除151位点外,D6还在168位点出现C∶T=2∶1的杂合现象,D7在205、279和622位点处出现C∶T=2∶1、C∶T=1∶1和A∶G=1∶2的杂合现象(图1-C)。D8、D9、D10和D11只在151和278位点处出现杂合现象(图1-D)。D8的杂合现象分别为C∶T=2∶1和C∶T=1∶2;D9都为C∶T=1∶1;D10为C∶T=1∶2和C∶T=2∶1;D11为C∶T=1∶2和C∶T=1∶1(图1-D)。
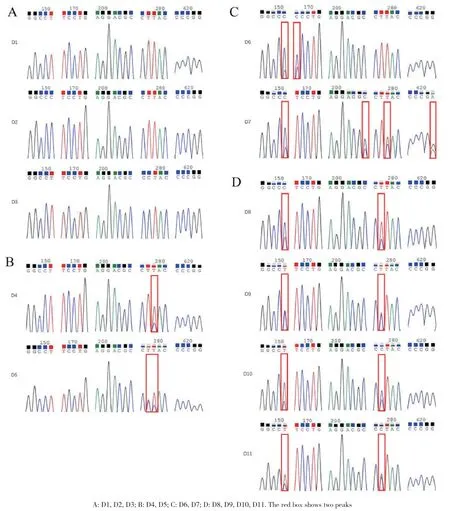
图1 D1-D11类ITS序列峰图Fig. 1 ITS sequence peak of class D1-D11
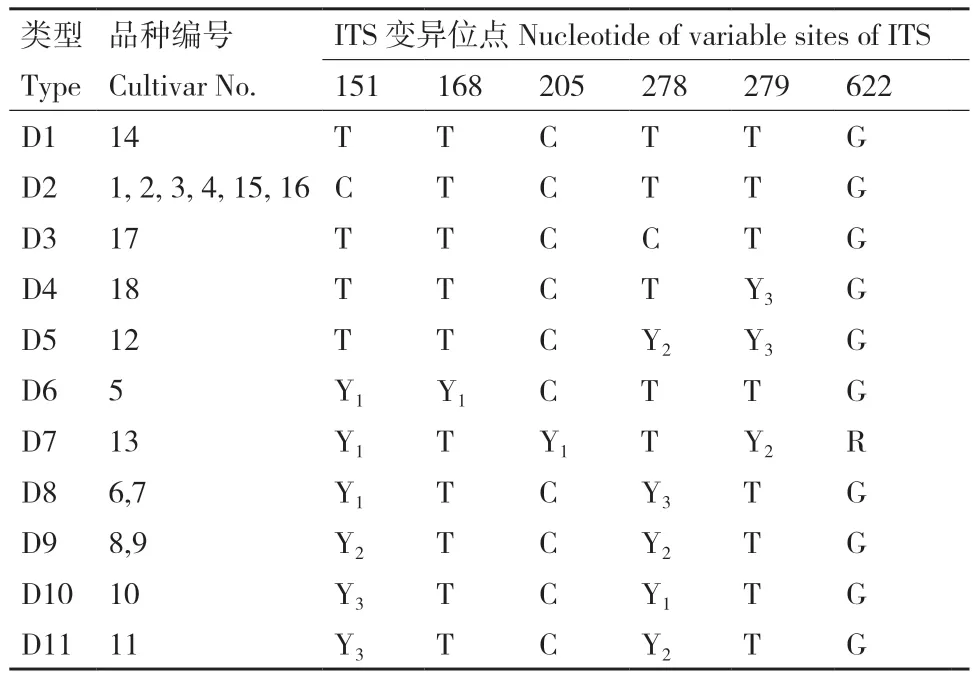
表2 基于柿种内ITS区的杂合位点现象聚类Table 2 Clustering of heterozygous sites based on ITS region in persimmon species
2.2 酶切验证试验
针对柿种内杂合位点进行验证,在151位点处存在C和T碱基,因为其不同的峰图面积比例,所以18个栽培柿在151位点共存在5种情况,分别选择‘阳丰’(C∶T=1∶2)、‘兴津-20’(C∶T=2∶1)、‘早秋’(C∶T=1∶1)、‘晚御所’(C)、‘黑柿’(T)进行151位点处的酶切验证试验。
‘晚御所’ITS序列151处位点为C碱基(GGCCC)能被Sau96 I特异完全酶切,在375 bp处存在1条条带(图2-d)。‘黑柿’ITS序列151处位点为T碱基(GGCCT)不能被Sau96 I特异酶切,在450 bp处存在1条条带(图2-e)。其他3个品种ITS序列151处位点为C和T碱基同时存在能被Sau96 I不完全特异酶切,在450和375 bp处各出现1条条带。‘阳丰’(C∶T=1∶2)450 bp处条带会比375 bp处更亮(图2-a),即碱基T的峰图面积大于C(图1-D);‘兴津-20’(C∶T=2∶1)375 bp处条带会比450 bp处更亮(图2-b),即碱基C的峰图面积大于T(图1-C);‘早秋’(C∶T=1∶1)450和375 bp处2条带会一样亮(图2-c),即碱基C的峰图面积等于T(图1-D)。

图2 151位点处特异酶切图Fig. 2 151 specific enzyme cut at sites
3 讨论
ITS序列主要用于植物属间、种间亲缘关系鉴定,本研究基于栽培柿的六倍体特性通过ITS区的SNP位点和观测杂合位点及其峰图面积比例构建了一种简单的鉴别栽培柿品种间差异的新方法。Ma等[37]对95个栽培柿品种使用GBS分析,构建了GBS文库鉴定了大量SNP位点,有15个成功用于KASP检测的引物和探针,应用KASP分子标记可以明显区分纯合型和杂合型,鉴定了32个柿子品种,与传统的SNP分子标记相比,本研究在ITS序列发现的SNP位点同样可以明显区分纯合型和杂合型,并通过碱基峰图面积比例进一步对杂合类型进行分类,大大降低了成本,节省了时间。
本方法与SSR、ISSR、SRAP、RAPD等方法相比最大的优势在于步骤简单、操作方便,可以在短时间内有效的区分出大量栽培柿品种间的遗传差异,只需对栽培柿品种的ITS区进行扩增、测序,并通过观测峰图对ITS区的杂合位点及其峰图面积比例进行分类即可,无须进行大量的引物筛选以及统计凝胶电泳特征性谱带,对栽培柿种质资源评价和遗传育种研究具有一定指导作用。在鉴别能力方面,18种栽培柿品种有8个品种能够完全区分,分别为D1、D3、D4、D5、D6、D7和D11,在D2中‘骏和’‘晚御所’‘花御所’被聚为一类,这与郭大龙[38]的研究一致。本方法可以为解决栽培柿品种“同物异名”和“同名异物”的情况奠定基础。
本研究基于ITS序列发现的SNP位点为151、168、205、278和279位点,与梁晋军[39]研究基本一致,622位点为新发现的杂合位点,96和474位点处为未发现的杂合位点现象,可能是由于样本数量少导致,随着样本数量的增加可能还会发现更多新的杂合位点和杂合类型。
4 结论
发现一种新的基于六倍体栽培柿nrDNA ITS序列的SNP分子标记,这种新方法可以将18份栽培柿品种分成11类。