甘蓝型油菜种子硫苷含量全基因组关联分析
周会汶 吴兰花 韩德鹏 郑伟 余跑兰 吴杨 肖小军
(1. 九江学院 江西油茶研究中心 药学与生命科学学院,九江 332005;2. 江西省红壤及种质资源研究所 国家红壤改良工程技术研究中心江西省红壤耕地保育重点实验室,南昌 330045)
油菜是我国重要的冬季油料作物,随着科技的发展,油菜质量安全水平明显提高[1-2]。油菜籽经榨取后的菜籽粕是丰富的饲料蛋白资源,但是饼粕中含有较多的抗营养因子,如硫代葡萄糖苷(glucosinolates,简称硫苷),其降解产物有毒,对动物的生长发育有严重危害,限制了菜籽饼粕在饲料中的应用[3-5]。因此,降低油菜种子中硫苷含量是油菜育种目标之一。
硫苷是一种广泛存在于十字花科植物中的次生代谢产物,其基本结构为一个β-D-葡萄糖,连接一个磺酸盐醛肟基团和一个来源于氨基酸的侧链,根据侧链基团化学结构的不同可将硫苷分为脂肪族硫苷、芳香族硫苷和吲哚族硫苷三大类[6-8]。目前硫苷的生物合成途径及主要酶基因均已被证实[8-10]。硫苷的合成途径包括前体氨基酸侧链的延长、核心结构的合成和次级修饰3个主要部分。其中次级修饰情况最复杂,包括羧基化、甲基化、葡萄糖基化等次级修饰,不同的修饰途径产生不同种类的硫苷。可见硫苷含量是一个复杂的数量性状,受多基因控制。Feng等[11]以202份DH群体(Tapidor×Ningyou7)为材料,采用786个分子标记在4种环境中定位到了105个mQTL,其中有4个与种子总硫苷含量相关mQTL(q.mcG-A9a、q.mcG-A9b、q.mcG-C2b和q.mcG-C2c)在4种环境下均被检测到。刘水燕等[12]以高硫苷‘GH06’、双低油菜‘油研2号’为亲本,构建了272份重组自交系群体,共检测到了11个QTLs,分别位于8个不同的连锁群。荐红举等[13]利用172份重组自交系的高密度SNP遗传图谱(包含2 795个SNP分子标记),检测到的5个QTL在2年内被重复检测到,分别位于A03、A09和C02染色体上。
随着基因组重测序和高密度SNP芯片技术的快速发展,全基因组关联分析(genome-wide association study,GWAS)已成为挖掘复杂农艺性状相关遗传位点的常用方法,具有不需要构建特殊的研究群体,可同时对多个性状进行分析,较传统QTL定位可以检测到更多的SNP位点和候选基因等优点[14]。近年来在水稻[15]、玉米[16]、大豆[17]、油菜[18-19]等作物中均有广泛应用。在油菜中,Wei等[19]在3种环境下重复检测到4个位点与硫苷含量显著关联,分别位于A09、C02和C09号染色体上。刘蔚等[20]在203份自交系中使用60K SNP芯片对油菜种子硫苷含量进行GWAS分析,共检测到了20个与硫苷含量显著关联的SNP,分别位于A02、A03、A09、C03、C08和C09染色体上。Tang等[21]基于基因组重测序在143份油菜中检测到113个与硫苷含量显著关联区域,分别位于9条染色体上。在甘蓝型油菜基因组中,是否还存在其他与油菜种子硫苷含量显著相关位点,需进一步探究。
本研究以遗传变异广泛的300份甘蓝型油菜自交系为材料,采用SLAF-seq(specific-locus amplified fragment sequencing)简化基因组测序技术开发的201 817个SNP标记[22-23],对该群体进行硫苷含量的全基因组关联分析,旨在检测与油菜种子硫苷含量显著相关的SNP位点及候选基因,为选育低硫苷油菜新品种提供理论依据。
1 材料与方法
1.1 材料
以300份甘蓝型油菜自交系为关联分析群体,所有油菜种质均由江西农业大学作物生理生态与遗传育种教育部重点实验室提供。
1.2 方法
1.2.1 田间试验与数据统计 300份油菜种质于2014年9月28日分别在江西农业大学试验田(简称JXAU)、江西省红壤及种质资源研究所油菜试验田(简称JXIRS)播种,两地各2个重复,在收获种子后,采用近红外分析仪(Perten DA7200,瑞典)测定油菜种子总硫苷含量,每个重复测定3次。经Excel、SPSS对测定数据进行统计分析。
1.2.2 基因型测序分型 在前期研究中,已采用北京百迈客生物科技有限公司开发的SLAF-seq技术,基于IlluminaHiSeqTM2500测序平台对300份材料基因组DNA进行测序,参考基因组为甘蓝型油菜品种Darmor-Bzh,群体相关SNPs与群体结构分析结果已在前期研究中报道[22-23]。
1.2.3 硫苷含量全基因组关联分析 基于前期开发的201 817个SNPs标记,结合一年两地油菜种子硫苷含量,使用TASSEL软件的GLM(General linear model)模型和MLM(Mixed linear model)模型进行全基因组关联分析[24]。根据GGplot2软件[25]、QQman软件[26]分别绘制Quantile-Quantile散点图(Q-Q plot)、曼哈顿(Manhattan)图,通过Manhattan图显示每个SNP位点的显著性。其中,Manhattan图显著关联SNP阈值取为1/SNP总数目的负对数,约为5.3。
1.2.4 候选基因预测 根据GWAS分析结果,将SNP定位到油菜参考基因组物理图谱上,搜寻每个显著SNP位点两侧100 kb范围内的候选基因,利用BLAST软件将候选基因分别与SwissProt、GO数据库比对分析,以获得候选基因的功能注释信息,根据基因功能注释筛选出与硫苷含量相关的候选基因。
2 结果
2.1 甘蓝型油菜硫苷含量表型统计及方差分析
从表1中可以看出,在JXAU环境下,300份油菜种子平均硫苷含量为29.789 μmol/g,硫苷含量范围为1.575-70.180 μmol/g,变异系数为63.52%;在JXIRS,所有材料平均硫苷含量为22.785 μmol/g,变异幅度为0.170-71.555 μmol/g,变异系数为81.55%。硫苷含量在两地均表现为连续分布,表明甘蓝型油菜种子中硫苷含量受多基因控制,适合QTL分析(图1)。
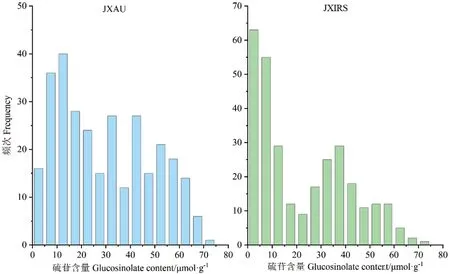
图1 甘蓝型油菜种子硫苷含量频次分布Fig. 1 Frequency distribution of seed glucosinolate contents of B. napus

表1 油菜籽硫苷含量统计分析Table 1 Statistical analysis of seed glucosinolate content in rapeseed
两地试验的方差分析结果显示(表2),硫苷含量在300份油菜种质中表现出极显著差异,硫苷含量在两地表现出极显著差异,说明环境对硫苷含量具有显著影响。并且硫苷含量的基因型与环境互作方差达到了极显著差异,在区组间差异不显著。
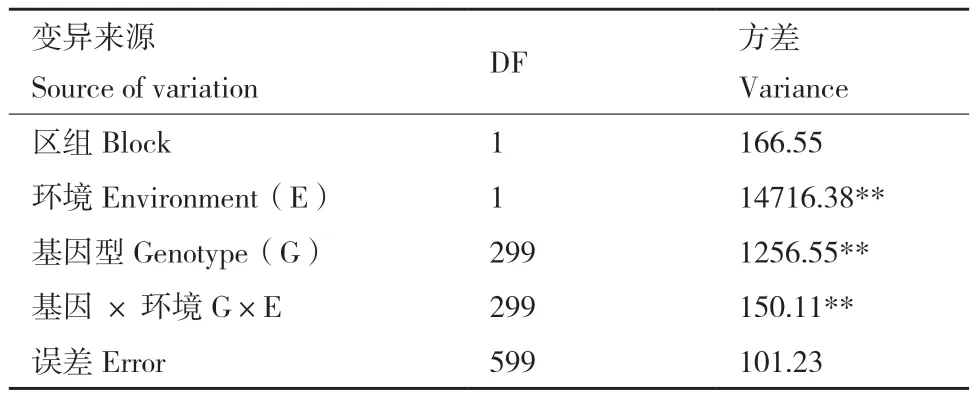
表2 两地环境下油菜种子硫苷含量的方差分析Table 2 Variance analysis of seed glucosinolate contents of rapeseed in two environments
2.2 甘蓝型油菜硫苷含量全基因组关联分析
采用GLM模型进行全基因组关联分析油菜硫苷含量,在JXAU检测到了89个显著相关SNP位点(图2,附表1),集中分布于A09(60个)和C09(11个)染色体上,单个SNP表型贡献率(R2)为4.62%-12.40%。在JXRIS共检测到183个显著相关SNP位点,集中分布于A09(140个)和C09(30个)染色体上,表型贡献率为4.34%-16.12%。此外,通过MLM模型在两地分别检测到58个(JXAU)、97个(JXRIS)显著相关SNP位点(图2,附表1),单个SNP表型贡献率分别为5.72%-13.21%(JXAU)、5.04%-16.75%(JXRIS)。除了JXAU的1个SNP(Bna_C08_13781013)外,MLM模型检测获得的SNP位点均在GLM模型中被检测,一共检测到了209个与硫苷含量显著关联SNP。在GLM与MLM两种模型、两地同时检测到的SNP有41个,SNP分别在A05(1个)、A09(36个)、C09(4个)3条染色体上。由于诸多SNP物理位置较近,将其命名为10个QTLs,分别为qSGC.A05.1、qSGC.A09.1、qSGC.A09.2、qSGC.A09.3、qSGC.A09.4、qSGC.A09.5、qSGC.A09.6、qSGC.C09.1、qSGC.C09.2、qSGC.C09.3(表3,图2)。
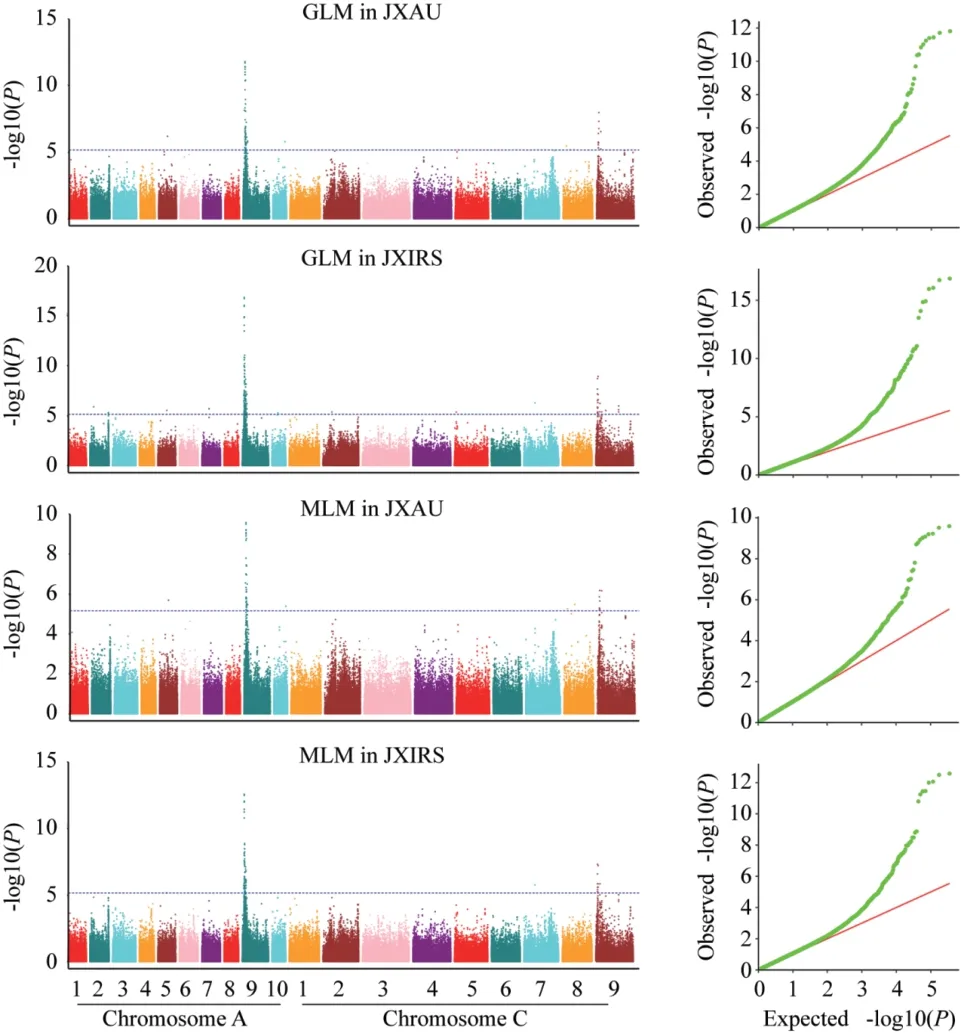
图2 硫苷含量全基因组关联分析Manhattan和Q-Q plot图Fig. 2 Manhattan and Q-Q plot of GWAS for glucosinolate content
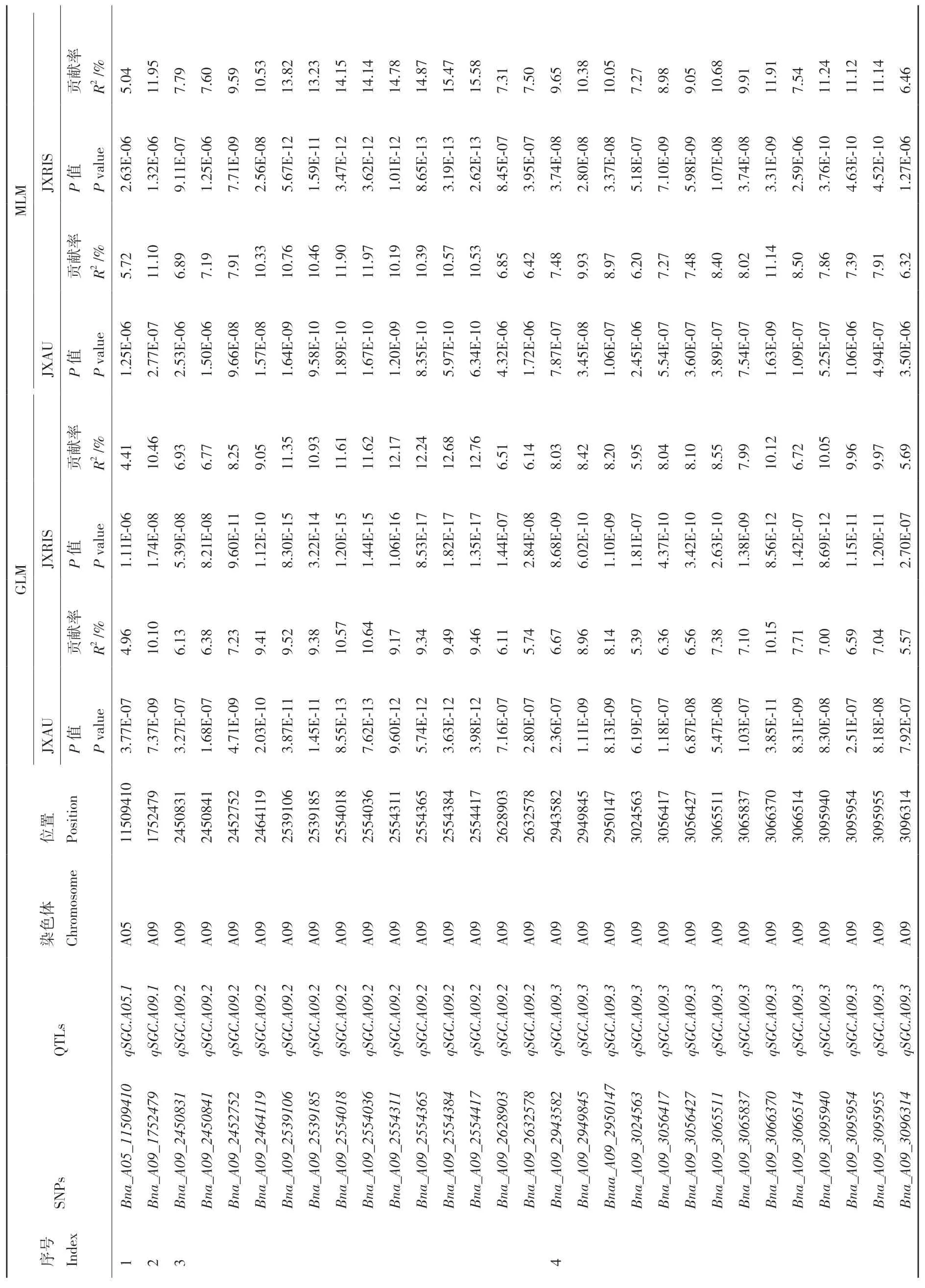
表3 两地重复检测到显著关联SNPsTable 3 SNP significantly associated with SGC under JXAU and JXRIS
2.3 甘蓝型油菜硫苷含量相关候选基因预测
根据油菜参考基因组注释信息,在10个QTLs上下游100 kb区间内共挖掘到了427个候选基因,并对候选基因进行功能注释,详细注释信息见附表2。在GO注释中,有8个候选基因注释在硫苷生物合成途径(GO:0019761)生物学过程中(表4),其中3个基因为MYB基因家族(BnaC09g05290D、BnaC09g05300D、BnaA09g05480D),2个NRT1/PTR基因家族(BnaA09g06180D、BnaA09g06190D),其他3个候选基因分别编码ATP硫酸化酶(BnaA05g16830D)、磷酸还原异构酶(BnaA09g06230D)、腺苷酸激酶(BnaC09g08710D),这8个基因分别在qSGC.A05.1(1个)、qSGC.A09.2(1个)、qSGC.A09.3(3个)、qSGC.C09.2(2个)、qSGC.C09.3(1个)等5个QTLs上。

表4 硫苷生物合成途径(GO:0019761)注释的候选基因Table 4 Candidate genes annotated with glucosinolate biosynthetic pathway(GO:0019761)
3 讨论
硫苷主要分布于十字花科、白菜花科、番木瓜种子中,是一种重要的次生代谢产物,在很大程度上决定了饼粕的商业价值[4,8,27]。因此,选育低硫苷含量的新品种是甘蓝型油菜的育种目标之一。甘蓝型油菜种子中硫苷含量是一个复杂的数量性状、受多基因调控,A09、C02和C09染色体是被公认的3个存在与种子硫苷含量显著相关的主效QTL位点,同时在A01、A03、A08、C06、C07等染色体也检测到相关位点[11,19-20,28-30]。Tan等[29]根据2017-2019年间505份种质种子硫苷含量,定位到了66个与硫苷含量显著关联的SNP位点,分别位于A02、A09、C02和C09上,其中3年均显著关联的位点为BnvaA0902677575、BnvaC0205007646、BnvaC0903100014。Liu等[30]同样在A09、C09上定位到了2个QTL与硫苷含量显著关联,分别为GSL-A9(Bn-A09-p2733282)、GSL-C9-1(Bn-scaff_19783_1-p379086)。魏大勇等[31]检测到了45个与油菜种子硫苷含量显著关联的SNP,主要分布于在A09(10个,物理位置在2 372 598-3 118 196 bp间)、C02(5个,物理位置在44 926 609-44 991 771 bp间)、C09(29个,物理位置在2 375 598-3 198 893 bp间)区间上。Qu等[32]在A09上染色体检测到了6个SNP位点与硫苷含量显著关联,其中有4个位点在2年间均被检测到,分别为Bn-A09-p3029767、Bn-A09-p3116738、Bn-A09-p3053532和Bn-A09-p1832760。诸多研究结果显示,A09、C09号染色体上诸多位点在不同群体中重复被检测到,表明这2个染色体上存在调控甘蓝型油菜种子硫苷含量的主效QTL位点。与前人研究结果比较发现,本研究中检测到的qSGC.A09.1、qSGC.A09.2、qSGC.A09.3、qSGC.A09.4、qSGC.A09.5、qSGC.A09.6、qSGC.C09.1、qSGC.C09.2与前人研究结果一致[29-32];qSGC.A05.1、qSGC.C09.3为新检测到的与硫苷含量显著关联的位点。与本研究组前期研究比较发现,qSGC.A09.1与芥酸含量(Bna_A09_1752479)显著关联,qSGC.A09.2与千粒重(Bna_C09_2586974、Bna_C09_2587207)、亚油酸含量(Bna_A09_2539185)显著关联,qSGC.A09.4与角果长度(Bna_A09_3899079)显著关联[33-35]。这表明A09、C09号染色体上存在调控硫苷含量、亚油酸含量、千粒重、角果长度等性状的多功能位点,可开发为CAPS、KASP等分子标记。
在硫苷合成途径中,R2R3-MYB类转录因子对吲哚族和脂肪族硫苷的生物合成具有重要的调控作用,其中MYB28、MYB34分别为脂肪族硫苷、吲哚族硫苷合成过程中的主效转录因子,对硫苷的合成起着重要作用[9,36-40]。本研究中,挖掘到了2个MYB28(BnaC09g05290D、BnaC09g05300D)、1个MYB34(BnaA09g05480D),其中2个MYB28在Tan等[29]研究中重复被检测到,BnaC09g05290D、BnaC09g05300D分别在花后20 d与40 d、20 d显著关联。除MYB28外,在Tan等[29]研究结果中挖掘到8个候选基因与硫苷含量显著关联(附表3),其中有6个候选基因(BnaA09g05940D、BnaA-09g06240D、BnaC09g04070D、BnaC09g04210D、BnaC09g04310D、BnaC09g05410D)在花后20 d与40 d显著关联,分别位于qSGC.A09.3、qSGC.C09.1、qSGC.C09.2上;2个候选基因(BnaA-09g04790D、BnaC09g08710D)仅在花后40 d显著关联,BnaC09g08710D参与硫苷生物合成途径(GO:0019761)。硫苷在植物中的积累是动态的,其合成部位与积累部位不同,硫苷主要在叶片中合成,通过茎秆转运到种子中,在转运过程中硫苷转运蛋白(GTR1、GTR2)起着重要作用[41-44]。如在芥菜中敲除GTR2后,显著降低了突变体种子中硫苷含量、叶片和角果皮中硫苷的积累量[45]。在本研究中,在qSGC.A09.3上挖掘到了2个与拟南芥AtGTR2(At5G62680)同源的候选基因BnaA09g06180D、BnaA09g06190D。与油菜种子硫苷含量显著关联位点附近的候选基因是否参与调控硫苷合成或者运输还需进一步验证。
4 结论
本研究通过对一年两地300份甘蓝型油菜种子硫苷含量的测定,基于SLAF-seq技术开发的201 817个SNP分子标记,经GWAS分析获得了209个SNP位点与硫苷显著关联,在两地两种方法中重复检测到41个位点,分别在A05(1个)、A09(36个)、C09(4个)3条染色体上。在显著关联SNP位点上下游100 kb共搜寻到427个候选基因,8个基因参与硫苷生物合成途径,包含2个调控硫苷合成的转录因子MYB28基因(BnaC09g05290D、BnaC09g05300D)、2个硫苷转运相关基因GTR2(BnaA09g06180D、BnaA09g06190D)。本研究检测到的SNP位点与候选基因可为后续改良甘蓝型油菜种子硫苷含量提供理论支持。
文章所有附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。