蒺藜苜蓿MtCIM基因结构和功能分析
谢宏 周丽莹 李舒文 王梦迪 艾晔 晁跃辉
(1. 北京林业大学草业与草原学院,北京 100083;2. 北京泰德制药股份有限公司,北京 100176)
Expansin是第一个被发现的细胞壁扩展蛋白[1]。在酸性条件下,它能断裂纤维素微纤丝间以及其与木葡聚糖之间的氢键,诱导细胞壁进行不可逆的伸展,从而促进植物细胞的增大[2]。Expansin蛋白在植物生长发育程中扮演了重要角色[3]。
目前,大量研究已经证明,Expansin蛋白几乎参与了植物生长发育全过程,包括种子发育[4]、叶片的生长和发育[5]、根的伸长、细胞的增大[6]以及侧根形成[7]等。在水稻(Oryza satival)中,OsEXPA8的过表达不仅使水稻根系结构发生改变,同时也增加了水稻株高、叶片大小和数量[8]。Chen等[9]将小麦TaEXPA2转入烟草中发现,烟草种子产量有所增加。另外,Expansin蛋白在植物的磷吸收方面也有一定的作用。通过分析大豆GmEXLB1发现,低磷胁迫诱导GmEXLB1在根系中过量表达,从而促进了拟南芥对磷的吸收[10]。GmEXPB2的过量表达有助于大豆根系生长和磷效率的提高[11]。同时,Expansin蛋白可以通过调控细胞壁的松弛,从而在植物适应环境胁迫过程中发挥关键作用[12]。在小麦中,过表达TaEXPA2可以提高抗氧化酶的活性,促进侧根的生长,从而进一步增强其在干旱条件下的适应性[13]。在烟草中,EXPA4过表达的植株在干旱和盐胁迫下呈现出更好的生长状态[14]。过量表达GhEXLB2使棉花(Gossypium hirsutum)在萌发期、苗期及开花期表现出较强的抗旱性[15]。
蒺藜苜蓿(Medicago truncatula),属于豆科(Leguminosae),苜蓿属(Medicago L.),一年生牧草植物,其生命周期短、倍性小(2n=16)、基因组小(454-526 Mb)[16],具有稳定的遗传转化体系,是一种非常重要的豆科模式植物。因此,研究蒺藜苜蓿基因的功能,在基因层面对蒺藜苜蓿进行性状培育和新品种的培育方面尤为重要。
目前,CIM在许多植物中已有研究,然而关于蒺藜苜蓿CIM基因的研究鲜有报道。本研究通过对蒺藜苜蓿CIM进行生物信息学分析、表达特征鉴定、亚细胞定位、转录自激活活性及转基因功能研究等。探讨MtCIM的功能,为后续深入研究该基因的网络调控机制奠定基础。
1 材料与方法
1.1 材料
试验所用的紫花苜蓿和蒺藜苜蓿种子均由北京林业大学草业与草原学院提供。所有植物均在人工气候箱中培养,培养条件包括:昼夜周期为16 h/8 h,温度为25℃/23℃,湿度为56%。
1.2 方法
1.2.1 引物设计 采用Primer Premier 5.0软件进行引物设计。其中,引物3302Y-MtCIM-F/R用于构建亚细胞定位植物表达载体,通用引物3302Y-F/R用于植物表达载体检测;引物pGBKT7-CIM-F/R用于酵母表达载体构建,T7 promter和3-BD用于酵母表达载体鉴定。引物MtCIM-RT-F/R用于MtCIM基因荧光定量检测,通用引物MtActin-F/R用于内参基因Actin荧光定量检测(表1)。

表1 引物序列Table 1 Primer sequences
1.2.2 生物信息学分析 基于NCBI(https://www.ncbi.nlm.nih.gov/)数据库MtCIM(Mtr_0118s0070)序列,使用DNA MAN软件分析MtCIM的开放阅读框和编码氨基酸序列,同时对MtCIM蛋白质进行保守结构域分析。利用PlantCARE(http://bioinformatics.psb.ugent.be/wetools/plantcare/html)数据库和TBtools软件对MtCIM上游DNA区域进行顺式调控元件分析。SOPMA(https://prabi.ibcp.fr/htm/site/web/home)被用于MtCIM蛋白的结构分析。
1.2.3 过表达载体3302Y-MtCIM构建 根据MtCIM的cDNA全长序列和3302Y植物表达载体的质粒图谱设计引物3302Y-MtCIM-F/R,以含有MtCIM克隆质粒为模板,用3302Y-MtCIM-F/R为引物进行PCR扩增。再将3302Y载体于37℃进行15 min酶切。利用无缝连接酶将纯化后的PCR产物与酶切质粒产物进行连接,50℃连接20 min,将连接产物转入大肠杆菌感受态,并将其菌液涂在含有50 mg/L卡那霉素的抗生素固体LB培养基上进行挑选,将其置于37℃恒温箱中培养8 h,挑取生长于抗生素培养基上的单菌落为模板,通用引物3302Y- MtCIM -F/R进行PCR扩增。PCR产物取4 μL经1%的琼脂糖凝胶电泳检测,条带大小符合的PCR产物送公司测序。经序列比对将序列正确的菌液,提取质粒用于后续试验。
1.2.4 亚细胞定位 采用CaCl2冻融法将3302Y-CIM重组质粒转入EHA105农杆菌感受态中。以健康生长1个月左右的健康烟草为材料,用注射器将菌液注射到叶片中,将完成注射的烟草置于人工气候箱中黑暗培养48 h。经过处理后,制作叶片玻片,将玻片倒置在激光共聚焦显微镜下捕捉荧光信号,并分析确定目的基因在细胞内的定位情况。
1.2.5 表达分析 分别用10 μmol/L ABA、10 μmol/L GA3和10 μmol/L IAA喷施处理生长健康且长势一致的蒺藜苜蓿植株,采集不同时间点的叶片组织,液氮速冻后,-80℃存储。提取上述材料的总RNA,并反转录为第一链cDNA,使用二步法进行荧光定量RT-PCR反应,程序为95℃ 10 s,68℃ 1 h,40循环。3次生物学重复,采用2-△△Ct法[17]计算基因相对表达量,运用Excel 2010对数据进行整理及图表制作,利用SPSS 26.0软件进行单因素方差分析。
1.2.6 转录自激活检测 利用实验室已构建的pMDCIM质粒为模板,使用引物pGBKT7-CIM-F/R进行PCR扩增,反应程序为95℃ 10 min;94℃ 30 s,60℃ 30 s,72℃ 1 min,25循环;72℃ 5 min;12℃保温。同时,提取酵母表达质粒pGBKT7,使用限制性内切酶Nco I进行单酶切,即37℃ 5 min。对PCR产物和酶切质粒分别进行纯化后,按照1∶1比例,使用无缝连接酶进行连接反应,即55℃ 15 min。连接产物转化至感受态大肠杆菌细胞,经50 mg/L卡那霉素筛选、挑选单克隆菌落以及菌体PCR鉴定后,将含有目标条带的大肠杆菌单克隆菌落送至生物技术公司进行测序分析。提取BD-CIM质粒,利用酵母转化试剂盒,将质粒转化至酵母菌Y2H Gold中。转化后的酵母经SD/-Trp筛选后,挑选单克隆菌落提取酵母质粒,使用T7 promoter和3'BD引物引物进行PCR检测。将含有正确条带大小的PCR产物送至生物技术公司进行测序分析。
将含有BD-CIM的Y2H Gold酵母菌,使用0.9%NaCl进行稀释后,分别滴加于SD/-Trp、SD/-Trp-His-AdeA平板上。放置于30℃恒温培养箱中倒置培养5 d。待培养结束,对酵母生长情况进行观察拍照。
1.2.7 转基因植株叶片形态检测 选择生长状态一致的转基因和野生型植物叶片进行显微分析。将叶片保存于50% FAA固定缓冲溶液中。随后,送至武汉赛维尔生物科技有限公司进行番红固绿染色、石蜡切片及光学显微镜下的电镜扫描分析。
1.2.8 转基因植株不同磷浓度处理 选择生长状态一致的转基因植株及野生型植株,转移至全蛭石中,置于培养箱中继续培养。待生长状态稳定后,分别施加全磷(正常霍格兰溶液)及低磷(磷含量为正常霍格兰溶液1%)霍格兰营养液,频率为1周/次,经过1个月的培养,观察其生长状态,并进行拍照分析。
2 结果
2.1 生物信息学分析
MtCIM(基因登录号:2723885)具有828 bp的开放阅读框,编码275个氨基酸。分子式为C1305H2002N354O406S13,蛋白分子量为29.563 kD,理论等电点为5.54。其中正电荷残基数为23,负电荷残基数为29;脂溶系数为75.16;不稳定系数为41.62,总平均亲水性为-0.178,结果表明,MtCIM是一个亲水性不稳定的蛋白。
二级及三级结构预测表明,MtCIM蛋白主要由无规则卷曲构成(图1),占二级结构总比例的49.09%,其中,α-螺旋占10.91%。同时,含有延伸链31.64%和β-转角8.36%。利用Signal 5.0网站进行MtCIM蛋白信号肽预测,结果(图2)显示,MtCIM存在信号肽(95.463%),定位于蛋白质的N端区域,信号肽序列为:MALTLEHAFSHILILLGLLSIFLVNPSF,类型:SP(Sec/SPI)。
对MtCIM上游的启动子序列进行顺式作用元件分析,结果显示,MtCIM的上游启动子区域除了含有核心启动元件TATA box,还存在多个光响应元件,如TCT-motif和G-BOX,防御和胁迫反应元件TC-rich repeats,以及参与厌氧诱导元件ARE等。同时,存在多种激素相关的反应元件,如ABRE、P-box、TGA-element,分别参与脱落酸、赤霉素、生长素的信号通路(表2)。该基因启动子区域分析表明,MtCIM可能在脱落酸、赤霉素、生长素响应或信号传导等方面发挥重要作用。

表2 MtCIM启动子的主要顺式作用元件Table 2 The main cis-acting elements of MtCIM promoter
2.2 亚细胞定位
在烟草叶片中瞬时表达MtCIM-GFP融合蛋白,并使用激光共聚焦显微镜下捕获荧光信号。结果(图3)显示,在细胞质中有强烈的荧光信号,表明MtCIM蛋白的亚细胞定位于细胞质中。
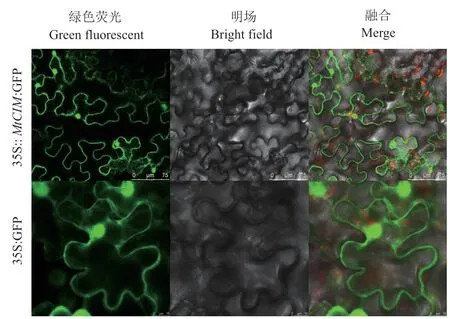
图3 MtCIM的亚细胞定位Fig. 3 Subcellular localization of MtCIM
2.3 表达分析
为探究MtCIM在不同激素处理下的表达特征,对蒺藜苜蓿分别喷施ABA、GA3、IAA激素,分析MtCIM在处理后12 h内的表达情况。结果(图4)表明,经ABA和GA3处理后,MtCIM表达量在短时间内快速升高,在10 min达到最高,随后便呈下降趋势;经IAA处理后,表达量整体呈现上升趋势,在处理1 h时达到最高水平,是未处理样品表达水平的4.22倍。
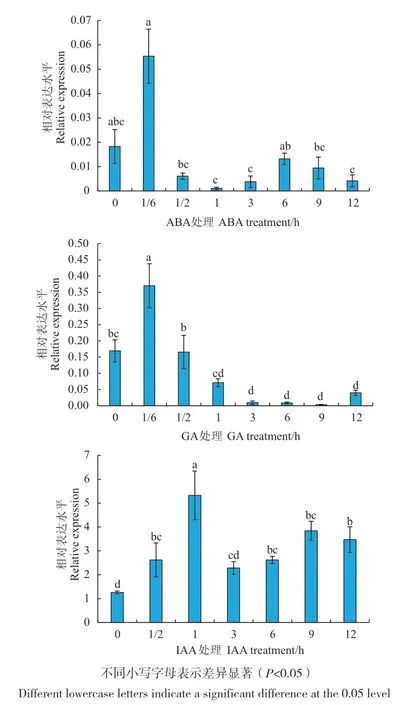
图4 不同激素处理下MtCIM在蒺藜苜蓿中的表达分析Fig. 4 MtCIM expression analysis in Medicago truncatula under different hormone treatments
2.4 转录自激活活性验证
为了研究MtCIM是否具有转录自激活活性,对MtCIM进行自激活活性验证(图5)。将pGBT7-CIM载体转入Y2Hgold酵母感受态后,将其接种在SD/-Trp培养基上发现,在SD/-Trp培养基上酵母菌落能正常生长。随后,挑取在SD/-Trp培养基上正常生长的阳性菌落,分别稀释10、100、1 000倍,点涂在SD/-Trp/-His/Ade培养基。30℃培养2-3 d后,pGBT7-CIM在SD/-Trp /-His/Ade培养基几乎无菌落生长。结果表明,CIM不具有自激活活性,可用于后续互作蛋白的筛选试验。

图5 pGBKT7-CIM转录自激活检测Fig. 5 Transcriptional self-activation testing of pGBT7-CIM
2.5 转基因植株叶片形态分析
通过对野生型和MtCIM过表达植株的叶片结构进行深入分析。结果(图6)显示,与野生型相比,转基因植株的叶片角质层厚度有所增加。在对照组叶片中,其细胞大小均匀一致,排列规整,并且呈椭圆形。然而,转基因植株叶片中的细胞呈现出不规则的排列模式。此外,比较发现,转基因植株的上表皮细胞和髓细胞数量较对照组明显减少。结果表明,在生长和发育过程中,转基因植株的细胞壁厚度有明显增加的趋势。
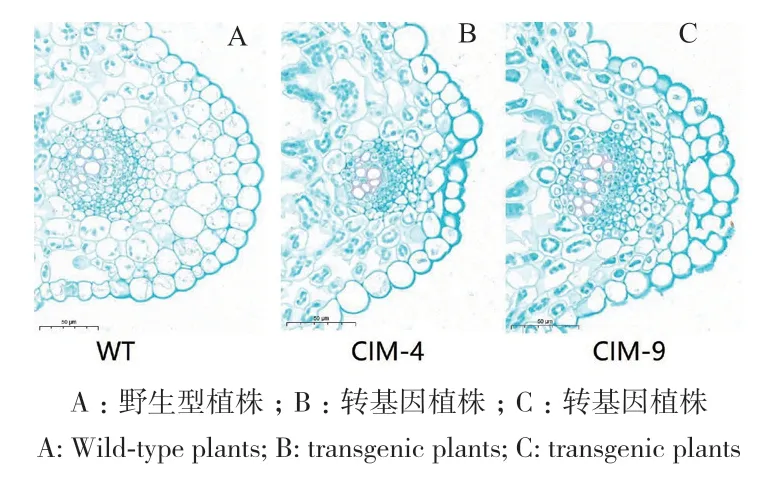
图6 番红固绿染色法对叶片结构的观察Fig. 6 Observation of leaf structure by saffred solid green staining method
2.6 转基因植株不同磷浓度处理
通过对实验室之前获得的20株转基因植株进行研究[18]。对转基因和野生型植株在同一时间进行扦插(图7-A, B),生长10 d后分别在全磷和低磷条件下进行培养(图7-C, D)。结果显示,在全磷条件下,转基因植株与野生型植株呈现相似的生长状态;而在低磷条件下,转基因植株生长状态较好,与野生型植株相比转基因植株生长速度较快,株高达到野生型植株的2倍左右。以上结果表明,与野生型相比,转基因植物更适应在低磷条件下生长。

图7 全磷和低磷处理下转基因和野生型植株差异Fig. 7 Difference between transgenic and wild type plants under total phosphorus and low phosphorus treatment
3 讨论
近年来,前人对CIM在其他物种中的功能进行了大量研究发现,CIM几乎参与调节植物生长发育的全部过程,尤其在调节植物细胞分子水平和组织器官水平过程中起到了至关重要的作用[14]。但在苜蓿中,关于CIM方面的研究还鲜见报道,CIM全长828 bp,编码275个氨基酸,其理化性质分析表明,CIM为亲水性不稳定的蛋白。亚细胞定位对蛋白质如何发挥其功能具有重要意义,蛋白质只有准确定位到其特定的位置上才能行使其功能[19]。本研究通过融合表达MtCIM-GFP来追踪目标蛋白质的亚细胞定位情况,利用烟草叶片瞬时表达方法,操作简单方便,瞬时表达率高。亚细胞定位结果显示,CIM蛋白定位在细胞质中,说明可能在细胞质中发挥其功能。
启动子位于基因的上游,调控着基因的转录起始,决定着转录的起始方向和转录效率[20]。同时,在启动子上也存在着许多与逆境和激素响应有关的顺式作用元件,这些顺式作用元件可以和反式作用因子相结合进行不同的基因表达调控[21]。因此,分析MtCIM顺式作用元件,对于研究该基因的表达调控具有重要意义。利用PlantCARE 软件分析CIM启动子区域发现,该启动子区域除了核心作用元件以外,还含有许多激素响应元件,如ABA响应元件ABRE、GA响应元件P-box和生长素响应元件TGA-motif等。生长素是最早发现的植物激素,具有促进植物的伸长生长、促进器官与组织分化,同时防止器官脱落等功能[22]。目前,一些研究已表明,Expansin蛋白能够响应生长素的诱导,在水稻中IAA能够影响多种Expansin蛋白基因的表达,其中包括诱导EXPA1、EXPB3和EXPB7上调表达[23]。在黄瓜中,CsEXPb1的表达受到生长素、细胞分裂素和赤霉素等激素诱导后均上调[24]。本研究中,ABA、IAA、GA3的激素诱导均能改变MtCIM的表达。因此,MtCIM的表达受到多种激素调控,并且可能通过激素网络来调控植物生长发育。
此外,该启动子区域还包含光响应元件G-Box、防御和胁迫反应相关的元件TC-rich repeats等。研究表明,Expansin蛋白在多种逆境胁迫中发挥至关重要的作用[25]。丁安明等[26]在烟草中发现,过表达NtEXPA12后,能促进烟草种子在ABA培养基上的萌发率,并增强在干旱胁迫条件下的生存。同时,过表达AtEXPA4的拟南芥植株也具有干旱及耐盐性的特征[27]。本研究发现,MtCIM启动子序列上有多种逆境胁迫相关元件并且MtCIM基因能够被ABA和IAA诱导。因此,推测MtCIM能够通过激素调控网络,参与植物逆境胁迫响应,进而影响植物生长发育。但MtCIM如何参与逆境胁迫响应机制还需要进一步研究。
近年来,研究发现Expansin蛋白能够参与调控植物细胞伸展和生长发育[28]。植物在缺少磷素时,通常会表现为生长缓慢、矮小、叶色暗淡无光泽[29]。Expansin蛋白在植物对磷的吸收方面也具有一定作用。在拟南芥中GmEXLB1[11]的过表达改变了其根系的结构,进而提高了拟南芥对磷的吸收。本研究发现,在低磷条件下,与野生型相比,转MtCIM苜蓿植株生长状态更好,生长速度更快,这说明MtCIM株系更能适应低磷环境。因此,推测MtCIM可能在低磷条件下提高紫花苜蓿对磷的吸收,促进植物的生长发育。
4 结论
低磷条件下,MtCIM能够促进紫花苜蓿的生长发育。另外,MtCIM可能通过ABA、IAA途径参与植物逆境胁迫响应机制,进而影响植物的生长发育。