森林根际土壤细菌的分离、鉴定及生物活性筛选
冯路遥 赵江源 施竹凤 莫艳芳,4 杨童雨,4 申云鑫,4 何飞飞李铭刚 杨佩文
(1. 云南大学资源植物研究院,昆明 650504;2. 云南省农业科学院农业环境资源研究所,昆明 650205;3. 云南大学云南省微生物研究所,昆明 650504;4. 云南农业大学植物保护学院,昆明 650201)
在集约化种植模式驱动下,常常通过施用过量的化学肥料来保持长时间的营养输入,以达到供应植物快速生长并保证营养充足和作物产量的目的[1]。但人们逐渐意识到化学肥料的施用只是一种短期的农业生产方式,易造成包括土壤板结、盐碱化、水分富营养化等在内的环境问题,迫切需要另一种营养供给方式来缓解并恢复常态化的、可持续的正常农作物生产环境[2]。而利用微生物的功能特性可实现促进土壤养分转化、构建健康土壤环境等多种有益作用,是实现绿色、可持续的农业环境的正确方向[3]。
植物根际微生物(plant growth promoting rhizobacteria, PGPR)作为一类栖息于植物根际的特殊微生物类群,能够通过解磷、固氮、解钾、拮抗病原菌、产铁载体、分泌IAA、ACC脱氨酶等多种生物机制直接或间接促进植物生长、提高植物的品质和产量[4]。Chouyia等[5]研究表明,用磷溶性微生物Streptomyces roseocinereus MS1B15接种大麦(Hordeum vulgare)能够有效提高其地上部、麦穗长度、麦穗叶片和根际土壤的氮磷含量。Romano等[6]研究表明,分离得到的Kosakonia pseudosacchari TL13和TL3 具有多种PGPR性状,还能够拮抗多种土源性植物病原体,对于番茄(Solanum lycopersicum)的定植和改善植物的生长起到了有效作用。另外,Chopra等[7]相关研究发现,从茶(Camellia sinensis)根际土壤中得到的菌株Brevibacterium sediminis A6具有促生抗病活性,能够生产生物表面活性剂,对水稻幼苗(Oryza sativa)的生长有着正向的影响。
目前微生物肥料依赖于核心微生物的功能,开发活性更强、针对性更强的微生物是发展生物肥料的重要需求[8]。在特殊的、多样性丰富的生态环境中更容易获得功能多样的功能菌株。无量山保护区作为云南省国家级的自然保护区,具有独一无二的森林生态环境,孕育了大量具有丰富多样性的生物资源。植物根际土壤中蕴含种类丰富的微生物资源,它们与植物之间进行物质、能量的交换,能够提高土壤中植物难以吸收利用物质的转化率,还可以分泌多种次生代谢物,降解土壤中的有害成分等,有助于创造出更加有益于植物和微生物生长的有利环境,蕴含较强的潜在农用价值,无量山根际土壤的特殊生境更易于发现高活性的菌株。
本研究从含有丰富微生物资源的无量山原始森林根际土壤中分离鉴定得到204株细菌,并从功能菌株中筛选得到两株功能多样化的菌株,对其多项生物活性进行探究,并通过促种子发芽实验和室内盆栽试验验证菌株对植株的促进生长能力,确定菌株的应用潜力。从独特的森林根际土壤环境下,筛选得到高活性多功能的根际微生物,并利用生物特性应用于农业生产实践中,有望取代化学肥料的营养支持作用,是一种生态友好、低消耗的替代措施,为可持续农业的发展提供有力的工具支持。
1 材料与方法
1.1 材料
1.1.1 供试土壤 土壤样品采自云南省普洱市景东彝族自治县无量山国家级自然保护区的25个地区的植株根际土壤,去除植株根际表面可见的杂物,挖取0-20 cm的土样,装入无菌袋中,于4℃冰箱中保存。
1.1.2 培养基的配置 参照引用文献配置的培养基包括无机磷培养基[9]、有机磷培养基[9]、固氮培养基[10]、无铁察氏(CAS)培养基[11]、DF(Dworkin and Foster)培养基[12]、溶锌培养基[13]。平板计数琼脂培养基(plate count agar, PCA)(g/L):胰蛋白胨5.0,酵母浸粉2.5,葡萄糖1.0,琼脂15.0,pH值7.0±0.2。生长素检测培养基[14]:蛋白胨20 g/L,甘油15 mL/L,K2HPO41.5 g/L,MgSO4·7H2O 1.5 g/L,色氨酸0.1 g/L,pH 7.2±0.2。1-氨基环丙烷-1-羧酸筛选(ADF)培养基[12]:将DF培养基中的硫酸铵替换为1-氨基环丙烷-1-羧酸(ACC)。
1.1.3 供试病原菌 烟草疫霉(Phytophthora parasitica var.nicotianae)、茎点霉(Phoma matteuciicola)、木贼镰刀菌(Fusarium equiseti)。由云南省农业科学院农业环境资源研究所提供。
1.2 方法
1.2.1 分离根际微生物的分离 采集云南省无量山国家级自然保护区的25个不同地区和植物的根际土壤,于无菌袋中4℃保存。取新鲜采集的土壤样品2 g于装有200 mL无菌水的500 mL锥形瓶中,放入适量玻璃珠,于30℃恒温摇床进行振荡培养4-6 h,吸取200 μL溶液以10-4、10-5浓度于PCA培养基上进行稀释涂板,挑选出活力较好的菌株。
1.2.2 菌株鉴定
(1)形态学和生理生化鉴定。观察菌株在PCA培养基上的生长形态和光学显微镜下的细胞形态,并参考《伯杰细菌鉴定手册》及《常见细菌系统鉴定手册》对菌株的生理生化包括革兰氏染色、过氧化氢酶、氧化酶、蛋白酶、淀粉酶、纤维素酶、生长pH范围、生长盐浓度范围、生长温度范围进行鉴定。
(2)分子学鉴定。采用chelex-100法提取细菌DNA[15],并将提取的DNA作为模板,使用通用引物PA(5'-CAGAGTTTGATCCTGGCT-3')和PB(5'-AGGAGGTGATCCAGCCGCA-3')进行16S rDNA序列的PCR扩增。PCR反应体系(25 μL)为基因组DNA 1 μL、PA(10 μmol/L)0.5 μL、PB(10 μmol/L)0.5 μL、Taq PCR Master mix 11 μL、ddH2O 12 μL。反应程序为95℃ 5 min,然后30-35个循环(95℃ 30 s,56℃ 30 s,72℃ 90 s),72℃ 10 min。将得到的PCR产物送往北京擎科生物科技股份有限公司测序,并在Ez biocloud(https://www.ezbiocloud.net/)上进行同源性比对,利用MEGA7.0构建系统发育树,并通过Bootstrap进行1 000次重复测试,结合生理生化结果,确定菌株分类地位。
1.2.3 根际微生物的功能筛选
(1)磷酸盐溶解功能筛选。将得到的菌株接种于无机磷和有机磷培养基,培养3 d后,挑取产生透明圈的菌株,并以十字交叉法测量透明圈直径(D)及菌落直径(d),以D/d来初步评估菌株的解磷强度。将筛选出的高活性菌株划线纯化后,以20%的甘油制成甘油管后于-80℃保藏。将纯化后的菌株接入300 mL的LB液体培养基中,以30℃、180 r/min振荡培养1 d后,制成种子液。将种子液以1%的量接种于100 mL无机磷液体培养基中,重复3次,在150 r/min、30℃环境下培养5 d。每隔24 h使用钼锑抗比色法测量可溶性磷的含量,并使用pH仪测量菌液上清液的pH值。
(2)固氮功能活性筛选。将待测菌株接入固氮培养基,于30℃恒温培养箱中倒置培养5 d后,若菌株产生透明圈,若出现,则证明菌株具有固氮功能,测量透明圈直径(D)及菌落直径(d),以D/d来初步评估菌株的固氮强度。
(3)溶锌功能活性筛选。将菌株接种于溶锌培养基,于30℃恒温培养箱中倒置培养5 d后,若菌株产生透明圈,则证明菌株具有溶锌功能,测量透明圈直径(D)及菌落直径(d),以D/d来初步评估菌株的溶锌强度[16]。
(4)分泌铁载体功能活性筛选。将待测菌株接种于CAS培养基中倒置30℃培养3 d,若出现明显的显色晕圈,则菌株具有分泌铁载体活性,测量透明圈直径(D)及菌落直径(d),以D/d来初步评估菌株的分泌铁载体强度。为确定菌株的产铁载体能力,将活性菌株接入100 mL CAS液体培养基,在30℃、160 r/min条件下振荡培养2 d,吸取2 mL菌液过0.22 μm无菌滤膜后加入2 mL CAS检测液,静置1 h后测定菌液OD630值(记作“As”),将空白CAS液体培养基的OD630值作为参比值(记作“Ar”)。铁载体的浓度用铁载体活性单位(siderophoreunit,SU)表示,计算方式如下公式所示[11]。
SU/%=(Ar-As/Ar)=×100%
(5)分泌吲哚乙酸功能筛选。菌株在NB培养基中培养24 h后,取1%接入KB培养基中,以30℃ 180 r/min振荡培养24 h后,吸取1 mL与4 mL Sackowcki’s显色剂混合,用分光光度计测定其OD535值,重复3次,以空白比色液OD535为零值,带入标准曲线,测得菌株的IAA产量[17]。
(6)分泌ACC脱氨酶功能筛选。采用ACC唯一氮源法,将活化菌株接种于以(NH4)2SO4为氮源的DF培养基上3-4 d后,将菌株转接到以ACC为氮源的ADF培养基上,重复接种于ADF培养基上,菌株若能够存活,则菌株具有分泌ACC脱氨酶功能。除此之外,还使用聚合酶链式反应检测菌株是否具有分泌ACC脱氨酶的关键基因acdS基因。使用简并引物acdSf3(5'-ATCGGCGGCATCCAGWSNAAYCANAC-3')和acdSr4(5'-GGCACGCCGCCCARRTGNRCRTA-3')进行acdS基因的PCR扩增。PCR反应体系(50 μL)为基因组DNA 2 μL、acdSf3(10 μmol/L)0.5 μL、acdSr4(10 μmol/L)0.5 μL、Taq PCR Master mix 25 μL、ddH2O 22 μL。反应程序为94℃ 4 min;94℃45 s,53℃ 45 s,72℃ 1 min,35个循环;72℃ 10 min[18]。将得到的PCR产物送往北京擎科生物科技股份有限公司测序,在DNA star软件上将序列翻译成蛋白质,并使用MEGA7.0进行多序列比对,使用Gene Doc美化序列比对结果,确认菌株具有分泌ACC脱氨酶的功能。
(7)拮抗病原菌功能筛选。采用平板对峙法,接种待测菌株于PDA平板两侧,病原菌菌饼倒置接种于平板中央,将只接种病原菌菌饼的平板设置为对照组。
真菌抑制率/%=(对照菌落直径-实验组菌落直径/对照组菌落直径-菌饼直径)×100%
1.2.4 菌株促生功能的验证 (1)菌株的促番茄种子发芽实验。本实验共设置2个对照组(CK1:施加无菌水,CK2:施加营养肉汤培养基)和4个处理组(T1:1 d菌株发酵上清液,T2:稀释10倍的发酵液上清液,T3:稀释102倍的发酵上清液,T4:稀释103倍的发酵上清液)。将较多的番茄种子放入水中,取沉淀到水下的种子在水中常温浸泡12 h后,取各组种子置于铺垫2-3层灭菌滤纸的9 cm透明培养皿中。每个处理每皿15粒种子,重复3次。对应处理的液体约2 mL将培养皿中的滤纸润湿后,于28℃人工气候箱培养7 d,每隔24 h需要加入无菌水将滤纸润湿。7 d后测得番茄种子萌发的个数和萌发种子的苗长度。
(2)番茄植株盆栽实验。本实验共设置2个对照组(CK1:施加无菌水,CK2:施加营养肉汤培养基)和3个处理组(T1:3 d发酵液,T2:稀释10倍的发酵液,T3:稀释102倍的发酵液)。番茄幼苗栽种后定植3 d后,对T1、T2、T3处理的每个盆栽添加200 mL的菌株发酵液,CK1的每个盆栽添加200 mL的无菌水,CK2的每个盆栽添加200 mL的无菌NB液体培养基。生长期间每3 d浇水1次,每隔7 d测量番茄植株的茎粗和地上部分高度,35 d测量所有实验组的植株地上部分长度、鲜重、干重、茎粗和地下部分的根长、根鲜重、干重。
(3)番茄植株根际土壤理化指标测定。测定种植35 d后的番茄根际土壤的常规8项理化指标,包括pH、有机质、全氮、全磷、全钾、碱解氮、速效磷、有效钾。参照鲁如坤等[19]《土壤农业化学分析方法》的方法进行测定。
1.2.5 数据处理 使用Mega7.0进行序列的同源性比对,DNA star软件进行核酸序列的翻译,Gene Doc软件进行多序列比对的可视化分析。对实验得到的数据使用SPSS 18.0软件的单因素方差分析(ANOVA)寻求不同处理组之间是否存在差异,并使用origin 2018进行图表绘制。
2 结果
2.1 根际菌株的分离鉴定
采用PCA培养基从无量山根际土壤中分离得到共204株。对分离菌株的16S rDNA基因序列进行比对发现,属于厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)3门32属,门水平和属水平的菌株分布如图1所示。属水平的优势类群为芽孢杆菌(Bacillus)、假单胞菌(Pseudomonas)、马赛菌属(Massilia)、普里斯特氏菌属(Priestia)、类芽孢杆菌属(Paenibacillus),其中芽孢杆菌占分离菌株占比最大为37.56%。从中选取32属的代表菌株构建的16S rDNA基因系统发育树如图2所示,代表菌株稳定分布于3门中的不同属内。
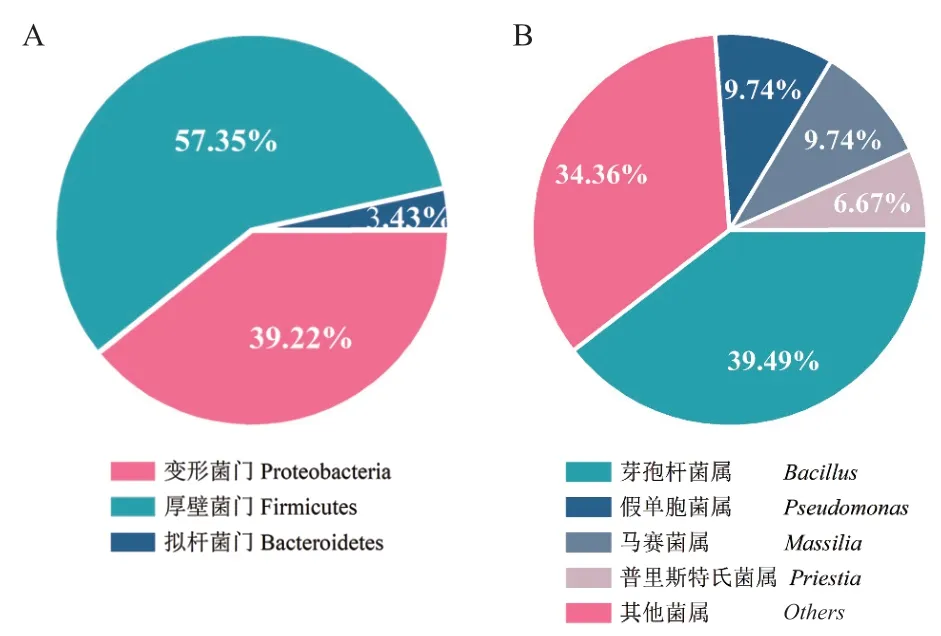
图1 无量山根际土壤可培养微生物门水平(A)和属水平(B)分布特征Fig. 1 Distribution characteristics of cultivable microbial phylum level(A)and genus level(B)of Wuliangshan mountain rhizosphere soil
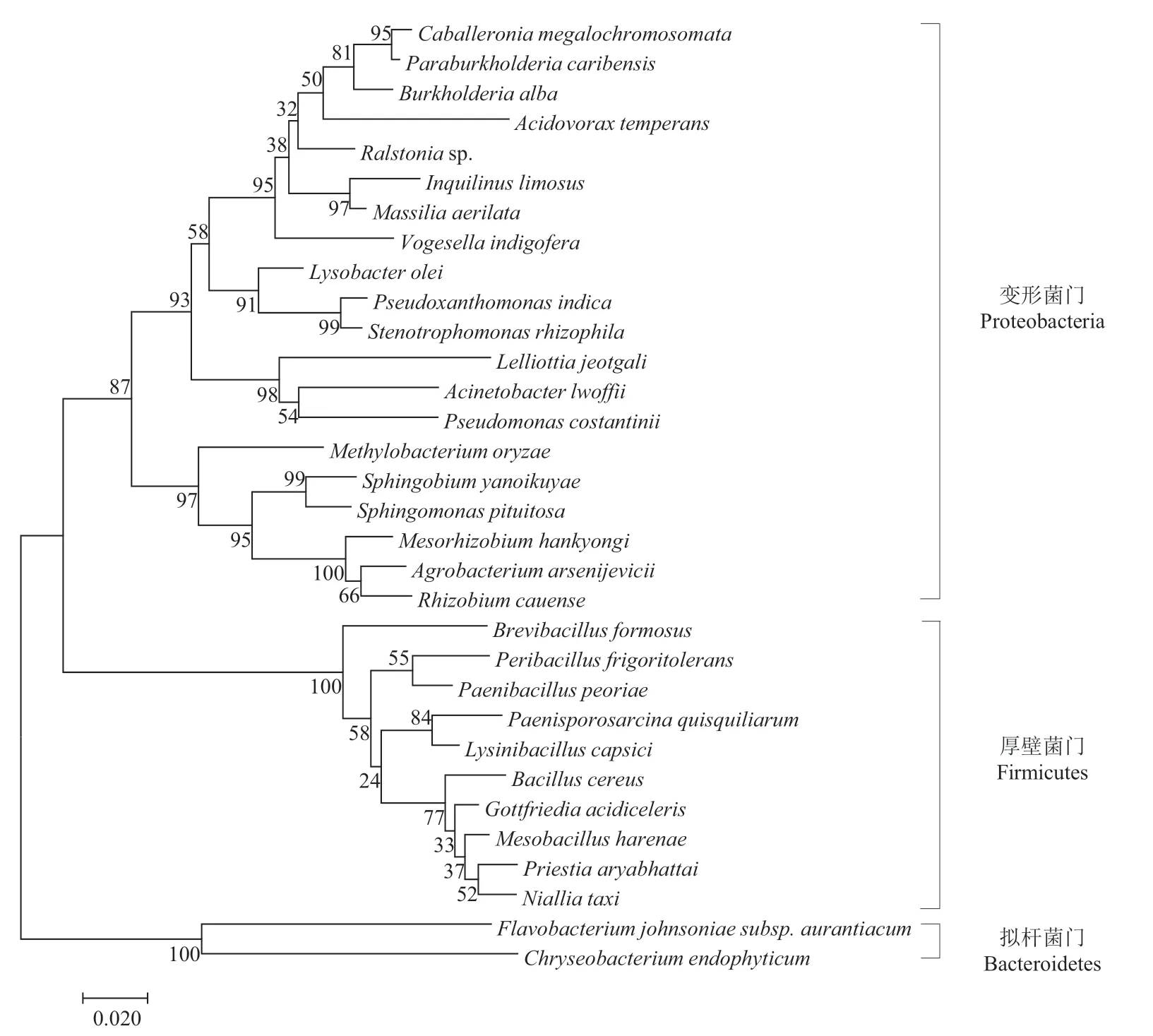
图2 无量山根际土壤中32属代表菌株基于16S rDNA基因构建的邻接法系统发育树Fig. 2 Phylogenetic tree of 32 genera representative strains in the Wuliangshan rhizosphere soil , constructed by neighbor-joining tree based on 16S rDNA gene
2.2 菌株功能筛选
从解磷、固氮、解钾、拮抗镰刀菌4个方面对分离得到的菌株进行活性检测。其中,解磷菌共有70株,固氮菌共有27株,解钾菌共有8株,拮抗镰刀菌的菌株共有51株,部分活性菌株具体功能活性见表1。其中芽孢杆菌属、假单胞菌属在上述4种功能都占据多数。挑选功能较多活性较强的菌株进行分泌铁载体、分泌吲哚乙酸、拮抗病原菌实验,成功选出两株具有上述功能的菌株YIM B08401和YIM B08402。
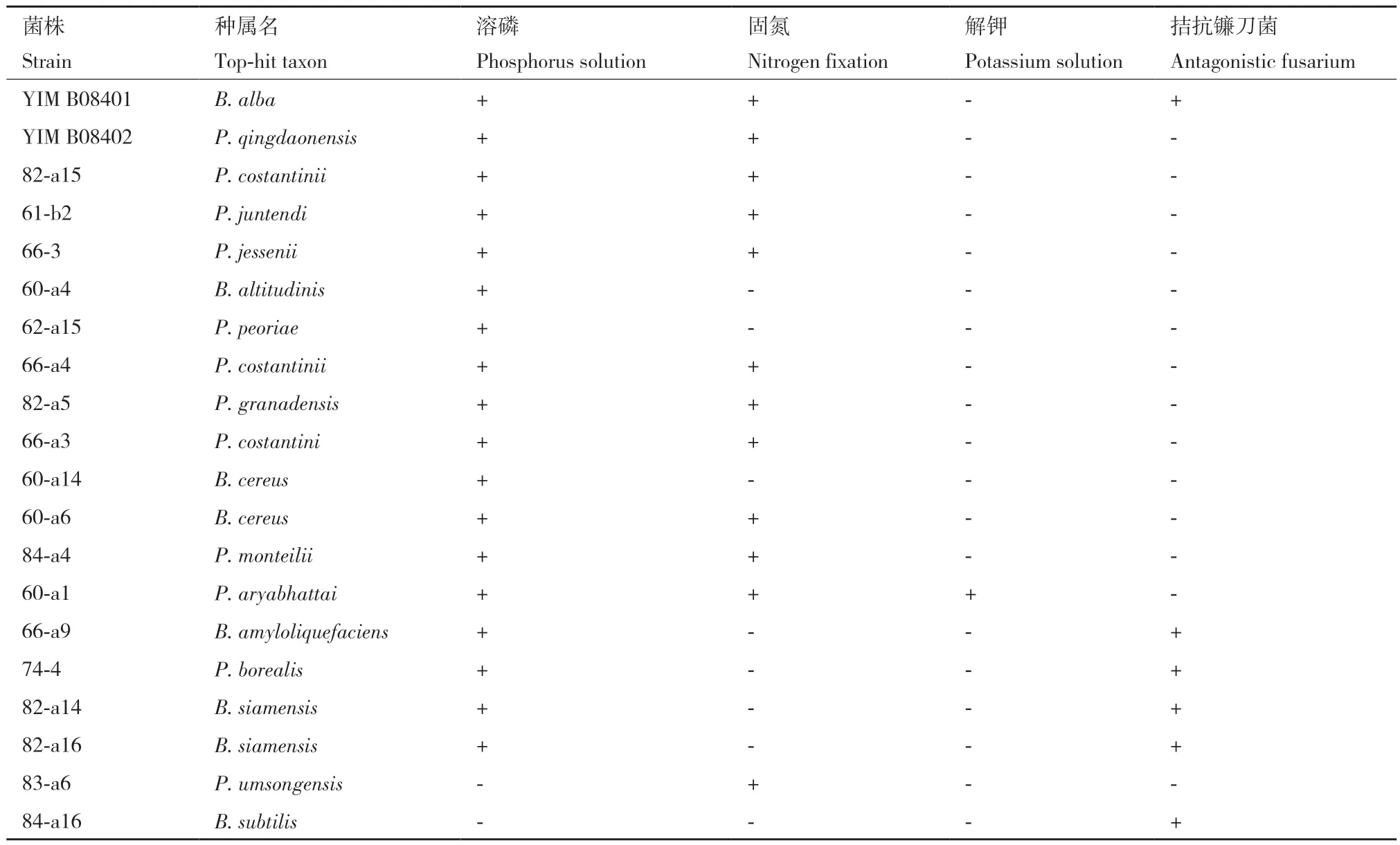
表1 部分活性菌株促生特性Table 1 Growth-promoting and disease-resistant properties of some active strains
2.3 功能菌株的鉴定
菌株YIM B08401和菌株YIM B08402分别从无量山的华山松(Pinus armandii)根际土壤(100°49'25″N,24°27'00″E)和酸模(Rumex acetosa)根际土壤(100°22'56″N,24°44'30″E)中,利用稀释涂布法从PCA培养基上成功分离得到。
菌株YIM B08401在PCA培养基上菌落呈现为近圆形,边缘不整齐,中间黄色边缘白色,湿润、有光泽。经光学显微镜鉴定为杆状菌。是革兰氏阴性菌,能在0-4%(体积质量分数)盐浓度、pH为4-8、10-40℃环境下生长,过氧化氢酶、氧化酶、蛋白酶阳性,淀粉酶、纤维素酶阴性。菌株YIM B08402在PCA培养基上菌落呈现为近圆形,边缘不整齐,黄色,湿润、有光泽。经光学显微镜鉴定为杆状菌。是革兰氏阴性菌,能在0-6%(体积质量分数)盐浓度、pH为6-8、4-40℃环境下生长,过氧化氢酶、氧化酶阳性,蛋白酶、淀粉酶、纤维素酶阴性。
将测序得到的16S rDNA基因在EZ biocloud数据库(https://www.ezbiocloud.net/)中进行比对,构建系统发育树(图3),结合形态学观察和生理生化实验,确认菌株YIM B08401是白色伯克霍尔德氏菌(Burkholderia alba),GenBank登录号为OR398962,菌株YIM B08402是青岛假单胞菌(Pseudomonas qingdaonensis),登录号为OR398963。
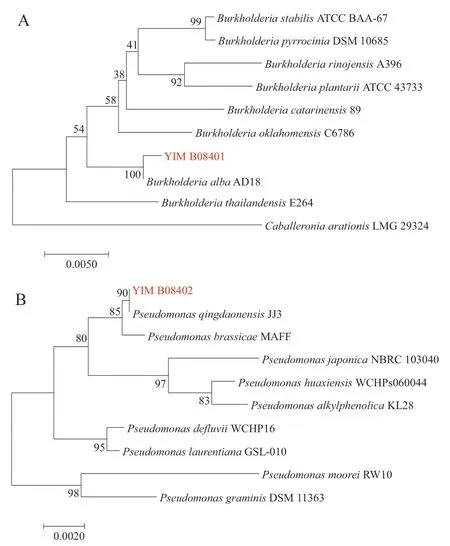
图3 菌株YIM B08401(A)和菌株YIM B08402(B)基于16S rDNA基因构建的邻接法系统发育树Fig. 3 Neighbor-joining trees of the strain YIM B08401(A)and YIM B08402(B)based on 16S rDNA gene
2.4 功能菌株促生抗病功能
对两个菌株进行功能筛选后发现,菌株YIM B08401具有磷酸盐溶解、固氮、溶锌、分泌铁载体和ACC脱氨酶、拮抗病原菌(烟草疫霉、木贼镰刀菌、茎点霉)的活性。菌株YIM B08402具有磷酸盐溶解、固氮、溶锌、分泌铁载体和吲哚乙酸的活性。
2.4.1 菌株营养转化活性分析 将待试菌株接种于无机磷培养基、有机磷培养基、固氮培养基、溶锌培养基,于30℃恒温培养箱中倒置培养3 d后,所有培养基均出现明显的透明晕圈(图4),并以D/d值判断菌株的营养转化能力(表2)。

表2 菌株的营养转化指数Table 2 Nutrient transformation indexes of the strain
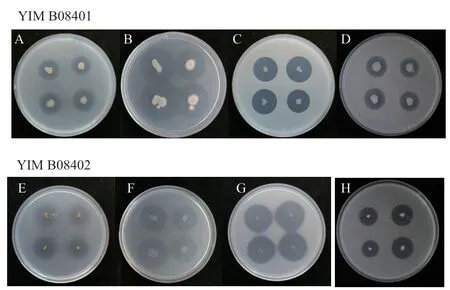
图4 菌株YIM B08401的溶磷(A)、解磷(B)、固氮(C)、溶锌(D)和YIM B08402的溶磷(E)、解磷(F)、固氮(G)、溶锌(H)效果图Fig. 4 Effect diagram of dissolved phosphorus(A), phosphorus solution(B), nitrogen fixation(C), zinc dissolution(D)of YIM B08401 and phosphorus dissolution(E), phosphorus solution(F), nitrogen fixation(G), and zinc dissolution(H)of YIM B08402
使用钼锑抗比色法定量测定5 d菌株的溶磷能力和pH值变化,结果如图5所示。菌株YIM B08401发酵液在第2天的可溶性磷含量达到最大为(455.63±59.65)mg/L,而pH值在第1天从7.00快速下降到(4.94±0.13)后一直上升。而菌株YIM B08402发酵液在第1天的可溶性磷含量达到最大为(878.95±64.78)mg/L,而pH值在第1天从7.00快速下降到4.50后一直上升,在第4天发酵液中不含有可溶性磷。

图5 菌株YIM B08401(A)和YIM B08402(B)发酵液可溶性磷含量及pH变化Fig. 5 Soluble phosphorus content and pH in the fermentation broth of the strain YIM B08401(A)and YIM B08402(B)
2.4.2 菌株分泌铁载体活性分析 接种于CAS培养基后出现明显红色晕圈(图6),证明菌株具有分泌铁载体的功能,经过定量实验确认菌株YIM B08401其铁载体含量为67.12%,菌株YIM B08402其铁载体含量为32.41%。
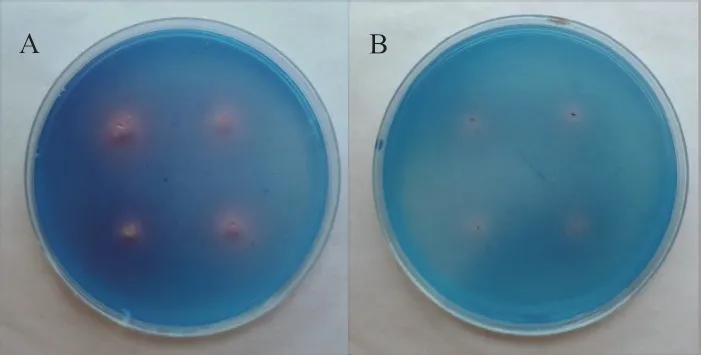
图6 菌株YIM B08401(A)和YIM B08402(B)的分泌铁载体效果图Fig. 6 Secretory siderophores of strain YIM B08401(A)and YIM B08402(B)
2.4.3 菌株分泌吲哚乙酸活性分析 经过定性实验(图7),菌株YIM B08401无分泌吲哚乙酸的功能,菌株YIM B08402能够分泌吲哚乙酸,其菌株发酵液通过与Sackowcki’s显色剂比色得到OD535,代入标准曲线算出其在第2天分泌的吲哚乙酸含量最高为(24.57±0.14)μg/mL。

图7 菌株YIM B08402的分泌生长素活性测定Fig. 7 Determination of IAA activity of strain YIM B08402
2.4.4 菌株分泌ACC脱氨酶活性分析 菌株YIM B08401能够在多次转接种到ADF平板上仍然能够存活,使用引物acdSf3和acdSr4进行PCR扩增后成功得到acdS基因片段,使用DNA star软件的Editseq应用将核酸序列翻译为蛋白质序列,并与具有ACC脱氨酶功能的菌株acdS基因的蛋白序列进行多序列比对及可视化(图8)。E(谷氨酸)295和L(亮氨酸)322是ACC脱氨酶所特有的,经过比对发现菌株YIM B08401同样在295和322位置上具有E和L,证明菌株YIM B08401具有分泌ACC脱氨酶的功能。菌株YIM B08402不具有分泌ACC脱氨酶的能力。

图8 菌株YIM B08401与具有ACC脱氨酶的菌株蛋白质序列的多序列比对Fig. 8 Multiple sequence alignment of proteins in strain YIM B08401 and strain with ACC deaminase
2.4.5 菌株拮抗病原菌活性分析 经过平板对峙实验,证明菌株YIM B08402不具有拮抗病原菌功能,而菌株YIM B08401可以有效拮抗病原菌(烟草疫霉、茎点霉、木贼镰刀菌),针对烟草疫霉的拮抗率达到了52.55%,对茎点霉的拮抗率达到76.68%,对木贼镰刀菌的拮抗率达到了69.84%(图9)。
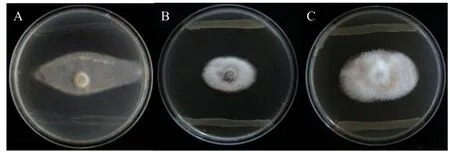
图9 菌株YIM B08401对烟草疫霉(A)、茎点霉(B)、木贼镰刀菌(C)的拮抗效果Fig. 9 Antagonistic effects of strain YIM B08401 against Phytophthora parasitica var. nicotianae(A), Phoma matteuciicola(B)and Fusarium equiseti(C)
2.5 菌株促生功能验证结果
2.5.1 菌株对番茄种子的促发芽效果 在发芽率方面,两个菌株施加了NB培养基的CK2都是发芽率最低的实验组,且明显低于施加清水的CK1。T1、T2、T3、T4均高于两个对照组的发芽,且稀释了1 000倍的T4处理均是萌发率最高的处理组。在苗长度方面,两个菌株的T1相较于CK1对照组存在明显抑制作用,施加稀释10倍的T2处理的苗长度显著高于其他处理组。其他处理组促进作用相近或弱于无菌水对照组,但均明显高于NB对照组。与CK1相比较,施加NB培养基的CK2对种子的萌发存在显著抑制作用(图10-11)。
图10 菌株YIM B08401(A)和YIM B08402(B)的各处理番茄苗Fig. 10 Tomato seedlings under each treatment by strain YIM B08401(A)and YIM B08402(B)
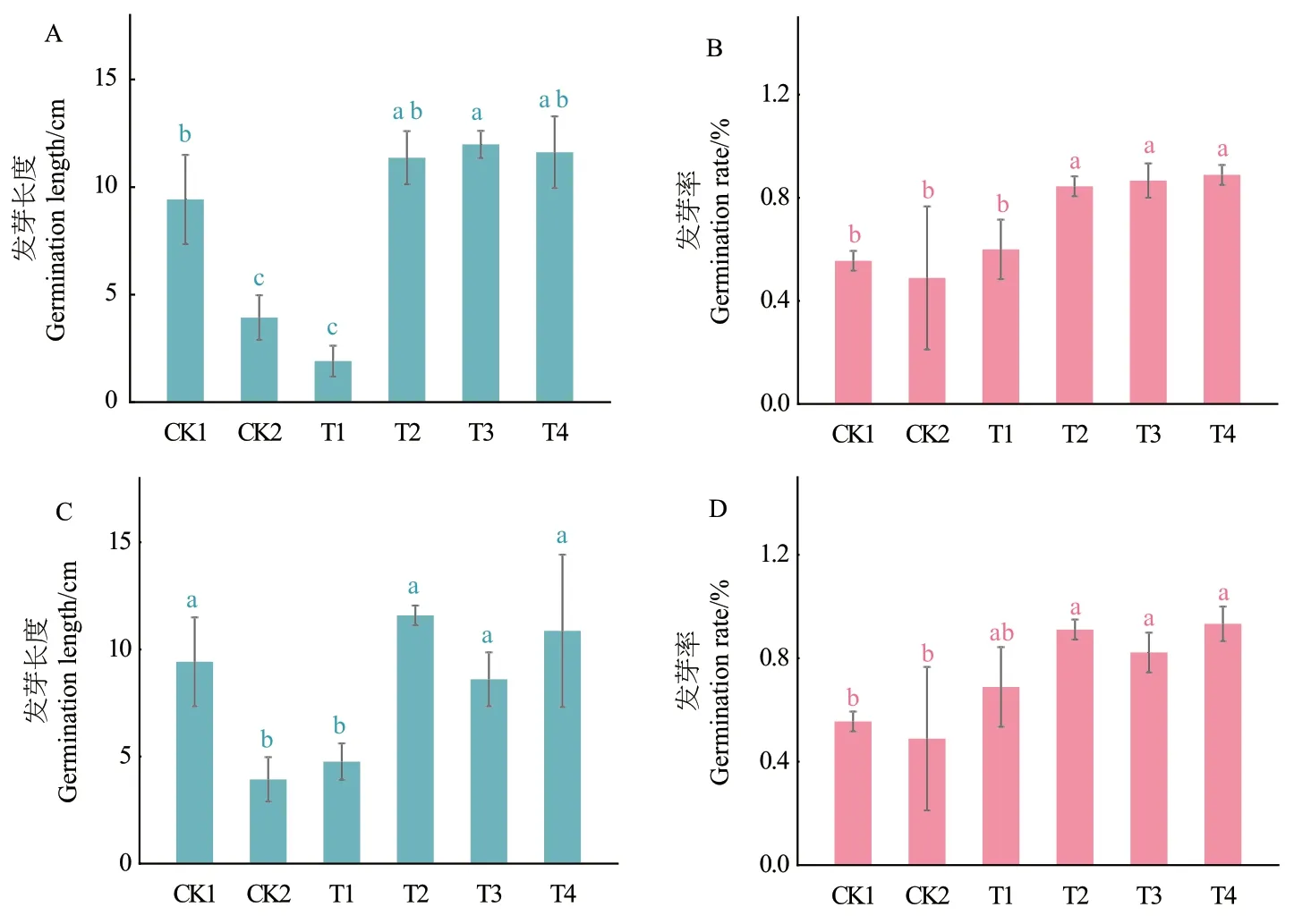
图11 菌株YIM B08401(A、B)和YIM B08402(C、D)的各处理番茄种子发芽长度和发芽率Fig. 11 Germination lengths and germination rates of tomato seeds of strain YIM B08401(A, B)and YIM B08402(C, D)
2.5.2 菌株对番茄植株盆栽促生效果 35 d的番茄盆栽实验结果(图12-13)表明,第35天施加了发酵液的处理相较于CK1和CK2具有显著差异(P<0.05)。其中菌株YIM B08401的T1处理组相较于对照组CK1,株高净增长量提高了89%,茎直径提高了62%,地上部分鲜重提高了495%,地上部分干重提高了268%,根长提高了53%,根鲜重提高了385%,根干重提高了469%,处理组和对照处理间具有显著差异(P<0.05)。而菌株YIM B08402的T1处理组的农艺指标方面相较于CK1株高净增长量提高了118%,茎直径提高了32%,地上部分鲜重提高了528%,地上部分干重提高了477%,根长提高了37%,根鲜重提高了413%,根干重提高了747%。施菌处理和对照处理间具有显著差异(P<0.05)。

图12 菌株YIM B08401(A)和YIM B08402(B)的各处理番茄植株Fig. 12 Tomato plants treated with strain YIM B08401(A)and YIM B08402(B)
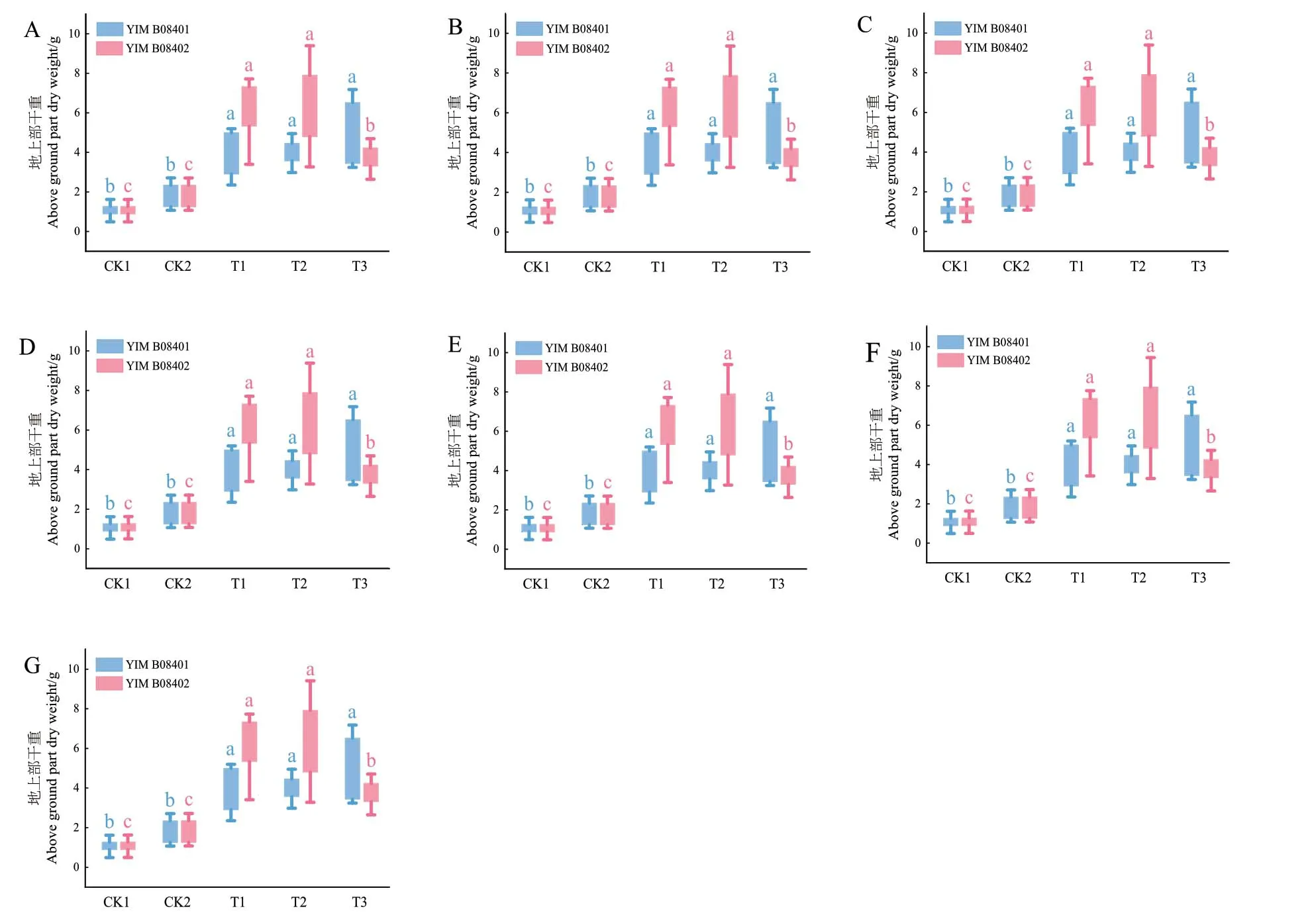
图13 菌株YIM B08401和YIM B08402各处理对番茄植株地上部鲜重(A)、地上部干重(B)、地上部长度(C)、根鲜重(D)、根干重(E)、根长(F)、茎粗(G)的影响Fig. 13 Effects on the fresh weight of above ground part(A), dry weight of above ground part(B), length of above ground part(C), fresh weight of root(D), dry weight of root(E), root length(F),stem diameter(G)of tomato plants under each treatment of strain YIM B08401 and YIM B08402
2.5.3 促生盆栽根际土壤理化指标 测定第35天两个菌株处理的根际土壤常规8项,结果(表3)表明,两个菌株的数据差异不大,处理组之间的pH值、全磷差异不大,T1的全钾、速效钾含量均高于两个对照组,而有机质、全氮、全磷、水解性氮、水解性氮的含量均低于对照组。

表3 番茄根际土壤理化指标Table 3 Physicochemical indexes in the rhizosphere soil of tomato plants
3 讨论
可持续发展一直是农业生产中追求的目标,通过微生物肥料来取代化学肥料是近年来受到广泛关注的话题,寻求功能丰富的菌株资源是开发新型生物肥料过程中的关键问题[20]。根际微生物作为一类生活在植物根际环境,与植物相互作用进行物质交换、能量流动的微生物类型,符合功能丰富菌株资源的要求。目前,促生微生物的分离主要以作物根际、内生环境等居多,森林根际土壤较少被采集用于促生微生物的分离,森林具有独特的生态环境,蕴育了丰富的微生物菌种资源,挖掘森林根际土壤可培养功能微生物是农用微生物资源开发的新方向。因此,本研究采集具有丰富生物多样性的云南省无量山国家级自然保护区的根际土壤,成功分离鉴定了204株细菌,从属于厚壁菌门、变形菌门和拟杆菌门3门32属,功能筛选出88株潜在活性的菌株,活性菌株的比例占据总分离的43.13%,功能微生物在森林根际土壤中含量较多。并选择两株功能更强更多样的白色伯克霍尔德氏菌YIM B08401和青岛假单胞菌YIM B08402作为主要的研究对象。
伯克霍尔德氏菌和假单胞菌是广泛报道的典型促生菌,伯克霍尔德氏菌中存在一类对植物或环境有益的物种,这类物种常常可以在根际土壤环境中被分离出来,究其原因可能是该类物种具有多种营养转化、分解代谢等功能,能够将植物根际分泌的产物进行转化分解,并提供植物其分泌的代谢产物,形成植物-微生物的循环共生生态环境[21-23],如Bhakat等[24]分离的越南伯克霍尔德氏菌(B.vietnamiensis)EIKU14可以转化不溶的氧化锌为植物所吸收,Zhang等[25]从茶叶(Camellia sinensis)根际土壤中分离得到的伯克霍尔德氏菌能够将不溶性钾转化为可溶性钾,提高了多项茶树农艺数据,增加了叶片多酚含量。参照多个伯克霍尔德氏菌的研究指向,探究本研究是否存在同样的功能作用,结果发现,本研究的白色伯克霍尔德氏菌YIM B08401磷酸盐溶解、固氮、溶锌、分泌铁载体、分泌ACC脱氨酶方面都有着较高的活性,应用于番茄种子和植物后都有显著的促进效果,相较于其他伯克霍尔德氏菌促生功能更加全面。此外,菌株YIM B08401还具有拮抗病原菌的功能活性,在促进植物生长的同时还可以起到抵御病原菌侵袭的作用,是值得更进一步发掘的微生物资源。
根际土壤中存在的假单胞菌为了更好在根际范围争夺养分,会趋向于通过抗菌、刺激植物防御机制和争夺生态位和养分,或利用磷酸盐和铁的溶解、固氮、植物激素调节和增加非生物胁迫耐受性等机制在根际环境生存且与植物互利共生,因此假单胞菌属在根际环境中会显示出更丰富的多样性[26]。Mohapatra等[27]发现Pseudomonas bharatica CSV86可以代谢芳香代谢物、分泌铁载体和吲哚乙酸。参照其他研究者的针对这两个属的功能研究方向,有助于发现新的功能[28]。本研究的青岛假单胞菌YIM B08402分别在解磷、固氮、溶锌、分泌铁载体、分泌吲哚乙酸方面都有着较高的活性,是值得应用于农业生产的具有较大应用潜力的活性菌株。
截至2023年,已有10 175个农业农村部正式登记的微生物肥料产品,采用的菌株多为芽孢杆菌、木霉等常见的功能菌株,使用伯克霍尔德氏菌和假单胞菌作为菌种的产品分别仅有3种和64种,且都未查到有以白色伯克霍尔德氏菌和青岛假单胞菌为菌种的正式登记微生物肥料[29],依靠本研究中的功能探究结果,菌株YIM B08401和YIM B08402是具有开发成为微生物肥料的潜力菌株。但本研究只涉及功能研究,并未对菌株的安全性进行验证,对于菌株是否能够开发成为正式登记的微生物肥料还有待后续的实验补充及大田验证。
后续还将对两个菌株进行全基因组的测序,利用目前发展迅速的生物信息工具对菌株的隐藏潜力进行挖掘,包括分析其是否能够耐受重金属[30-32];是否具有分泌胞外多糖和生物膜等与定植根际环境相关的潜力,并结合荧光定量方法探索菌株在植物根际环境的定植能力强弱[33];以及通过antiSMASH、PRISM 4和BAGEL 4等数据库揭示细菌中可能存在的天然次生代谢产物[34-36]。除此之外,还将实验验证两个菌株之间的生物相容性,了解菌株复合之后是否能够具有与单个菌株相同或更好的生物活性,辅以其他成分,以复合菌株体系的形式应用于实验中,探索其是否具有开发成微生物肥料的应用潜力,为菌株的开发应用提供较为广阔的发展方向。
4 结论
从无量山根际土壤筛选得到88株活性菌株,其中两株高活性菌株B. alba YIM B08401和P.qingdaonensis YIM B08402,均能溶解磷酸盐、固氮、溶锌、分泌铁载体,YIM B08401还具有拮抗病原菌和分泌ACC脱氨酶的功能,YIM B08402还能分泌IAA。菌液处理后发芽率和发芽长度分别提高了33%-44%和4.67-8.05 cm,并使得番茄植株的农艺性状数据增加了37%-747%,其根际土壤的理化指标间接证明菌株的促生能力显著,为微生物肥料的制备提供了潜在的优良菌株资源。
——固氮微生物