bHLH96的克隆及其在薄荷萜烯生物合成调控中的功能
王斌 袁晓,2 蒋园园 王玉昆 肖艳辉 何金明
(1. 韶关学院生物与农业学院 广东省粤北食药资源利用与保护重点实验室,韶关 512005;2. 华南农业大学园艺学院,广州 510642)
萜烯类化合物是植物中种类最多的次生代谢产物,几乎存在于所有植物中,具有广泛的药理活性,例如抗炎、抑菌杀菌、抗疟疾和抑制肿瘤等活性[1],但植物体内萜烯类物质含量低是普遍存在的问题。因此,通过基因工程的方法调控萜烯类化合物的生物合成,提高含量或改良萜烯组成,改良植物种质资源,对于增强萜烯类化合物的药理活性具有重要意义。唇形科(Labiatae)植物广泛分布于中国各地,是我国常用的传统中药材之一,在全球范围内已记录的唇形科植物有200余属和3 500余种[2]。
薄荷(Mentha haplocalyx Briq.)是唇形科薄荷属植物,是一种具有很高经济价值的芳香植物[3]。薄荷自1977年载入《中国药典》后一直收载至今,具有提高人体细胞渗透性、改善精神疲劳、消炎、祛痰以及促进术后排气等多种作用[4]。薄荷还可与牛蒡子、连翘、金银花等草药配伍,以治疗风热感冒或温病初起;与白芷石膏、川芎等配伍,可用于治疗风热上攻,如头晕和眼花;与当归、白芍、柴胡等草药组合,对治疗肝气郁结有较好疗效[5]。
根据分子结构中含有的异戊二烯单元数,萜烯可细分为单萜、倍半萜、二萜、二倍半萜、三萜、四萜、多萜。尽管部分植物如迷迭香、红豆杉等植物中的二萜和三萜含量也比较高,但大部分植物中的萜类物质主要以单萜和倍半萜化合物为主,其他类型萜的种类和含量相对较少[6-8]。植物萜烯合成均起始于2个C5异戊二烯单元的前体物质,即异戊烯基焦磷酸(isopentenyl pyrophosphate, IPP)和3,3-二甲基丙烯基焦磷酸(dimethylallyl pyrophosphate,DMAPP)[9]。IPP和DMAPP在细胞质中由甲羟戊酸(mevalonate pathway, MVA)途径合成,在质体中由2-C-甲基-D-赤藓糖醇-4-磷酸(2-C-methyl-D-erythritol-4-phosphate, MEP)途径合成[1]。细胞质中主要负责倍半萜和三萜等的生物合成,质体中主要负责单萜和二萜等的合成[10]。但植物萜烯的生物合成是一个极度复杂的过程,萜烯的合成速率和流向还受到萜烯合成酶(terpene synthase, TPS)的直接调控,而TPS表达则直接受转录因子等反式作用因子的调控。
转录因子是一类可直接调控基因表达的反式作用因子,研究表明,TPS表达受许多转录因子的调控。如番茄中SCL(scarecrow-like)家族转录因子SlSCL3通过激活相关TPS的表达,正向调控多种挥发性萜的合成[11]。柑橘CitERF71转录因子通过激活CiTPS16表达,从而调控甜橙香叶醇的合成和释放[12]。作为最大的转录因子家族之一,bHLH在调控植物萜烯合成中具有重要作用[13-14]。拟南芥bHLH家族转录因子AtMYC2直接与AtTPS21和AtTPS11的启动子结合,激活其表达并促进倍半萜的合成[15]。黄花蒿AabHLH1能直接与AaADS和AaCYP71AV1启动子中的E-box顺式元件结合,促进青蒿素的生物合成[16]。但bHLH转录因子家族基因是否参与薄荷萜烯的生物合成,以及其具体调控哪些萜烯组分的合成,国内外少有相关研究报道。
薄荷地上部组织中含有种类和含量丰富的萜烯化合物,尤其以叶片中的萜烯含量最高。在分析前期转录组数据时,鉴定了一个在薄荷叶片中高表达的bHLH转录因子基因,命名为bHLH96。
本研究从薄荷叶片中克隆出了bHLH96全长序列,分析亚细胞定位和序列特性,并在叶片中分析瞬时过表达对薄荷TPS表达与萜烯含量的影响,为通过代谢或基因工程改良薄荷种质提供重要基因资源,拓展有关植物挥发性次生代谢产物合成途径与调控机制的认识。
1 材料与方法
1.1 材料
供试薄荷品种为‘恒进高油’,种植于韶关学院生态园芳香植物基地,通过扦插方式无性繁殖。将薄荷茎秆用无菌剪刀剪成长度为5 cm左右的小段,用1∶800的多菌灵溶液浸泡消毒处理薄荷茎段5 min,扦插在混合育苗基质(草炭土∶蛭石=1∶1)上待生根发芽。分别在2020年和2021年3-4月份育苗,当扦插的薄荷小苗生长至10 cm高度时开展后续试验。
1.2 方法
1.2.1 薄荷叶片和茎的转录组测序 扦插生根的薄荷幼苗长至20 cm时,将叶片和茎组织单独收集,用于转录组测序分析。将来自于6株植株的新鲜茎和叶片分开收集在50 mL的离心管中(3个重复,各重复单独取样),液氮速冻,-80℃保存。转录组测序由北京百迈客生物科技有限公司进行。
使用天根生化科技(北京)有限公司的总RNA提取试剂盒(产品编号:DP441)提取总RNA。用琼脂糖凝胶电泳检测总RNA的纯度和完整性,利用上海翌圣生物科技有限公司的反转录试剂盒(产品编号:11141ES)合成cDNA。cDNA文库构建、转录组测序、基因功能注释等步骤详见文献[17]。
测序完成后,将测序结果推送至百迈客云(https://www.biocloud.net/),利用该云平台分析转录组测序数据。差异表达基因的筛选标准为:差异倍数(fold change, FC)≥2.0,q值≤0.01。使用FPKM(fragments per kilobase of exon model per million mapped fragments)值表示基因表达水平[17],利用TBtools软件根据FPKM值绘制薄荷叶片和茎中差异表达的bHLH家族基因的表达热图。
1.2.2 bHLH96全长序列的克隆 根据转录组测序组装的序列预测编码区序列(coding sequence, CDS),利用NCBI在线工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast)设计全长特异引物(表1)。以叶片cDNA为模板,使用生工生物工程(上海)股份有限公司的2×高保真PCR Mix(产品编号:B639292)扩增bHLH96全长序列。反应体系:25 μL的2×高保真PCR Mix预混液、正反向引物各2 μL、2 μL的cDNA溶液和19 μL ddH2O。PCR扩增条件:95℃ 3 min;95℃ 15 s,58℃ 15 s,72℃ 1 min,35个循环;72℃ 5 min。当反应至33个循环时,在每个反应体系中加入10 μL的普通Taq PCR Mix 预混液(产品编号:B639295),在PCR产物末端加A尾,以使PCR产物能与T载连接。

表1 引物信息Table 1 Primer information
PCR产物经凝胶电泳后回收,与pUCm-T载体连接,构建克隆重组载体,转化DH5α大肠杆菌感受态细胞,筛选阳性克隆进行测序。
1.2.3 亚细胞定位 使用BamH I内切酶将pBI121-GFP载体线性化。将bHLH96全长序列(不含终止密码子)正向插入到pBI121-GFP载体的BamH I酶切位点处,构建含GFP报道蛋白的亚细胞定位重组载体,由CaMV35S启动子驱动bHLH96表达,引物信息见表1。重组质粒转化DH5α感受态细胞,扩繁重组质粒,经测序验证后转化GV3101农杆菌感受态。之后使用真空渗透法将阳性单克隆农杆菌打入本氏烟草叶片,试验用本氏烟草为转mCherry蛋白的转基因烟草。共培养48 h后,使用正置荧光显微镜(德国蔡司,型号:Axio Imager Z2)观察转基因烟草叶片细胞中的mCherry和GFP荧光。
1.2.4 氨基酸序列特性分析 将bHLH96蛋白序列提交至NCBI数据库中blast,比对得到与该蛋白同源性高的候选蛋白。在候选蛋白中挑选与bHLH96蛋白同源性高的4种模式植物(野生稻、拟南芥、烟草和番茄)的bHLH96蛋白序列,利用DNAMAN v6软件的多序列比对功能绘制氨基酸序列比对图片。
在PlantTFDB网站(http://planttfdb.gao-lab.org/index_ext.php)下载拟南芥bHLH家族基因的氨基酸序列,鉴定出与薄荷bHLH96蛋白亲缘性最高的拟南芥bHLH蛋白。在NCBI数据库中查找唇形科植物bHLH家族蛋白,利用获得的氨基酸序列,使用MEGA7软件中的邻接法(neighbor joining, NJ)进行系统发育分析。MEGA7软件中bootstrap值设置为1 000次,其余参数均为软件默认。根据bootstrap值将植物bHLH蛋白划分为不同亚类,亚类分组的阈值为50次。利用WebLogo网站(http://weblogo.berkeley.edu/logo.cgi)分析bHLH蛋白保守结构域的保守性。
1.2.5 荧光定量PCR(RT-qPCR)分析 使用美国Bio-Rad公司的RT-qPCR仪(型号:CFX Connect)分析基因表达情况,RT-qPCR反应体系:cDNA溶液1 μL、正反向引物各1 μL、PCR mix 10 μL和ddH2O 7 μL。反应程序:95℃ 5 min;95℃ 10 s,58℃ 20 s,72℃ 20 s,40个循环。在反应的最后增加溶解曲线,按照仪器默认参数增加溶解曲线。以薄荷Actin(NCBI登录号:KR082011.1)为内参基因,通过2-△△Ct法根据Ct值计算特定基因的表达量[17]。
1.2.6 薄荷叶片中瞬时过表达bHLH96 将bHLH96全长序列正向插入到pBI121-GUS载体的BamH I酶切位点处构建重组pBI121-bHLH96。利用真空渗透法将含重组质粒(OE)和pBI121空载质粒(CK)的GV3101农杆菌分别侵染薄荷叶片,在薄荷叶片中瞬时过表达bHLH96。每处理各使用6株幼苗(约20 cm)用于瞬时过表达分析,每株薄荷选取3-4片幼嫩叶片用于注射农杆菌(老叶细胞壁较厚,农杆菌渗透液不易渗入)。薄荷叶片注射了农杆菌后,在黑暗环境下培养24 h,之后转移至光周期为16/8 h(光/暗)、温度为25℃的环境中继续生长。在7 d时收集叶片,检测挥发性化合物含量和TPS表达的变化。通过顶空固相微萃取法(GC-MS型号:7890B-5977B,安捷伦科技公司)检测薄荷叶片中挥发性化合物的种类及含量。
1.2.7 数据分析 在Excel 2016软件中汇总整理试验数据,并绘制柱形图以及分析数据间的相关性。使用SPSS 22软件中的Student's t-test法检验2组样品间的差异显著性(P≤0.05),各处理或组织包含3个独立的生物学重复。
2 结果
2.1 薄荷bHLH基因在不同组织中的表达
通过比较分析叶片和茎的转录组学差异,共鉴定到21个bHLH基因在叶片和茎中差异表达。其中,仅bHLH7、bHLH87和bHLH96在叶片中高表达,另外18个bHLH基因在茎中高表达(图1-A)。推测3个在叶片中高表达的bHLH基因可能正向调控萜烯的生物合成,本研究重点探究bHLH96在薄荷萜烯合成中的调控作用。

图1 薄荷bHLH家族基因的表达模式及bHLH96的表达Fig. 1 Expression patterns of bHLH family genes and bHLH96 expression
转录组测序分析结果显示,叶片中bHLH96表达量比茎中的表达量高2.59倍(图1-B)。为验证转录组测序结果的可靠性,采用RT-qPCR法检测根、茎和叶片中bHLH96的表达情况(图1-C),bHLH96在根中的表达量最低,在叶片中的表达量最高,在叶片中的表达量比茎中高3.34倍,总体与转录组结果一致。尽管bHLH96在薄荷不同组织中组成型表达,其表达模式表现出明显的组织特异性,且在叶片中显著高表达,这与挥发性萜烯化合物主要在叶片中合成积累的特性是一致的。初步表明薄荷bHLH96表达与萜烯化合物的含量正相关,可能参与薄荷萜烯类化合物的合成调控。
2.2 薄荷bHLH96全长的克隆
转录组测序组装的薄荷bHLH96全长包含861 bp。以薄荷叶片cDNA为模板,通过RT-PCR法扩增bHLH96全长序列。结果显示,在750-1 000 bp间有一条DNA条带(图2-A),DNA片段大小符合预期。菌落PCR结果(图2-B)表明,成功获得转化重组质粒的阳性单克隆菌落。经测序,获得薄荷bHLH96的核苷酸序列,推导其氨基酸序列(图3)。
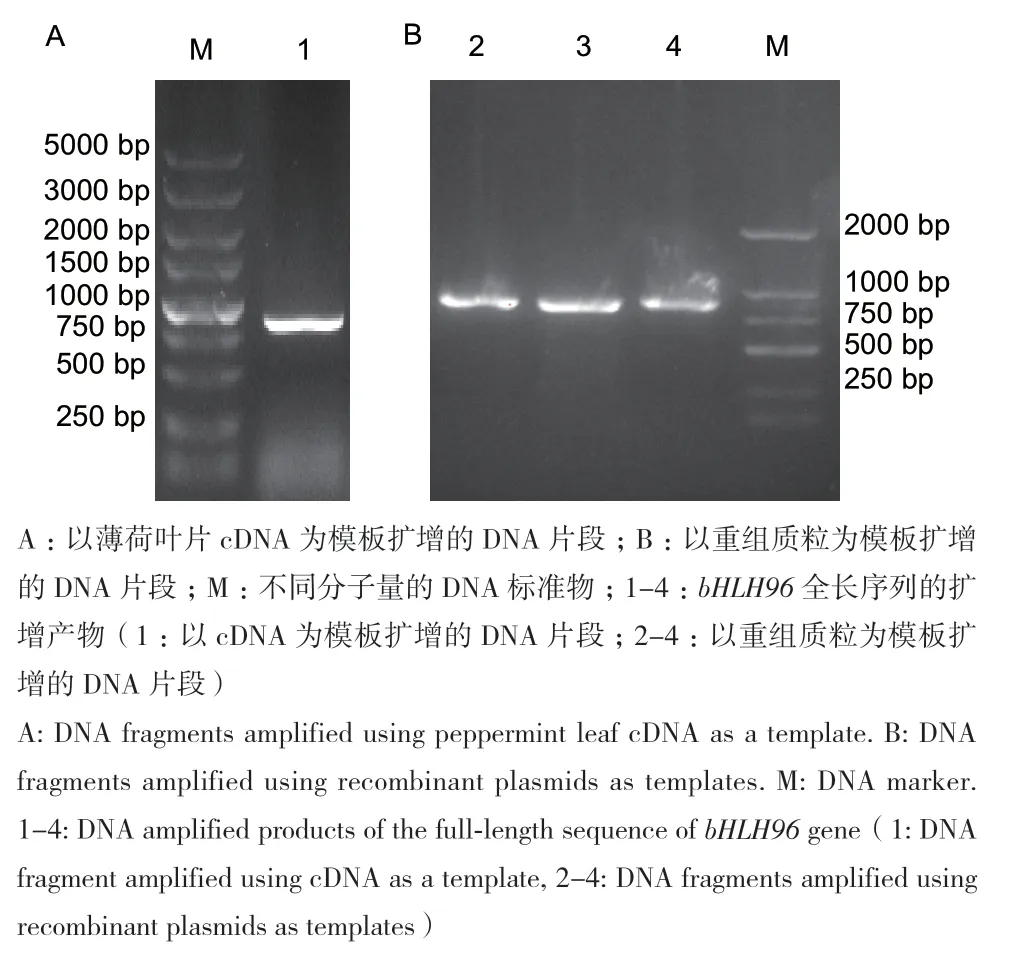
图2 薄荷bHLH96的PCR扩增产物电泳图Fig. 2 Electrophoresis maps of PCR amplification products of peppermint bHLH96 gene

图3 薄荷bHLH96的核苷酸序列(浅绿色背景)和推导的氨基酸序列(浅蓝色背景)Fig. 3 Nucleotide sequence(light green background)and the deduced amino acid sequence(light blue background)of peppermint bHLH96 gene
2.3 薄荷bHLH96蛋白的亚细胞定位
mCherry蛋白具有核定位信号[18]。通过观察mCherry和GFP蛋白的定位发现,pBI121空载的mCherry蛋白定位在细胞核,GFP蛋白定位在细胞质。但在bHLH96-GFP重组质粒中,mCherry和GFP蛋白均定位在细胞核(图4)。表明bHLH96是一个核定位蛋白,符合转录因子定位在细胞核、在细胞核中发挥转录调控作用的特性。
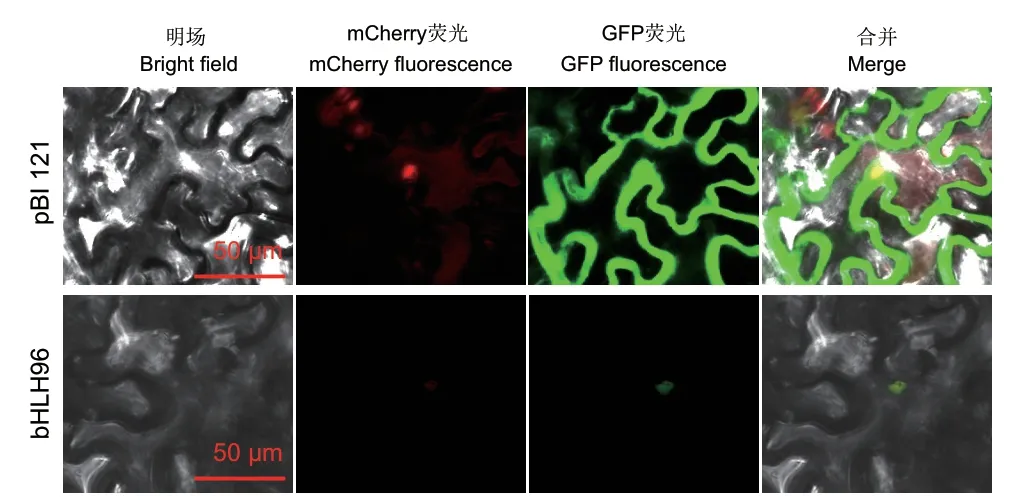
图4 薄荷bHLH96转录因子的亚细胞定位Fig. 4 Subcellular localization of peppermint bHLH96 transcription factor
2.4 薄荷bHLH96氨基酸多序列比对和系统发育分析
为分析薄荷bHLH96蛋白的功能保守性,比较其与4种模式植物(野生水稻、拟南芥、烟草和番茄)bHLH96蛋白的氨基酸序列相似性。5种植物的bHLH96蛋白序列中均含有一个bHLH保守结构域(图5-A),且保守结构域的保守性很高(图5-B)。薄荷bHLH96蛋白的氨基酸序列与烟草bHLH96和番茄bHLH96的同源性最高,分别为55.74%和52.73%,与野生水稻和拟南芥bHLH96的氨基酸序列一致性均低于50%。番茄bHLH96与烟草bHLH96蛋白的氨基酸序列一致性最高,为73.68%(表2)。这是因为番茄和烟草同属于茄科植物,亲缘关系更近,序列相似性也更高。薄荷bHLH96与4种模式植物的氨基酸序列相似性较低,意味着bHLH96在植物中具有复杂多样的生物学功能,bHLH96在薄荷中的生物学功能可能有别于拟南芥等模式植物。

图5 薄荷bHLH96与模式植物bHLH96氨基酸序列比对(A)和保守结构域保守性分析(B)Fig. 5 Amino acid sequence alignment(A)and conservation analysis of conserved domain(B)of peppermint bHLH96 and bHLH96 from model plants
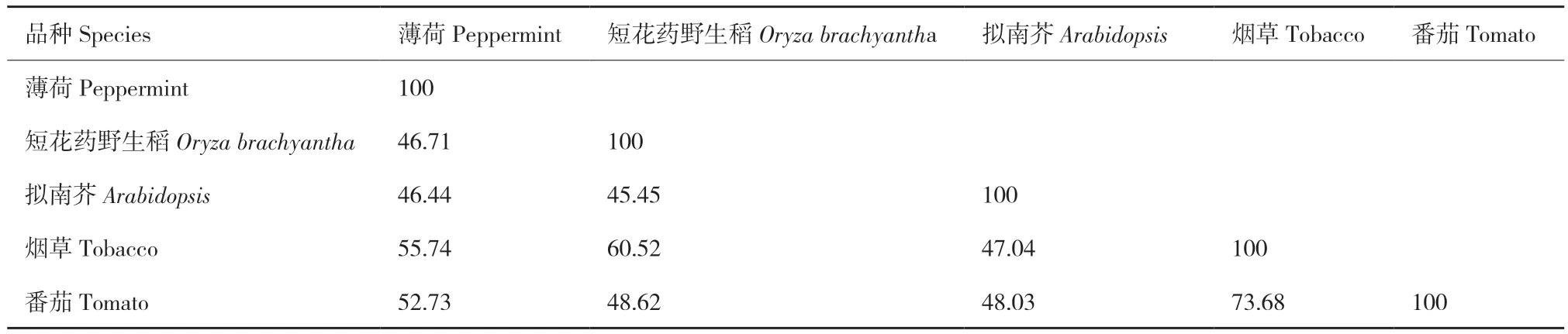
表2 不同植物bHLH96氨基酸序列一致性比较Table 2 Comparison in the amino acid sequences of bHLH96 proteins in different plant species%
在拟南芥bHLH家族中,AtbHLH96(登录号:AT1G72210.1)和AtbHLH94(登录号:AT1G22490.1)与薄荷MbbHLH96蛋白的亲缘关系最近。唇形科植物以富含萜烯化合物而著称[19]。为从系统发育角度证明薄荷bHLH96参与萜烯合成调控,利用拟南芥AtbHLH96和AtbHLH94的氨基酸序列,以及唇形科植物bHLH家族蛋白的氨基酸序列进行了系统发育分析。
根据bootstrap值可将植物bHLH蛋白划分为2个亚类(图6)。其中,薄荷MhbHLH96与同属于唇形科的鼠尾草(Salvia hispanica)ShbHLH96、丹参(Salvia miltiorrhiza)SmbHLH94、薰衣草(Lavandula angustifolia)LaMYC4等bHLH蛋白,以及拟南芥AtbHLH96和AtbHLH94聚在同一分支,丹参SmbHLH10与SmbHLH148聚在另一分支。说明薄荷bHLH96与薰衣草LaMYC4的亲缘关系较近,可能与LaMYC4具有相似的生物学功能。
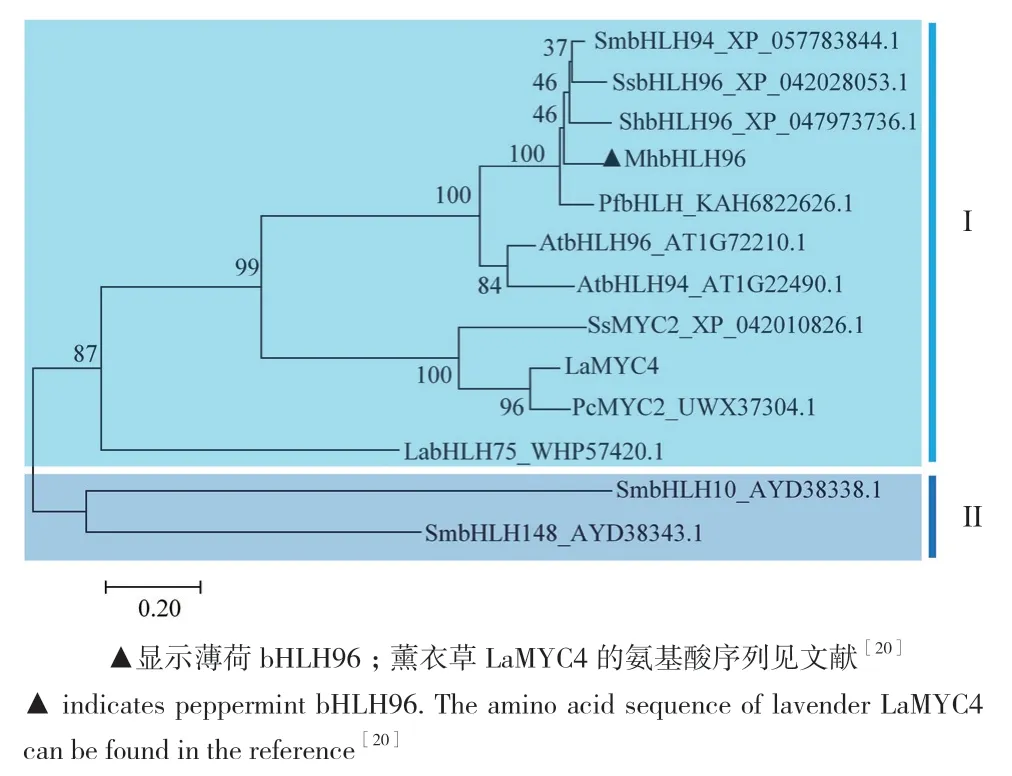
图6 植物bHLH蛋白系统发育分析Fig. 6 Phylogenetic analysis of plant bHLH proteins
2.5 过表达薄荷bHLH96对叶片萜烯含量的影响
为探究bHLH96是否会影响萜烯化合物的合成,在薄荷叶片中瞬时过表达bHLH96,研究过表达bHLH96对薄荷萜烯含量的影响。与只过表达空载pBI121的对照(CK)相比,过表达bHLH96尽管没有显著影响薄荷醇(menthol)等薄荷特征性挥发性组分的相对含量,但显著影响15种萜烯化合物的相对含量(表3)。其中,OE中11种挥发性化合物的含量显著高于CK,4种挥发性化合物的含量显著低于CK。对降低(±)-薄荷酮[(±)-pulegone]含量的作用最明显,表明bHLH96影响薄荷萜烯化合物的合成。

表3 CK和OE薄荷叶片中的挥发性化合物种类和相对含量Table 3 Types and relative contents of volatile compounds in the leaves of CK and OE peppermint seedlings
2.6 过表达薄荷bHLH96对萜烯合成相关基因表达的影响
由于过表达bHLH96显著影响薄荷萜烯化合物的相对含量,为此分析过表达bHLH96对TPS相关基因表达的影响。在OE样品中,bHLH96表达量显著高于CK(图7-A),表明bHLH96在薄荷叶片中成功过表达,OE样品中其他基因表达发生变化是由bHLH96表达增加引起的。瞬时过表达bHLH96显著上调5个TPS的表达,分别是2,3-氧化鲨烯环化酶基因OC2(2,3-oxidosqualene cyclase 2)、角鲨烯单加氧酶基因SM1(squalene monooxygenase 1)、贝壳杉烯合成酶基因KS1(kaurene synthase 1)、(+)-新薄荷醇脱氢酶基因ND[(+)-neomenthol dehydrogenase]和内根-贝壳杉烯酸氧化酶基因EAO1(ent-kaurenoic acid oxidase 1);显著下调3个TPS基因的表达,依次是橙花叔醇/芳樟醇合酶基因NLS1(nerolidol/linalool synthase 1)、异薄荷二烯酮还原酶基因iPR[(-)-isopiperitenone reductase]和柠檬烯合成酶基因LS(limonene synthase)(图7-B-I)。表明转录因子bHLH96通过影响TPS基因相关基因的表达,控制萜合成速率和流向,从而调控萜烯类化合物的生物合成。
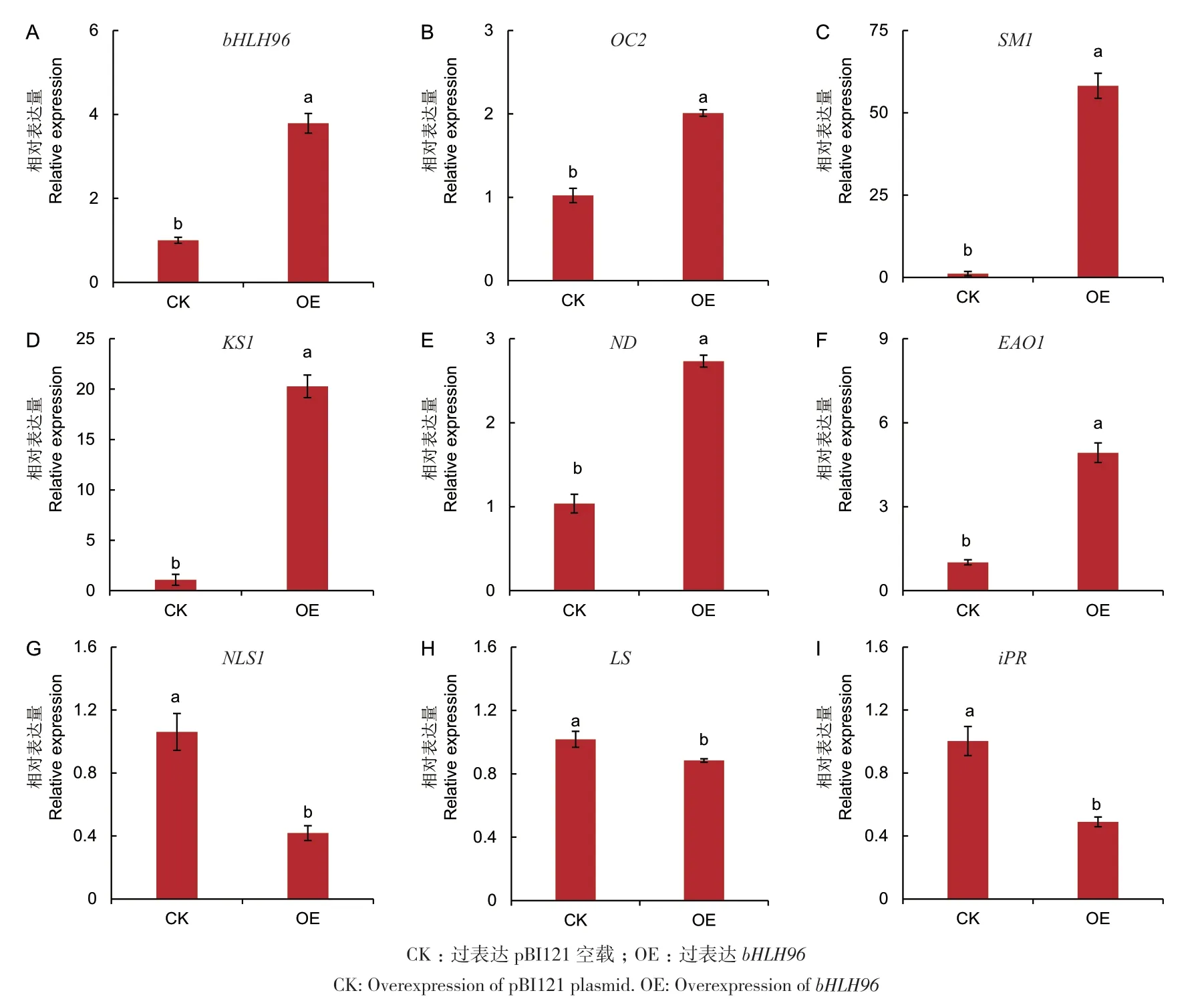
图7 薄荷叶片中瞬时过表达bHLH96对相关TPS基因表达的影响Fig. 7 Effects of transient overexpression of bHLH96 in the peppermint leaves on the expressions of TPS genes
2.7 可能受bHLH96调控的TPS基因表达与萜烯含量的相关性分析
为明确过表达bHLH96导致15种萜烯含量发生变化是否由相关TPS基因表达量改变引起,分析TPS基因表达与萜烯含量的相关性。15种萜烯物质的含量与8个TPS基因的表达量间具有明显相关性(附表1),且相关性很高,表明bHLH96过表达引起上述萜烯物质含量变化与TPS基因表达密切相关。对萜烯化合物含量而言,bHLH96表达与(E)-2-已烯醛[(E)-2-Hexenal]含量的正相关性最高(R2=0.98),与异胡薄荷醇(isopulegol)含量的负相关性最高(R2=-0.99)。对TPS基因表达而言,bHLH96表达与SM1和KS1表达的正相关性最高(R2=1.00),与iPR表达的负相关性最高(R2=-0.98)。说明bHLH96可能正向调控与其表达呈正相关性的TPS基因,负向调控与其表达呈负相关性的TPS基因,也再次证实一些萜烯含量发生变化是由bHLH96表达量增加引起。
3 讨论
bHLH转录因子是植物最大的转录因子家族之一,在植物生长发育、信号转导、逆境胁迫反应和次生代谢产物合成调控中具有重要作用[21-23]。植物精油主要在腺毛(trichome)中合成并贮存,而腺毛主要在叶表皮形成并分泌,尽管茎中也含有少量腺毛,但数量甚微[24-25],暗示着在叶片中高表达的bHLH基因可能调控萜烯物质的生物合成。比较转录组学分析或许能鉴定到一些调控萜烯合成的关键bHLH家族基因。为此,本研究利用比较转录组学分析了bHLH基因家族在薄荷不同组织中的表达模式发现,薄荷bHLH96在叶片中的表达量显著高于茎中的表达量,RT-qPCR结果也证实bHLH96在叶片中的表达量最高,推测bHLH96可能参与薄荷萜烯化合物的生物合成调控。薄荷是热带、亚热带地区重要的经济作物,茎叶通常用于提取精油或作为中草药,具有很高的经济价值和药用价值[26]。但由于品种杂合度高,无性繁殖体细胞容易变异,使得不同品种间的薄荷精油组分差异很大,直接影响精油质量和药用价值。因此,克隆bHLH96并探究其在薄荷萜烯化合物合成中的调控作用,对于丰富bHLH基因家族的生物学功能具有重要意义,能为薄荷遗传改良提供重要候选基因。
本研究从薄荷叶片中克隆到了bHLH96的全长序列,其编码含有286个氨基酸的蛋白质。氨基酸多序列比对结果显示,本研究所比对植物bHLH96蛋白的氨基酸序列中均含有一个bHLH保守结构域,表明薄荷bHLH96属于植物bHLH转录因子超级家族中的一员。植物bHLH96蛋白的保守结构域保守性很高,但保守结构域外的其他序列存在较大差异,反映在不同植物bHLH96蛋白的氨基酸序列一致性相对较低,这可能是不同植物面对的生长环境和气候条件存在较大差异的原因。植物面对复杂多变的生长环境和生物与非生物胁迫,可能导致保守结构域外的其他序列发生了一定程度的突变,以适应环境变化。薄荷bHLH96定位在细胞核,与其他植物bHLH蛋白定位在细胞核的特性一致[27-29],表明薄荷bHLH96在细胞核中发挥转录调控作用。薄荷bHLH96与薰衣草LaMYC4等唇形科植物bHLH家族蛋白聚在一个分支,亲缘关系很近。LaMYC4被证实直接调控薰衣草中萜烯的生物合成[20],说明薄荷bHLH96与LaMYC4具有相似的生物学功能,其可能在薄荷萜烯合成调控中具有重要作用。
许多研究表明,植物bHLH家族转录因子参与次生代谢产物的合成调控,MYC类转录因子是研究最多的bHLH转录因子[14]。拟南芥AtMYC2是一个bHLH家族转录因子,在拟南芥中过量表达AtMYC2可显著增加腺毛数目,进而促进腺毛中萜烯类物质的合成[30]。长春花CrMYC1和CrMYC2能与异胡豆苷合成酶(strictosidine synthase, STR)基因启动子序列的G-box元件结合,直接调控长春花中萜类吲哚生物碱的生物合成[31]。在紫杉中也鉴定到了1个MYC转录因子,能与二萜紫杉醇合成途径中紫杉二烯合酶(taxadiene synthase, TS)基因的启动子结合,调控靶基因的表达[32]。本研究中,在薄荷叶片中瞬时过表达bHLH96显著增加11种萜烯化合物的含量,降低4种萜烯含量,显著上调5个TPS基因的表达,下调3个TPS基因的表达,且受bHLH96影响的TPS基因的表达与萜烯的含量呈明显相关性,证明bHLH96调控薄荷萜烯化合物的生物合成。
植物萜烯合成速率和流向直接受萜烯合成酶的控制[33],KS和EAO参与植物二萜类物质的合成调控。KS催化柯巴基焦磷酸(ent-copalyl diphosphate)生成贝壳杉烯[34]。EAO可催化内根-贝壳杉烯酸向GA前体转化,GA是典型的二萜类物质[35]。OC是三萜化合物生物合成的关键酶,能将柔性的线性底物精准地催化环化生成不同骨架结构的三萜产物[36]。本研究中,在薄荷叶片中瞬时过表达bHLH96显著上调OC2、KS1和EAO1等二萜和三萜合成基因的表达,表明bHLH96正向调控二萜和三萜化合物的合成。NLS、iPR和LS等萜烯合成酶是控制薄荷单萜合成的关键酶[37]。ND是一种单萜脱氢酶,参与(+)-新薄荷醇等单萜的合成[38]。本研究中,过表达bHLH96显著下调单萜合成酶基因iPR、LS和NLS1的表达,却上调ND1的表达;降低异胡薄荷醇和(±)-薄荷酮等单萜的含量,提高己醛(hexanal)和α-蒎烯(α-pinene)等单萜物质的含量,表明bHLH96复杂地调控薄荷单萜类物质的合成。结果表明,薄荷bHLHL96通过调控TPS基因的表达,控制萜烯合成流向。因此,通过在薄荷中调控bHLH96表达,能丰富薄荷挥发性萜烯物质的种类和相对含量,改善薄荷精油中萜烯类化合物组分,从而改良薄荷的药用价值。但bHLH96是如何调控这些TPS基因的表达的,尚需通过酵母单杂、双荧光素酶报道基因实验等分子生物学研究手段进一步明确。
4 结论
薄荷bHLH96属于植物bHLH转录因子超级家族,是一个核定位蛋白,可能在细胞核中发挥转录调控作用。植物bHLH96蛋白的保守结构域保守性很高,薄荷bHLH96与同属于唇形科的薰衣草LaMYC4的亲缘关系较近。在薄荷叶片中瞬时过表达bHLH96显著影响8个TPS基因的表达,影响15种萜烯化合物的相对含量,表明可能通过调控TPS基因表达,控制萜烯合成流向,从而调控萜烯物质的合成。
文章所有附表数据请到本刊官网下载(http://biotech.aiijournal.com/CN/1002-5464/home.shtml)。