13例卵巢癌肉瘤临床特征分析及相关文献回顾
邢笑宇,史惠惠,邓学利,韩丽萍
(郑州大学第一附属医院妇科,郑州 450052)
卵巢癌肉瘤(ovarian carcinosarcoma,OCS),也称为恶性混合米勒肿瘤(malignant mixed Müllerian tumor,MMMT)或恶性混合中胚层肿瘤,发病率较低,约占卵巢癌的1%~3%,与其他卵巢上皮性癌相比,OCS恶性程度更高,预后差,易复发,5年生存率不足30%[1]。由于其罕见性,目前缺乏对该疾病的大规模前瞻性研究,对OCS的标准化诊断和治疗策略仍未达成共识。本文通过回顾分析OCS患者的临床资料,旨在对该病的临床诊治提供一定的参考。
1 资料与方法
1.1 研究对象 2014年1月至2020年12月郑州大学第一附属医院收治13例OSC患者,占同期卵巢癌的0.55%(13/2348)。病例信息及随访记录完整,诊断由肿瘤组织病理证实。
1.2 研究方法 采用2014年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)卵巢癌分期系统来确定肿瘤分期。回顾分析13例患者的临床表现、肿瘤标志物、影像学特点、病理特点、治疗方式及预后。采用电话及门诊复查进行随访,随访时间截至2023年5月31日。
1.3 统计学处理 采用SPSS26.0统计学软件。计量资料采用中位数进行描述,计数资料描述采用频数、百分比进行描述。采用Kaplan-Meier法进行单因素生存分析,Log-rank检验比较生存差异。P<0.05为差异有统计学意义。
2 结 果
2.1 临床特征 13例患者中位年龄62岁(32~79岁),均因腹痛或腹胀就诊,部分患者伴发腹部包块纳差或排便困难。患者均有不同程度的糖类抗原CA125(carbohydrate antigen 125,CA125)升高,中位数值487.72U/mL(48.84~15690U/mL)。10例患者检测血清人附睾蛋白4(human epididymis protein 4,HE4)及糖类抗原199(carbohydrate antigen 199,CA199),其中7例HE4不同程度升高,中位数值690.0U/mL(266.0~>1500U/mL),5例CA199不同程度升高,中位数值277.1U/mL(45.875~4747U/mL)。患者临床资料见表1。

表1 患者临床特征及单因素生存分析结果
2.2 影像学检查 13例患者均行超声或CT检查。肿瘤最大直径小于10cm者(中位数值7.5cm)3例,10~20cm者(中位数值15.4cm)9例,大于20cm者1例。在超声或CT上多表现为形态不规则,边界不清。超声图像显示3例为实性包块,10例为囊实性包块,其中4例以实性为主。彩色多普勒血流显像(color doppler flow imaging,CDFI)提示实性部分可见点线状血流信号或稍丰富血流信号。CT图像多表现为囊实性肿块影或软组织肿块影,密度不均匀,不均匀强化。1例患者CT表现为不规则肿块影,边界锐利,似见完整包膜,内见脂肪密度影及片絮状高密度影,占位效应存在,诊断为畸胎瘤,见图1。
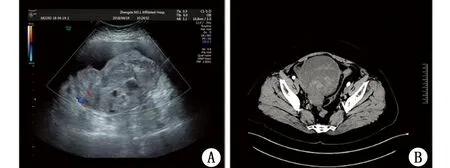
图1 误诊为畸胎瘤患者的超声及CT图像
2.3 病理特征 肿瘤大体呈实性或囊实性,切面呈灰白色、灰红色或灰黄色,质软到中,可伴有出血或坏死。癌组织成分主要为高级别浆液性癌,少见鳞状细胞癌。肉瘤成分可见横纹肌肉瘤、异源软骨肉瘤和(或)骨肉瘤分,另有1例含有卵黄囊瘤成分。上皮来源标志物:广谱细胞角蛋白(pan-Cytokeratin,AE1/AE3)(13/13)、细胞角蛋白7(cytokeratin 7,CK7)(12/13)及上皮膜抗原(epithelial membrane antigen,EMA)(13/13)免疫组化结果多阳性,细胞角蛋白20(cytokeratin 20,CK20)多阴性(12/13);癌成分标志物:波形蛋白(Vimentin)(13/13)、p16(9/10)、配对盒基因8(paired box 8,PAX-8)(11/12)多阳性表达。此外,p53阳性者8例(8/13),8例患者报告雌激素受体(estrogen,ER)和孕激素受体(progesterone,PR)的免疫组化结果,阳性者6例。13例患者的增殖标记物(ki-67)指数均较高,12例患者ki-67指数≥50%。
2.4 治疗方式 10例患者初治行手术治疗,减瘤满意者(残存肿瘤灶≤2cm)8例,减瘤不满意者(残存肿瘤灶>2cm)2例。1例患者因双下肢血栓形成先行新辅助化疗4次而后接受了满意的肿瘤细胞减灭术。1例年轻女性(32岁)因术时视野大范围水肿、质硬,仅行右侧附件切除术+大网膜活检+阑尾切除术+盆腔淋巴结活检术。1例高龄患者(75岁)因发现多发转移仅行盆腔穿刺术。10例患者术中清扫淋巴结,淋巴结转移者2例且均为腹主动脉旁淋巴结。13例患者均行辅助化疗。10例患者接受了4~8次紫杉醇类+铂类化疗方案;2例患者接受含蒽环类药物(异环磷酰胺+多西他赛/多柔比星)的化疗方案;1例患者接受静脉注射白蛋白紫杉醇化疗方案,但因化疗副反应较重,仅化疗3次。
2.5 随访结果 13例患者均进行了随访,中位随访时间17个月(5~93个月),截至2023年5月31日,10例患者死亡,3年生存率38.5%,5年生存率23.1%。8例患者在化疗结束后的17个月内复发。3例患者在行满意的肿瘤减灭术后进行了6~8次紫杉醇类+奈达铂化疗,分别于术后37个月、67个月和89个月复发。2例患者未见复发征象,其中1例患者术后行多柔比星脂质体+异环磷酰胺化疗5次,术后虽未检测出BRCA1/2基因突变,但目前口服尼拉帕利维持治疗中,现术后45个月,1例患者术前行紫杉醇脂质体+顺铂新辅助化疗4次,术后继续进行了4次化疗,现化疗结束69个月。单因素生存分析发现,化疗次数≥4次是影响患者预后的因素(P=0.017)。见表1。
3 讨 论
3.1 流行病学与发病机制 OSC是一种罕见的卵巢恶性肿瘤,在组织学上定义为同时含有癌和肉瘤的双相肿瘤。研究表明,OSC多发于绝经期女性,偶见于育龄期女性。患者多因腹痛、腹胀或胃肠道症状而就诊,但症状往往较上皮性卵巢癌更重。在约90%的OSC患者诊断时病变已扩散到卵巢以外,诊断时多已处于Ⅲ期或Ⅳ期(72.3%~80%)[1]。Rauh-Hain等[2]调查了2003~2011年2886例接受化疗的OCS患者,结果表明整个人群的5年生存率为26.63%,其中Ⅰ期患者5年生存率为59.07%,Ⅱ期为46.78%,Ⅲ期为20.14%,Ⅳ期为13.68%。本研究共纳入13例OSC患者,均因腹痛或腹胀就诊,部分患者伴发腹部包块或纳差、排便困难。11例患者发病时已绝经,发病时中位年龄为62岁。12例患者诊断时已处于晚期,13例患者的3年生存率为38.5%,5年生存率23.1%。
目前关于0CS的起源仍不清楚,普遍被接受的是以下三种理论[3]:(1)碰撞理论认为,肿瘤是双克隆的,上皮成分和肉瘤成分来源于两种不同类型的干细胞,独立演化,然后碰撞;(2)组合理论认为,一个共同的干细胞前体双向分化产生了癌成分和肉瘤成分;(3)转化理论认为,肉瘤成分来源于癌成分,或原始干细胞分化为一种细胞类型,反过来又分化为第二种细胞类型(形变)。其中普遍被大家接受的是转化理论。最近一项研究对18例患者的癌成分和肉瘤成分分别进行了RNA测序,结果发现与上皮性卵巢癌相比,癌肉瘤的癌成分更多的是间质性的,支持肉瘤成分由癌成分通过上皮-间充质转化(epithelial-mesenchymal transition,EMT)[4]。
3.2 辅助诊断 临床上,癌肉瘤与上皮性卵巢癌的鉴别诊断是一个难题。血清肿瘤标志物CA125在93%OSC患者中不同程度升高。本组13例患者均有不同程度的CA125升高,血清学指标不能用于鉴别诊断,但可能是癌肉瘤患者疗效评估和随访的指标[5]。OCS在影像学上多表现为盆腔囊实性包块,体积较大,形态不规则。超声中实性部分可见点线状血流信号或稍丰富血流信号,同时可伴盆腹腔多发种植转移及侵犯邻近器官征象。超声检查对于OCS的诊断及术前评估具有较大应用价值,但其表现无特异性,难以与其他低分化卵巢癌相鉴别[6]。CT检查可提供病变周围情况以及有无腹膜、淋巴结转移,为临床分期提供重要依据[7]。MRI上可因肿块内出血、囊变或坏死等,表现为信号混杂图像[8]。
病理学检测是确诊OSC的金标准。癌肉瘤与上皮性卵巢癌的不同之处在于,它们既包含起源于上皮组织的癌成分,也包含起源于结缔组织的肉瘤成分[9-10]。癌成分通常是浆液性、子宫内膜样或未分化腺癌,少见鳞状细胞癌或透明细胞腺癌。肉瘤成分通常为存在于卵巢中的间充质组织—同源组织,如子宫内膜间质肉瘤、纤维肉瘤或平滑肌肉瘤,或非卵巢固有组织—异源组织,如软骨肉瘤、横纹肌肉瘤、脂肪瘤、骨肉瘤或血管肉瘤。CK和EMA是上皮性肿瘤成分重要标记物。CK7染色阳性,CK20染色阴性或PAX-8染色阳性支持苗勒管来源。间质成分通常Vimentin、平滑肌肌动蛋白(smooth muscle actin,SMA)和结蛋白(Desmin)阳性表达。Kurnit等[11]发现,糖皮质激素受体(glucocorticoid receptor,GR)在肉瘤成分中的表达显著高于癌成分,而ER和PR在肉瘤成分中的表达显著低于癌成分,并发现GR高表达、ER/PR低表达与肉瘤细胞的EMT相关,并可能作为一个潜在的治疗靶点。本文12例患者表现出高Ki-67指数,Ki-67是一种与细胞增殖有关的核蛋白。Ariyoshi等[12]发现,高Ki-67指数组和低Ki-67指数组的5年生存率分别为15.9%和36.4%。本研究单因素生存分析结果未提示Ki-67指数与患者生存预后明确相关。
3.3 治疗 由于OSC的罕见性,目前尚无治疗的明确指南,治疗方案多借鉴上皮性卵巢癌。研究证实,肿瘤细胞减灭术后再进行紫杉醇类和(或)铂类化疗是卵巢OSC的最佳和最有效的治疗[13]。Yalcin等[14]评估了肿瘤细胞减灭术联合铂类-紫杉醇类联合化疗对OCS及高级别浆液性卵巢癌(high-grade serous ovarian cancer,HGSC)患者生存的影响,发现OCS组的中位无进展生存期(progression free survival,PFS)为29个月,总生存期(overall survival,OS)为62个月,HGSC组的PFS为27个月,OS为82个月,差异均无统计学意义。满意的减瘤手术可能是影响患者预后的因素之一,据报道,无可见肿瘤残留患者的OS(中位OS为57个月)明显长于残留肿瘤≤1cm的患者(中位OS为31个月)和残留肿瘤>1cm的患者(中值OS为3个月)[15]。此外,关于术中是否需同时清扫淋巴结,Wang等[16]分析了363例早期OCS女性,发现淋巴结清扫和无淋巴结清扫之间的OS无显著差异(HR=0.88,95%CI为0.56~1.38)。Garg等[17]发现,淋巴结清扫是影响OCS患者预后的独立因素。本文发现,术中清扫淋巴结不是影响OCS患者生存的因素,但仍需大量临床数据验证。
由于缺乏大规模的临床研究,尚未就OCS的一线化疗方案达成共识,2023 NCCN指南提出OSC患者全面分期手术后必须接受化疗,首选紫杉醇/卡铂静脉化疗,或其他上皮性卵巢癌化疗方案,如异环磷酰胺/顺铂和异环磷酰胺/紫杉醇[18]。Brackmann等[19]回顾分析31例使用不同化疗方案OCS患者的预后,发现卡铂/紫杉醇组的中位PFS为17.8个月(95%CI为4.0~31.6个月),异环磷酰胺/紫杉醇组的中位PFS为8.0个月(95%CI为2.4~13.7个月),差异有统计学意义(P=0.025),但两组的OS分别为23.2个月和19.0个月,差异无统计学意义。考虑到化疗双药方案中的铂类成分对方案的有效性至关重要,该研究对异环磷酰胺/顺铂和紫杉醇/卡铂化疗方案的疗效也进行了比较,发现两组患者的中位PFS(13.0个月 vs 17.8个月,P=0.750)和OS(20.6个月 vs 23.2个月,P=0.657)差异均无统计学意义。一项Ⅲ期临床研究[GOG-0261,NCT00954174][20]共纳入90例符合条件的OCS患者,结果显示,卡铂/紫杉醇组的OS(30个月 vs 25个月)和PFS(15个月 vs 10个月)均高于异环磷酰胺/紫杉醇组,但差异无统计学意义。卡铂联合紫杉醇的化疗方案具有并发症少、住院时间短、治疗费用低、PFS长等优点,可作为OCS患者术后的一线化疗方案。此外,Signorelli等[21]发现,OSC患者对蒽环类、烷化剂和顺铂的组合化疗方案显示出良好的反应率,对13例接受顺铂、阿霉素和环磷酰胺联合化疗和28例接受顺铂、多柔比星和异环磷酰胺联合化疗的OSC患者进行随访,22例可评价疗效的患者中,10例(46%)达到完全缓解,3例(13%)达到部分缓解(总体缓解率为59%),总PFS和中位OS分别为11.8个月和20个月,但联合化疗方案也显示出较高的毒性,故需根据患者耐受性选择合适的化疗方案。
放疗更多用于治疗子宫癌肉瘤,96.5%的卵巢癌肉瘤患者未接受放疗[1]。Nizam等[22]报道了1例术后孤立性复发患者以及1例初治多发转移患者,放疗使患者取得了不错的生存期。对于孤立性复发患者临床医生或许可考虑将放疗作为辅助治疗手段。
3.4 未来治疗方向 本研究发现,44%(4/9)的OSC表达血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)。Nishikawa等[23]报道,靶向作用于VEGFR的帕唑帕尼治疗OSC的有效率分别为25%(2/8)和50%(4/8)。Schwab等[24]发现,在小鼠模型中靶向HER2/neu通路的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)—来那替尼有效抑制了肿瘤生长并延长了小鼠生存期。一种新的基于杜卡霉素的靶向HER2抗体-偶联药物(SYD985)已被证明对低/中度或异质性HER2/neu表达的癌肉瘤有活性。HER2/neu 3+细胞系中,SYD985诱导细胞死亡的能力比恩美曲妥珠单抗(Trastuzumab Emtansine,T-DM1)强7倍以上,HER2/neu 1+细胞株中,SYD985诱导细胞死亡的能力是T-DM1的54倍[25]。
NCCN指南提出,初始治疗后达到完全缓解(complete response,CR)或部分缓解(partial response,PR)者,如有BRCA1/2突变,可考虑使用PARP抑制剂维持治疗[18]。Tymon-Rosario等[26]对25例OCS患者进行全外显子测序,结果显示15例患者检测出Signature-3,即与同源重组缺陷(homologous recombination deficiency,HRD)相关的特征。体外实验也发现,携带Signature-3/HRD的CS细胞系对奥拉帕利的敏感性显著提高。本文中1例患者行BRCA基因检测,虽无突变,但仍口服尼拉帕利用于维持治疗,目前术后45个月无复发征象。
靶向PD-L1通路的免疫治疗也可能是有效的治疗模式。CA209-538研究中,5例接受纳武利尤单抗和伊匹单抗治疗的OCS患者,1例达到PR,1例达到病变稳定(stable disease,SD)[27]。Ho等[4]发现,微管靶向药物艾瑞布林通过逆转EMT、甲羟戊酸(Mevalonate,MVA)通路下调和诱导免疫反应在OCS中发挥其强大的抗肿瘤作用,建议开展艾日布林单药或联合免疫治疗OCS的早期临床试验,以期改善女性OCS患者的治疗方案。
OCS恶性程度高,预后差,手术联合术后化疗是主要治疗方式。目前主流的化疗方案还是含铂的化疗方案,在患者耐受情况下给予足够次数的化疗可能有助于延长患者的生存期。但因本研究样本量较少,结果可能存在偏倚。此外,结合最新文献,临床医生应将靶向治疗及免疫治疗纳入临床决策中去。

