多参数MRI 影像组学评估浸润性乳腺癌HER-2 表达状态的临床应用价值
刘婷婷,林佳璐,娄鉴娟,邹启桂,王思奇,蒋燕妮
南京医科大学第一附属医院放射科,江苏 南京 210029
女性乳腺癌发病率现已超过肺癌,成为全球癌症之首。在女性人群中,乳腺癌的发病率和死亡率居所有癌症首位[1]。乳腺癌是一种具有高度异质性的肿瘤,肿瘤的生物标志物检测在乳腺癌精准治疗中发挥着重要作用,人表皮生长因子受体-2(human epidermal growth factor receptor 2,HER-2)是一种原癌基因,其过表达与乳腺癌的治疗和预后密切相关[2-4],20%~30%的乳腺癌病例会出现HER-2 基因及其蛋白的过度表达[5]。检测乳腺癌HER-2表达状态对个性化治疗乳腺癌至关重要[2]。通过免疫组织化学(immunohistochemistry,IHC)检测蛋白表达或通过荧光原位杂交(fluorescencein situhybridization,FISH)分析HER-2基因扩增是临床实践中用于确定HER-2 表达状态的两种主要方法[5],但均为有创性检查,且由于浸润性乳腺癌治疗过程中HER-2表达状态的变化以及疗效的个体差异常常会导致临床患者HER-2表达状态的动态评估比较困难[2,6]。
目前,乳腺磁共振成像(magnetic resonance imaging,MRI)被推荐为乳腺癌高危女性的首选成像方式,它可用于诊断乳腺癌、无创评估肿瘤的治疗反应和术后有无残留肿瘤[7]。而影像组学是指将通常的医学图像转换为高通量、可挖掘的定量数据特征,突出肉眼不可见的图像特征,对病变图像进行全面、精准的分析[2]。近年来的研究显示,基于MRI图像的影像组学特征模型在识别良恶性病变[8]、区分不同乳腺癌的亚型[9]、预测有无腋窝淋巴结转移[10]和预测肿瘤对新辅助治疗(neoadjuvant chemotherapy,NAC)治疗的反应及肿瘤复发的风险[5,11]等预后因素等方面具有一定价值。既往已有研究通过影像组学评估乳腺癌HER-2表达状态,相关研究均比较了多参数影像组学模型和单一参数影像组学模型的预测差异,并未深入探索各序列在预测价值中的权重差异,且对于包含动态增强MRI特征在内的多参数影像组学相关实验[12-19],并没有比较动态增强检查不同时期乳腺癌强化特征的差异;因此,本研究的目的就是探究基于多参数MRI 影像组学特征的模型评估浸润性乳腺癌HER-2表达状态的价值,比较不同序列特征在评估价值中的权重差异。
1 对象和方法
1.1 对象
收集2018 年1 月—2019 年12 月于南京医科大学第一附属医院确诊为浸润性乳腺癌患者MRI 图像资料进行回顾性分析。纳入标准:①乳腺MRI检查前未进行手术、活检、化疗及其他微创治疗;②有穿刺或者手术病理结果,并接受IHC 和/或FISH 检验评价HER-2表达状态;③临床资料(发病年龄、肿瘤最大径和诊断时有无腋窝淋巴结转移)完整。排除标准:①无基线期乳腺MRI 图像或图像质量不佳;②病理及免疫组化资料不全。最终纳入401 例患者,均为女性,年龄(49.99±10.16)岁,其中HER-2阳性191例,HER-2阴性210例。将病例按照7∶3比例随机分组分为训练集(n=281)和测试集(n=120)。本研究为回顾性研究,通过医院伦理委员会批准(伦审号:2020-SRFA-277)。
1.2 方法
1.2.1 HER-2表达状态判读
参考乳腺癌HER-2检测指南[20],HER-2的检测需要IHC 和/或FISH 检验。HER-2 阳性结果包括IHC 3+和/或FISH 阳性;IHC 1+或IHC 0,则可判断为HER-2 阴性;对于IHC 2+的患者,应进一步通过FISH 等方法行HER-2 基因扩增检查,若FISH 结果为扩增,HER-2可判读为阳性,否则阴性(图1)。
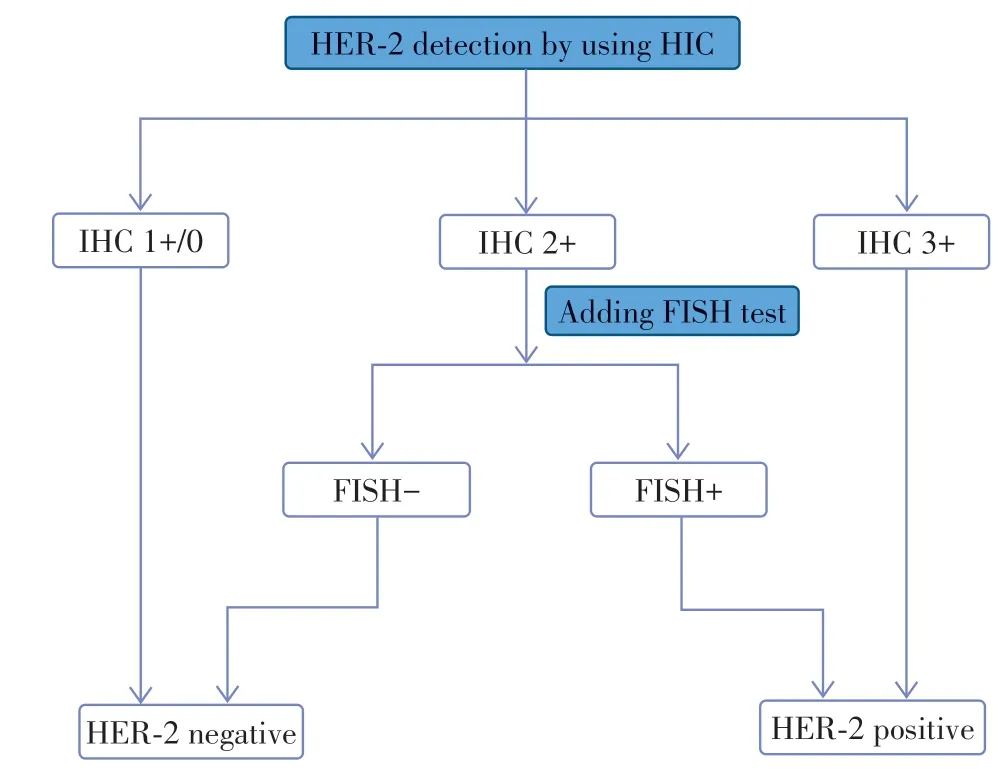
图1 HER-2表达状态判读流程图Figure 1 The flow chart of assessing HER-2 expression status
1.2.2 MRI检查方法
检查设备采用西门子3.0T MRI 及1.5T MRI 扫描仪和乳腺专用8 通道相控阵线圈。患者行俯卧位,双侧乳腺自然下垂放置于线圈内并严格制动。患者均行乳腺MRI 平扫及多期动态增强扫描。扫描序列包括:①快速反转恢复(turbo inversion recovery magnitude,TIRM)压脂序列横轴面T2WI;②横轴面弥散加权成像(diffusion-weighted imaging,DWI)及其衍生表观弥散系数(apparent diffusion coefficient,ADC)图;③横轴面T1WI 多期动态对比增强MRI(dynamiccontrast enhanced MRI,DCE-MRI)。具体扫描参数见表1。ADC值图像均由b值=800 s/mm2的DWI图像生成。动态增强扫描检查时,均在注射对比剂(Gd-DTPA)前先扫描蒙片,然后经手背静脉使用高压注射器团注对比剂,剂量0.1 mmol/kg,注射流率3.0 mL/s,注射对比剂后快速推注20 mL生理盐水;随后连续不间断扫描5期。
1.2.3 影像组学分析
1.2.3.1 图像处理与分割
将入组乳腺癌患者的TIRM、DCE-MRI序列的第2 期(DCE2)和第4 期(DCE4)、DWI(b值=800 mm/s2)及软件自动生成的ADC 图从医学影像存储和传输系统(picture archiving and communication systems,PACS)中以DICOM格式导入ITK-SNAP软件(Version 3.8.0,http://www.itk-snap.org),由一名放射科医生(具有2 年乳腺MRI 诊断经验)在肿瘤最大层面手动勾画感兴趣区域(region of interest,ROI),以动态增强MRI 肿块强化最明显的一期减影图像上强化病灶范围为基础,确定病灶边缘,如遇ROI难以确定边缘的病灶,则与另一名高年资医师(具有15 年乳腺MRI 诊断经验)讨论决定。勾画时避开囊性区域,不避开实性肿瘤内的坏死区域,尽量避免超出病灶边缘(图2、3)。多中心及多灶性病例选择最大病灶层面进行勾画。间隔3 个月后随机抽取40 例患者再次进行ROI 的勾画,使用组内相关性系数(intraclass correlation coefficient,ICC)来评估观察者之间和观察者之内对ROI选取的一致性。

图3 HER-2阳性组患者ROI勾画示意图Figure 3 Illustration of ROI delineation in HER-2 positive group patients
1.2.3.2 影像组学特征提取与筛选
特征提取:将勾画好的ROI 导入人工智能软件(artificial intelligent kit,A.K.)进行影像组学特征的提取。从原始图像中提取3 种原始特征:①18 个一阶特征(first-order);②14 个形状特征(shape);③75个纹理特征,包括24个灰度共生矩阵(glcm)、16个灰度区域大小矩阵(glszm)、16 个灰度游程矩阵(glrlm)、5 个邻域灰度差分矩阵(ngtdm)、灰度相关矩阵(gldm)。在基于小波滤波和本地二进制模型变换之后的图像中分别提取18个一阶特征和75 个纹理特征。每个序列ROI各提取1 130个特征,一共提取出5 650个特征。
特征筛选:在进行特征筛选之前,用Z-score 标准化法对数据进行标准化处理。对前后两次分割图像所提取的特征进行组间和组内一致性评估,ICC>0.75 为一致性较好,并保留这些一致性较好的特征,进行后续分析;然后使用皮尔逊相关性系数(Pearson correlation coefficient,PCC)计算特征之间的相关性,如果两个特征之间的相关系数>0.9,则两者随机保留其一;最后利用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)对训练集进行10 折交叉验证,筛选出最佳影像组学特征。
1.2.3.3 影像组学模型的建立
利用从TIRM、DCE2、DCE4、DWI、ADC 图中筛选出来的影像组学特征,使用逻辑回归算法(logistic regression,LR)分别构建单参数模型(TIRM模型、DCE2 模型、DCE4 模型、DWI 模型和ADC 模型)、组合模型(由DCE2 特征和DCE4 特征组成的增强模型、由DWI特征和ADC特征组成的弥散模型、增强+TIRM模型、弥散+TIRM 模型、增强+弥散模型)及多参数模型(由TIRM 特征、DCE2 特征、DCE4 特征、DWI特征和ADC特征联合组成的多参数模型)。以上过程首先在训练集数据集中进行,随后在测试集数据集中完成数据内部验证。
1.3 统计学方法
采用R 4.2.3 软件和SPSS 27.0 统计软件进行统计分析。符合正态分布的计量资料采用均数±标准差()表示,组间以两独立样本t检验进行比较;不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,组间以Mann-WhitneyU检验进行比较;计数资料采用频数统计表示,采用χ2检验比较组间差异。应用受试者工作特征(receiver operating characteristic,ROC)曲线及相应曲线下面积(area under curve,AUC)评估不同影像组学模型预测浸润性乳腺癌HER-2表达状态的效能,并计算模型预测的准确度、灵敏度、特异度、阳性预测值和阴性预测值。以DeLong 检验比较各模型间效能差异。采用决策曲线分析(decision curve analysis,DCA)评价不同模型的临床价值。
2 结果
2.1 一般临床资料分析
训练集与测试集之间的临床资料对比:本研究401例患者,训练集与测试集之间年龄、肿瘤最大径和有无腋窝淋巴结转移差异均无统计学意义(P>0.05,表2)。

表2 训练集与测试集的患者临床信息Table 2 Clinical information of patients in training and test sets
HER-2阳性与HER-2阴性组的临床资料对比:HER-2 阳性组和HER-2 阴性组的肿瘤最大径和腋窝淋巴结有无转移差异有统计学意义(P<0.05),而两组之间的年龄差异无统计意义(P=0.397,表3)。

表3 HER-2阳性组与HER-2阴性组的患者临床信息Table 3 Clinical information of patients in the HER-2 positive and HER-2 negative groups
2.2 一致性检验
2 名医师勾画病灶ROI 的一致性均较好,观察者内的ICC为0.84~0.99,观察者之间的ICC为0.80~0.99,证明所勾画的ROI病灶可用于后续分析。
2.3 影像组学特征的筛选及预测模型的建立
利用10 折交叉验证的LASSO 算法分别对5 个序列提取出的特征进行筛选,最终TIRM、DCE2、DCE4、DWI、ADC 序列分别筛选出3、16、13、13、6个特征;基于以上单模态序列筛选出来的特征再次进行多模态的特征的筛选,增强模态、弥散模态、增强+弥散双模态、增强+TIRM双模态、弥散+TIRM双模态筛选的特征分别为17、18、22、21、19 个特征,最后基于上述特征筛选出多参数模态(增强+弥散+TIRM)特征26 个(表4)。最终筛选出的26 个多参数特征中按照权重排序的前10 个特征如图4所示。

表4 最终筛选出的26个多参数影像组学特征Table 4 Final selection of 26 multi-parametric radiomics features

图4 按照权重排序的前10个特征Figure 4 Top10 features ranked by weights
在利用LR 构建的11 个模型中,单参数模型中的DCE2模型在训练集和测试集中预测HER-2表达状态的AUC值分别为0.907、0.879;组合模型中的增强模态模型、增强+TIRM 模型以及增强+弥散模态模型在训练集中的AUC 值分别为0.902、0.923、0.920,在测试集的AUC 分别为0.890、0.891、0.872;而多参数模型在训练集和测试集的AUC 分别为0.932、0.906(表5,图5)。经综合分析,单参数模型中DCE2模型的预测效能最佳,且DeLong检验显示,DCE2 模型的AUC 值均明显高于其他单参数模型,且差异具有统计学意义(P均<0.001);DCE4模型的预测效能稍逊于DCE2 模型,但较TIRM 模型、DWI模型及ADC模型稍好;其余单参数模型的预测效能均较差。在组合模型中,联合增强特征的模型比其他未联合增强特征的模型如弥散模型、弥散+TIRM模型等的预测效能更好,DeLong 检验也显示,联合增强特征的模型的AUC 值均高于其他未联合增强特征的模型,且差异具有统计学意义(P均<0.001,表5,图5);而在单参数DCE2模型、联合增强特征的组合模型及多参数模型的比较中发现,多参数模型AUC 值较高,但是DeLong 检验显示,这几组模型之间的差异没有统计学意义(P均>0.05)。测试集的决策曲线表明多参数模型在大范围阈值概率下优于其他模型,临床获益度更高(图6)。
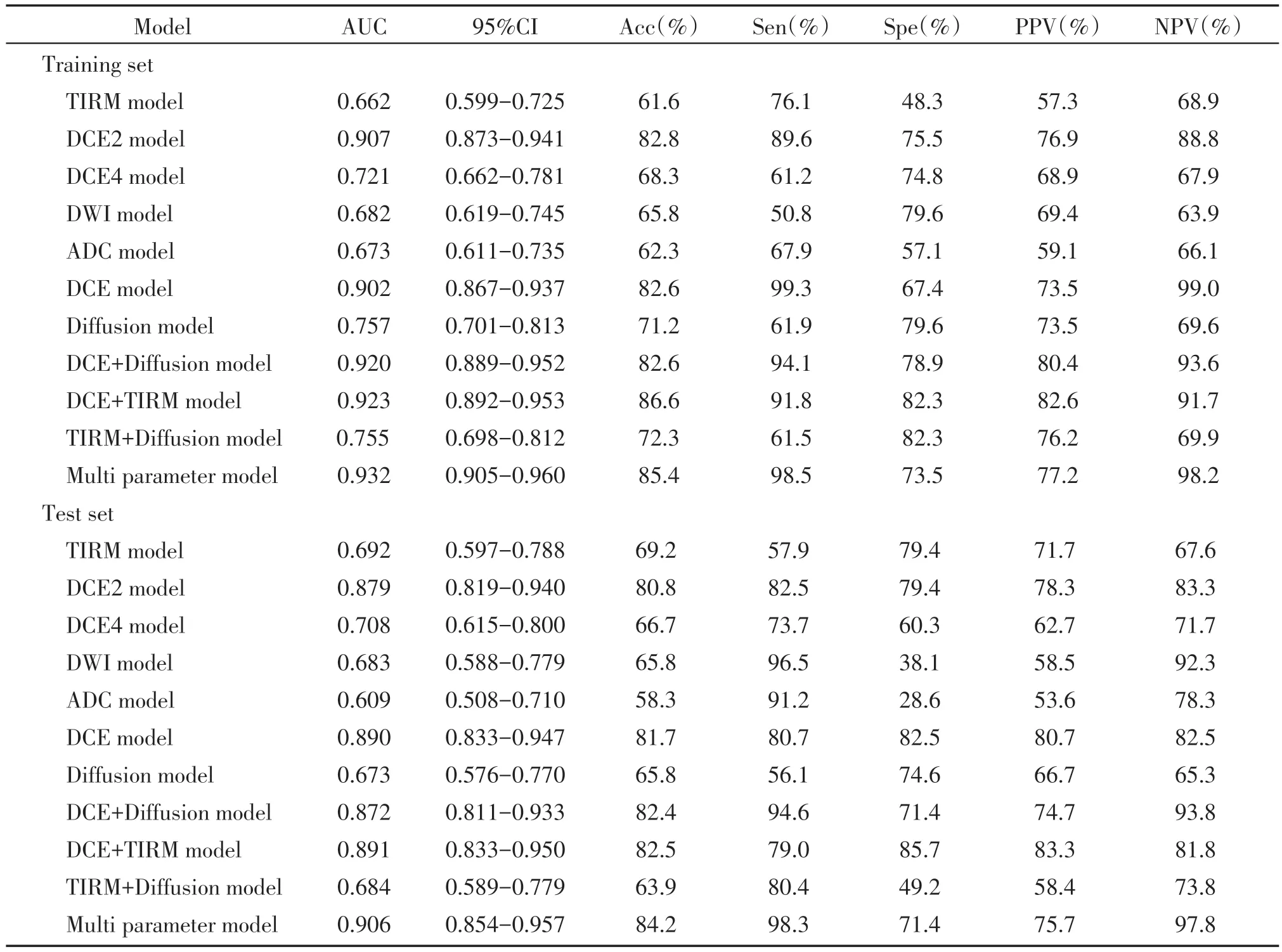
表5 训练集及测试集中不同模型的预测效能Table 5 Predictive performance of different models in the training and test sets
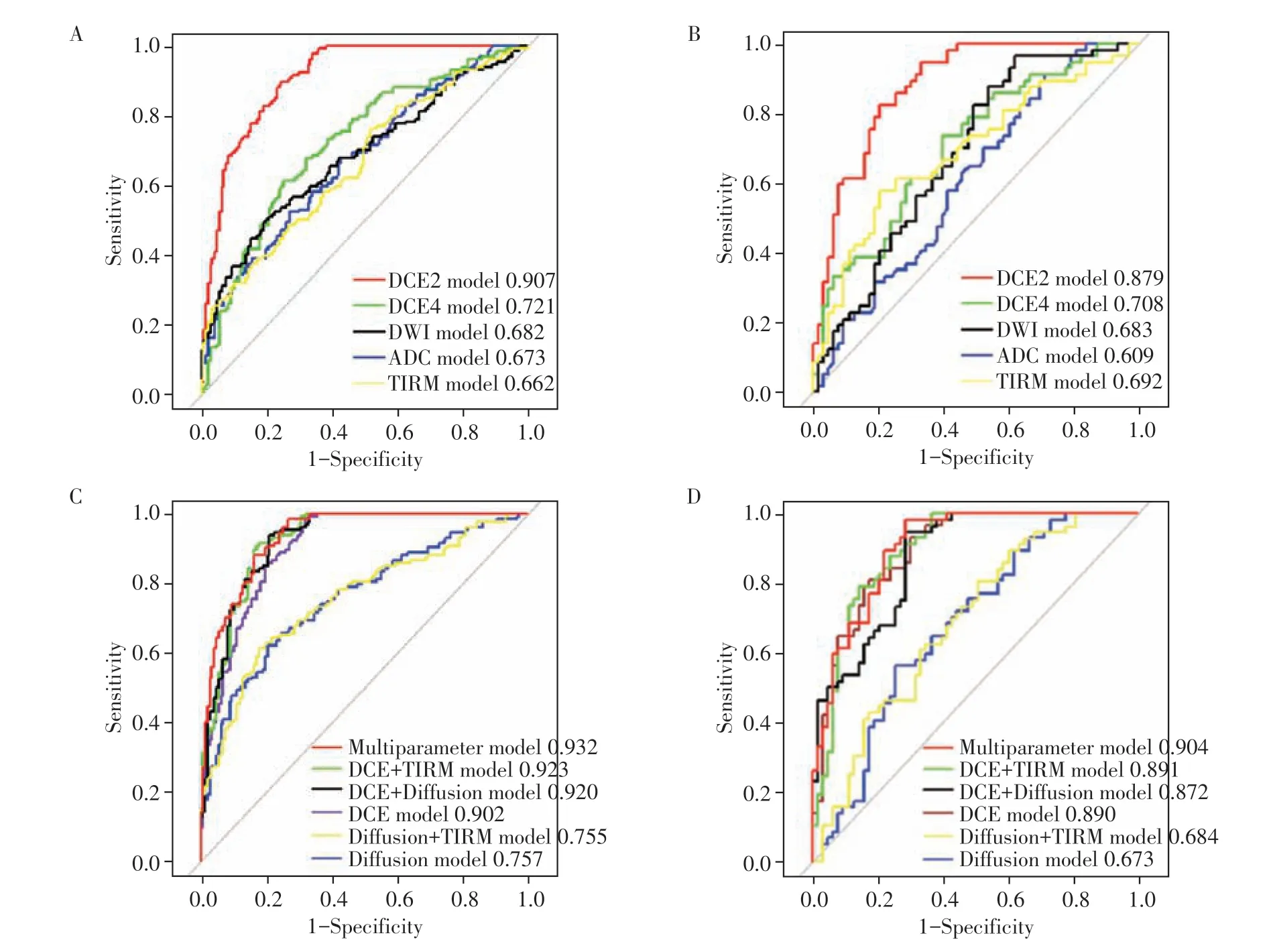
图5 训练集与测试集各种模型预测效能的ROC曲线Figure 5 ROC curves of various models in the training and test sets
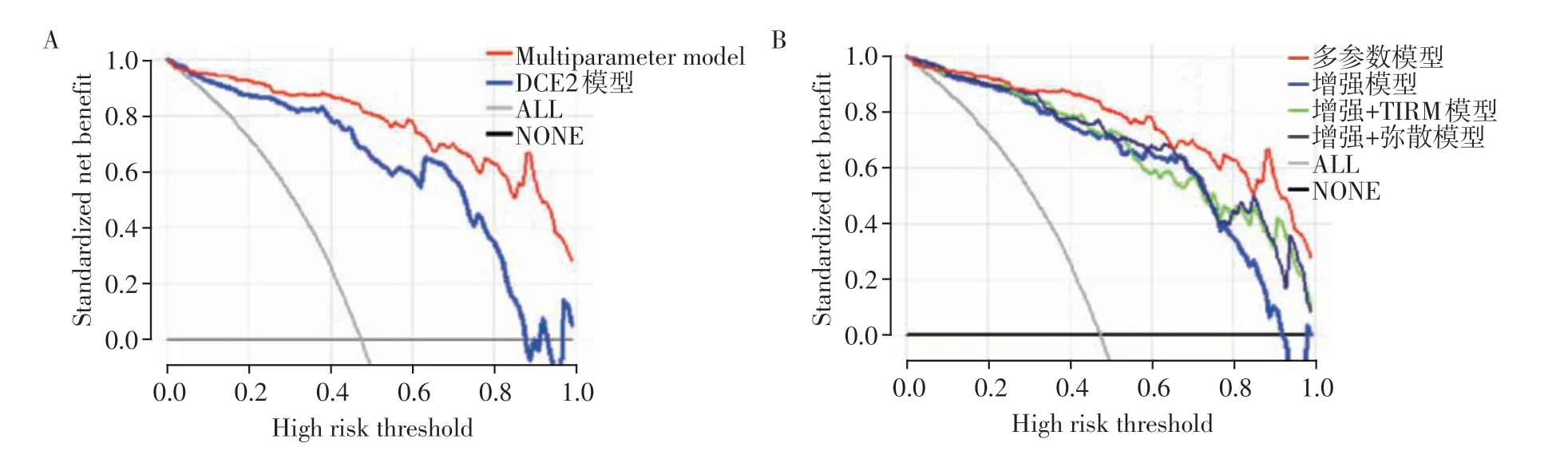
图6 验证组各种模型的DCA曲线Figure 6 DCA curves of the various models in the validation group
3 讨论
HER-2是一种原癌基因,与细胞的生长、分化、转移过程调控作用有关[21];20%~25%的乳腺癌会出现HER-2的扩增和过表达,HER-2状态是乳腺癌症疾病进展和死亡的独立预测因子,HER-2过表达的浸润性乳腺癌患者预后更差[22],但随着临床治疗的发展,HER-2 也可做为乳腺癌靶向治疗的一个靶点,因此,早期对乳腺癌患者的HER-2 状态进行准确的评估至关重要。目前,HER-2状态主要通过免疫组织化学(IHC)或荧光原位杂交(FISH)检测,两者都是有创性检查方法。因此本研究期望能够通过建立多参数影像组学模型为实际临床工作中乳腺癌患者HER-2 表达状态判读提供无创性的辅助工具,避免患者受到不必要的创伤。尤其是在病检肿瘤取样不足而无法得出结论及治疗过程中需要多次进行HER-2表达状态评估的情况下,乳腺MRI能提供有价值的信息。
MRI 是乳腺成像中必不可少的工具,被认为是检测乳腺癌和监测新辅助化疗最灵敏的成像方法之一。影像组学是一种新的机器学习方法,旨在从临床图像中提取有意义的特征,通过这些定量图像特征对肿瘤进行综合量化、评估。既往已有研究通过影像组学评估乳腺癌HER-2表达状态[12-16],Zhou等[13]利用基于单参数和多参数磁共振成像的影像特征,包括FS-T2WI、DWI、DCE-MRI 及其组合(FS-T2WI+DWI+DCE-MRI),联合PR、Ki-67临床特征建立临床-影像组学列线图模型在术前预测癌症患者的HER-2表达状态,最终结果证实临床-影像组学列线图模型预测效能优于单一影像组学模型和临床模型。Xu 等[16]同样利用多参数磁共振成像数据联合组织学分级、Ki-67 临床特征建立临床-影像组学列线图模型预测HER-2 表达状态。既往研究仅仅比较了多参数影像组学和单一参数影像组学模型的预测差异,并未深入探索各序列在预测价值中的权重分布,而且上述实验虽然采用了包含DCE-MRI在内的多参数MRI影像组学特征对HER-2状态进行评估,但是并没有比较动态增强检查不同时期乳腺癌强化特征的差异;而本研究不仅包含了TIRM、DWI、ADC 和DCE-MRI 序列,更将DCE-MRI 详细划分为增强早期(增强后第2 期)和增强晚期(增强后第4期),期望通过不同时期的病变增强特征对比,得到更加精准的预测指标。最终通过对单参数模型、组合模型以及多参数模型的多方面对比之后,发现单参数模型中DCE-MRI的特征预测效能最佳,其中增强早期特征(增强后第2 期,即DCE2 特征)最为明显;而在组合模型中,联合增强特征的组合模型比未联合增强特征的模型预测效能更好;因此,可以得出结论,增强特征在预测浸润性乳腺癌HER-2表达中具有较高的价值,尤其是增强早期特征贡献最大。而TIRM、DWI 和ADC 这些平扫特征对HER-2表达状态的预测效能虽然不如增强特征,但亦有一定价值,与既往研究基本一致[5,12,23-24]。
本研究最终筛选出26个影像组学特征,按照权重排序的前10 个特征中,DCE2 特征中的DCE2_original_shape_SurfaceVolumeRatio 位居首位(图3)。一方面,HER-2 基因过表达产生的酪氨酸激酶蛋白会激活其下游的PI3K-AKT-mTOR 信号通路,促进细胞增殖和血管的形成[25],新生血管的形成导致局部血流灌注增加,但同时血管内皮细胞不成熟导致血管通透性增加[26],因此HER-2过表达型乳腺癌在增强早期即会出现明显强化表现[27-28]。安丽华等[29]的研究也表明早期增强率与HER-2 阳性表达呈正相关,即早期增强率越高,肿块的HER-2阳性表达越高,提示肿瘤恶性程度较高。另一方面,original_shape_SurfaceVolumeRatio 是基于形态与表面积体积比的特征,SurfaceVolumeRatio 值越大则病灶边缘越不规则[17],而HER-2阳性乳腺癌的特征性表现多为不规则肿块或非肿块样强化[30],也说明肿瘤的形态与HER-2表达高度相关,这一结果与既往研究结果一致[24,29]。除DCE2_original_shape_SurfaceVolumeRatio这一特征以外的9个特征中,有5个基于小波变换的纹理特征、3 个基于小波变换一阶特征及1 个形状特征。一阶特征(Minimum、Skewness)描述灰度直方图的最小特征值和分布偏度,不考虑像素的相对空间位置。而gldm、ngtdm、glszm等特征均为高阶纹理特征,用于量化灰度区域分布特征[31],因此,上述特征在不同维度上反映了病变的异质性。
本研究存在一定的局限性:①本研究为单中心回顾性研究,未包含外部验证集,缺少对结果的泛化性和稳健性评价,未来需要进一步开展多中心研究,将模型应用到新的数据集以评估其效能;②本研究包含两种扫描仪器,扫面参数不是完全一致,这可能对最终结果有所影响,未来研究应尽量选择相同检查仪器,确保做到控制变量;③本研究ROI勾画为手动勾画,且选择在肿瘤最大层面分割,存在一定的误差,未完全包含肿瘤容积信息;未来需要寻找一种自动、可靠且高效的肿瘤分割方法。
综上所述,基于多参数影像特征(包括TIRM、DCE2、DCE4、DWI 和ADC 特征)构建的影像组学模型在评估HER-2表达方面有一定的临床价值,其中增强特征,尤其是增强早期特征的预测价值较高,能够为临床提供相应影像学依据,从而实现个体化精准治疗。

