铜藻应对强光胁迫的光合适应
张 琦,李凌雪,何健龙,王 宁,刘 凯,刘丽娟,徐智广*
(1 鲁东大学 生命科学学院,山东 烟台 264025;2 山东省海洋资源与环境研究院,山东 烟台 264006;3 长岛综合试验区 海洋经济促进中心,山东 烟台 265800)
金潮是漂浮马尾藻(Sargassum)暴发性生长而出现的生物量大规模堆积在海水表面的海洋生态现象[1]。受全球变暖和近岸海水富营养化的影响,这一现象在规模、频率和程度上逐渐加剧[2]。铜藻(Sargassumhorneri)是目前发现的马尾藻金潮的三个原因种之一。近年来,我国黄海、东海因漂浮铜藻导致大面积、周期性的金潮现象频现,对当地海区造成了严重的生态灾害和巨大的经济损失[3]。例如,漂浮藻体会阻碍水体交换,使光照难以到达海洋深处并导致水体缺氧,对其他海洋生物生存造成威胁,影响海洋生态系统的稳定性;亦会阻挡船只海上作业,对渔业和旅游业产生破坏[4];同时,金潮暴发也会给水产养殖业带来毁灭性破坏,2016年底苏北浅滩紫菜养殖筏因金潮暴发而发生大面积坍塌,造成5亿元的经济损失[5]。因此,铜藻金潮有可能是继浒苔绿潮后的又一重大海洋环境问题[6]。
金潮发生时,藻体由定生水下漂浮到海面,缺少了海水对可见光的削减作用,其会接收到更多的光照[7]。光照是影响藻类生长、发育、繁殖等生理活动的重要环境因子之一,光照强度、光照频率、光照周期、光强波动、光谱组合等诸多因素都会对藻体产生影响[8]。光照强度直接影响藻类的光合速率,不同种类海藻对光照强度的需求存在一定差异,就每一种藻体而言,补偿光照强度和饱和光照强度之间的范围为个体的最适光强范围[9]。在一定的光强范围内,藻体的光合速率会随着光照强度的增加而增强;当光照强度超过饱和光强时,藻体的光合作用通常会受到抑制,产生光抑制现象[10-11]。
除对藻类生长的直接影响外,光照强度还会对藻类的光合活性、色素组成、新陈代谢产物和酶活性等产生影响[8]。强光下,藻类的叶绿素含量一般呈下降趋势,如瓦氏马尾藻(SargassumvachellianumGreville)[12]、琼枝藻(Betaphycusgelatinae)[13]、脆江蓠(Gracilariachouae)[14]等。反之,在低光强条件下,藻体会补偿性地增加光合色素的合成来维持光合作用,以供生长发育所需[15]。此外,光强过强会减慢电子的传递速率、降低光合活性[16]、破坏相关酶的活性[17]。虽然光胁迫对藻体会产生一定的光损伤,但经过长期进化,藻类具备了抵御强光辐射的多种光保护途径[18]。比如,强光下藻类可以通过叶黄素循环的非光化学淬灭,将过多光能转化为热能,通过热耗散的方式来保护光反应中心免受高光强损伤[19];也可以通过提高抗氧化系统(包括抗氧化酶和抗氧化剂)的能力有效清除强光诱导的活性氧[20],以削弱强光胁迫对藻体的损伤,其中光合色素类胡萝卜素就是一种具有ROS清除作用的有效抗氧化剂[21]。此外,藻类还常常通过加速光系统Ⅱ(photosystem Ⅱ,PSⅡ)反应中心D1蛋白的合成周转,来修复强光对反应中心的损伤[22]。这些保护和修复策略,对藻体适应快速光强变化至关重要。
大型海藻对光胁迫的适应能力和适应途径具有种的特异性,作为中国金潮暴发的原因种,漂浮型铜藻在海水表面强光条件下的光合响应过程尚不明确。本研究探讨了不同光照强度下铜藻的光合生理变化,以揭示铜藻在强光胁迫下的光损伤和光修复等光合响应过程,为铜藻金潮暴发的生理机制提供参考。
1 材料与方法
1.1 材料
实验材料铜藻于2022年12月中旬采自山东省荣成市俚岛湾(37°15′N、122°35′E,海水表层温度为5 ℃)的漂浮种群。俚岛湾内漂浮铜藻呈大小不一的斑块状分布,共发现斑块20个,斑块面积3~9 m2。样品采集时,每个斑块随机采集铜藻分枝个体10株,采集后样品置于低温箱(5 ℃)中3 h内运回实验室。样品用过滤、灭菌自然海水在恒温光照培养箱(GXZ-380D,宁波江南仪器公司,中国)中混合培养24 h,培养光照强度为92 μmol/(m2·s),温度为18 ℃,光/暗周期为12 h∶12 h,不间断充气。
1.2 培养光强设置
从混合培养24 h后的铜藻中随机选择45个铜藻分枝个体(长5~7 cm)用于光处理实验,每5个铜藻分枝(鲜重约为1.0 g)培养在1个装有500 mL自然海水的石英管中,石英管置于水浴槽内,通过低温恒温槽(YRDC-0506,上海亚荣生化仪器厂,中国)将水浴温度控制在18 ℃。利用全波长太阳模拟器(Sol 1200,Hönle GmbH,德国)进行光照处理,参考北方不同季节海水表面光强[23]及采样地荣成市俚岛湾的实测最高光强,设置3个光合有效辐射(photosynthesis active radiation,PAR,400~700 nm)强度,分别为:460(低光)、920(中光)、1 380(高光)μmol/(m2·s),每个光强处理设置3个重复。经不同光强培养120 min后,石英管全部转移到光强为9.4 μmol/(m2·s)、温度为18 ℃的恒温光照培养箱(GXZ-380D,宁波江南仪器公司,中国)中进行弱光恢复 240 min。光强采用光量子计(PMA2100,Solar Light,美国)进行测定。
1.3 最大光化学量子产量(Fv/Fm)和非光化学淬灭的测定
最大光化学量子产量使用双调制式叶绿素荧光仪(FL6000,Photon Systems Instruments,捷克)进行测定[24]。在强光处理过程中,分别在处理0、30、60、90、120 min时取活体进行测定;在低光恢复阶段,分别在处理60、120、180、240 min时取活体进行测定。测定前将藻体置于黑暗环境暗适应5 min,使所有反应中心在测量前保持开放状态。测量光照强度低于0.1 μmol/(m2·s),照射后获得最小荧光(F0);通过照射强度为3 500 μmol/(m2·s)的饱和脉冲光获得暗适应状态下的最大荧光(Fm);用光化光50 μmol/(m2·s)获得稳态荧光(F);用远红光测量光适应状态下的最小荧光(F0′);使用饱和光测量在光适应状态下的最大荧光(Fm′)。PSⅡ最大光化学量子产量使用最大可变荧光与暗适应下的最大荧光之比进行表示,即
Fv/Fm=(Fm-F0)/Fm。
(1)
式中:Fv为暗适应状态下当所有非光化学过程处于最小时的最大可变荧光;Fm为暗适应状态下当光系统Ⅱ的所有反应中心处于完全关闭状态且所有非光化学过程处于最小时的最大荧光产量;F0为初始荧光,是在暗适应状态下当光系统Ⅱ的所有反应中心处于完全开放状态且所有非光化学过程处于最小时的荧光产量。
非光化学淬灭系数(qN)的计算公式为
qN=(Fm-Fm′)/Fm′。
(2)
式中:Fm为暗适应状态下当光系统Ⅱ的所有反应中心处于完全关闭状态且所有非光化学过程处于最小时的最大荧光产量;Fm′为在光适应状态下当光系统Ⅱ的所有反应中心处于完全关闭状态且所有非光化学过程处于最优态时的荧光产量。
1.4 快速叶绿素荧光诱导动力学曲线参数的测定
铜藻的快速叶绿素荧光诱导动力学曲线采用双调制式叶绿素荧光仪(FL6000,Photon Systems Instruments,捷克)进行测定。取不同光照处理的藻样,置于黑暗环境适应5 min,记录藻样照射激发光后20 μs~1 s的荧光信号(对数尺度上)。计算得到单位反应中心吸收(EABS/RC)和耗散(EDI0/RC)的光能、捕获的用于还原质体醌A的能量(ETR0/RC)及捕获的用于电子传递的能量(EET0/RC)、在J点的相对可变荧光(VJ)、光系统Ⅱ反应中心净关闭率(M0)、捕获的激子将电子传递到电子传递链中超过质体醌A的其他电子受体的概率(ψ0)。
参考李鹏民等[25]的方法,计算公式如下:
VJ=(FJ-F0)/(Fm-F0),
(3)
M0=4×(F300 μs-F0)/(Fm-F0),
(4)
ψ0=1-VJ,
(5)
EABS/RC=M0×(1/VJ)×(1/φP0),
(6)
ETR0/RC=M0×(1/VJ),
(7)
EET0/RC=M0×(1/VJ)×ψ0,
(8)
EDI0/RC=EABS/RC-ETR0/RC。
(9)
式中:FJ为在快速叶绿素荧光诱导动力学曲线上J点处的荧光;F0为暗适应后的最小荧光;Fm为暗适应后的最大荧光;F300 μs为在300 μs时的荧光;φP0为光适应后的最大光化学效率。
1.5 快速光响应曲线的测定
铜藻的快速光响应曲线使用掌上水体叶绿素荧光仪(AquaPen AP-C100,Photon Systems Instruments,捷克)测得。取不同光照处理的藻样,置于黑暗环境暗适应5 min,设置光强梯度分别为10、20、50、100、300、500、1 000 μmol/(m2·s)的7个光化学光,每个梯度持续 60 s,每隔10 s检测器测量1次实时荧光,获得藻体的动态荧光曲线及各光照梯度下的PSⅡ实际光量子产量。
相对电子传递速率的计算公式[26]为
R=IPFD×φPSⅡ×0.5。
(10)
式中:R为相对电子传递速率;IPFD为光化光强度;φPSⅡ为PSⅡ实际光量子产量;系数0.5表示所有吸收的光量子中约有50%被分配到PSⅡ。
最大相对电子传递速率Rmax、光饱和点Ek的计算公式为
R=Rmax×tanh(α×IPFD/Rmax),
(11)
Ek=Rmax/α。
(12)
式中:α为快速光响应曲线的初始斜率;IPFD为光化光强度。
1.6 光合色素含量的测定
称取0.1 g鲜重藻体,使用90%丙酮研磨,并将溶液体积定容至8 mL,置于4 ℃冰箱中黑暗条件提取12 h。提取结束后在4 ℃、4 000 r/min条件下离心15 min,使用分光光度计(UH5300,日立,日本)测定上清液的吸光度值。根据Jeffrey等[27]的描述,计算光合色素叶绿素a、叶绿素c和类胡萝卜素的含量:
C叶绿素a=(11.47×A664-0.40×A630)×V/M,
(13)
C叶绿素c=(24.36×A630-3.73×A664)×V/M,
(14)
C类胡萝卜素=[7.6×(A480-1.49×A510)]×V/M。
(15)
式中:C叶绿素a、C叶绿素c、C类胡萝卜素分别代表叶绿素a、叶绿素c和类胡萝卜素的含量;A664、A630、A510、A480分别代表波长为664、630、510、480 nm的吸光度值;V代表90%丙酮的体积;M代表藻体鲜重。
1.7 数据分析
采用Excel和SPSS 17.0进行数据整理和统计分析,使用GraphPad Prism 8作图。结果表示为平均数±标准偏差,用Friedman检验判断不同培养条件下叶绿素荧光参数的差异。采用双因素重复测量方差分析(RM-ANOVA)评价时间序列下光强对叶绿素荧光参数的影响;采用单因素方差分析(one-way ANOVA)对光合色素数据进行方差分析。采用t检验对初始、高光处理、弱光恢复后的荧光参数和光合色素数据进行差异显著性分析,显著性水平均设置为P<0.05。
2 结果
2.1 叶绿素荧光参数
Fv/Fm表示PSⅡ的最大光化学量子产量,是衡量植物光合作用效率的重要指标,较高的量子产量代表更好的光合活性[28]。强光处理和弱光恢复过程中铜藻的Fv/Fm结果如图1a所示。不同处理时间和光照强度对铜藻的Fv/Fm具有显著影响(时间:P<0.05,df=8,F=83.454;光照:P<0.05,df=2,F=38.825;表1),且二者具有交互作用(P<0.05,df=16,F=3.719;表1)。在强光处理过程中,Fv/Fm值逐渐下降,进行弱光恢复后,Fv/Fm值逐渐升高。铜藻的Fv/Fm初始值为0.757±0.006,经460、920、1 380 μmol/(m2·s)的强光处理120 min后,Fv/Fm值较初始值分别降低40.95%、49.93%、73.58%。中光处理组与低光处理组的Fv/Fm值具有显著差异(P<0.05),高光处理组的Fv/Fm值显著低于中、低光处理组(P<0.05)。弱光恢复240 min后,低光、中光、高光处理组铜藻的Fv/Fm值分别恢复到初始值的90.49%、84.15%和74.90%。

表1 不同时间和光强条件下Fv/Fm和qN的双因素重复测量方差分析结果
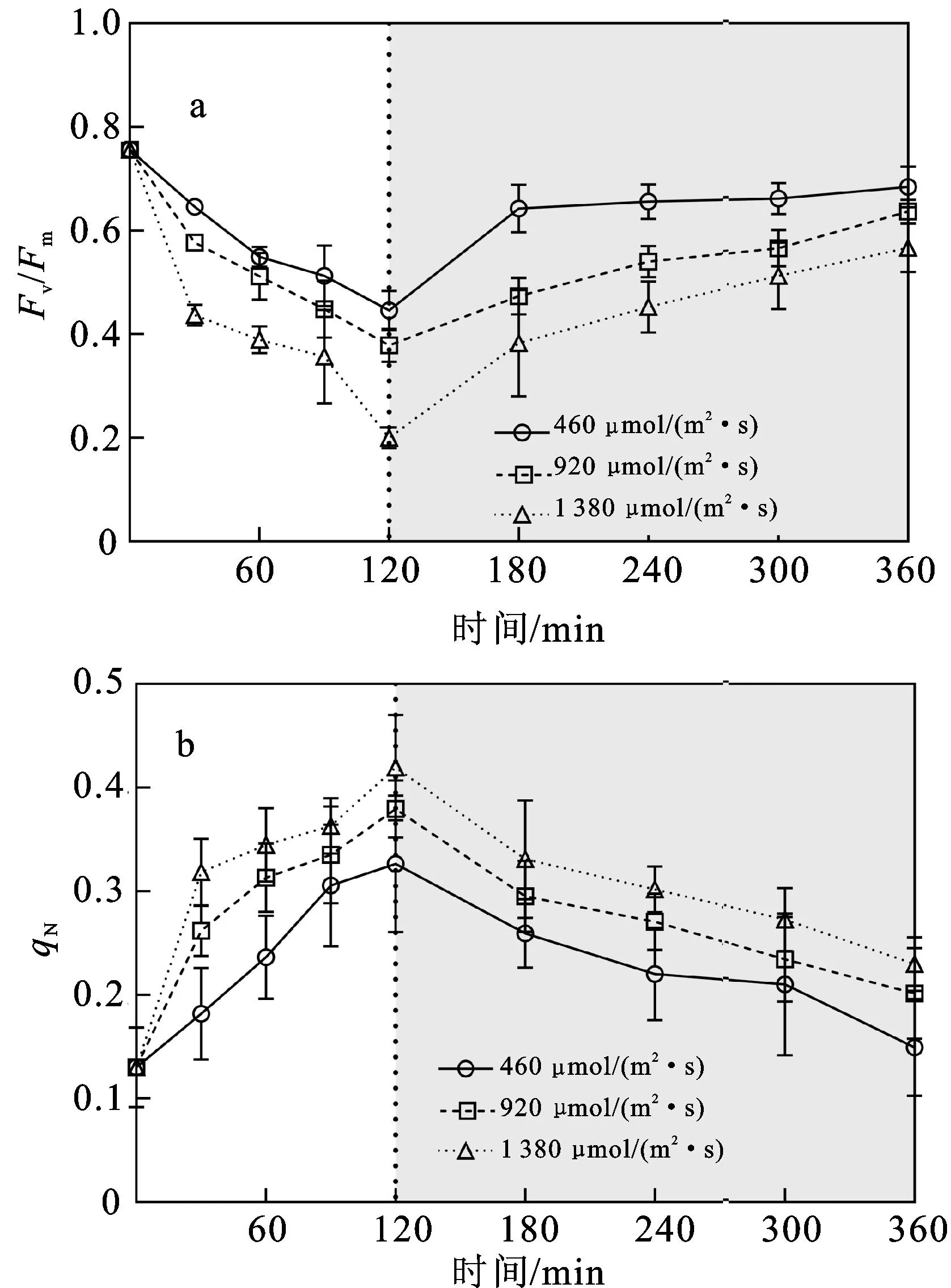
图1 强光处理(白色背景部分)和弱光恢复(灰色背景部分)过程中铜藻Fv/Fm(a)和qN(b)随时间的变化
强光处理和弱光恢复对铜藻qN的影响如图1b所示。时间和光强均对铜藻的qN有显著影响(时间:P<0.05,df=8,F=31.230;光照:P<0.05,df=2,F=12.349;表1),二者没有交互作用(P>0.05,df=16,F=0.737;表1)。铜藻的qN初始值为0.130±0.039,3种光照强度均能使qN逐渐升高。强光处理120 min后,460、920、1 380 μmol/(m2·s)光照强度下的qN分别升高为初始值的2.52倍、2.92倍和3.23倍,低光、高光处理组间qN的升高程度存在显著差异(P<0.05)。弱光恢复240 min后,qN逐渐恢复,低光处理组恢复至初始状态(P>0.05,t=-0.876,df=2),但中光(P<0.05,t=-13.482,df=2)、高光(P<0.05,t=-4.941,df=2)处理组经240 min弱光恢复后,qN仍显著高于初始状态,可见高光强会显著影响藻体的qN。
2.2 快速叶绿素荧光诱导动力学曲线参数
快速叶绿素荧光诱导动力学曲线包含诸多PSⅡ反应中心原初光化学反应的信息[29],因此本研究通过快速叶绿素荧光诱导进一步探究光强对藻体光反应过程的影响。强光处理和弱光恢复对铜藻J点相对可变荧光(VJ)、PSⅡ反应中心净关闭率(M0)、PSⅡ捕获能量从还原态质体醌A传递到质体醌B的概率(ψ0)的影响如图2所示。不同处理时间和光照强度对铜藻VJ(时间:P<0.05,df=8,F=31.231;光照:P<0.05,df=2,F=25.968;表2)、M0(时间:P<0.05,df=8,F=55.232;光照:P<0.05,df=2,F=233.498;表2)和ψ0(时间:P<0.05,df=8,F=31.712;光照:P<0.05,df=2,F=24.924;表2)均影响显著,时间和光强对M0有交互作用(P<0.05,df=16,F=5.653;表2),而VJ(P>0.05,df=16,F=1.195;表2)和ψ0(P>0.05,df=16,F=1.456;表2)的时间和光强不存在交互作用。随时间及光照强度的增加,铜藻的VJ和M0均显著升高(P<0.05),但ψ0显著降低(P<0.05)。经120 min的强光处理后,高光处理组的VJ显著高于低光处理组(P<0.05),中光处理组与低、高光处理组间无显著差异(P>0.05);各组间的M0均具有显著差异(P<0.05);中光处理组与低、高光处理组的ψ0差异不显著(P>0.05),但高光处理组的ψ0显著低于低光处理组(P<0.05)。恢复弱光240 min后,460、920、1 380 μmol/(m2·s)光强处理下的VJ分别降低至0.511±0.035、0.556±0.013、0.579±0.033,M0分别降低至0.724±0.037、0.880±0.048、1.206±0.144,ψ0随着弱光的恢复逐渐升高至初始值的91.33%、82.82%、78.64%。
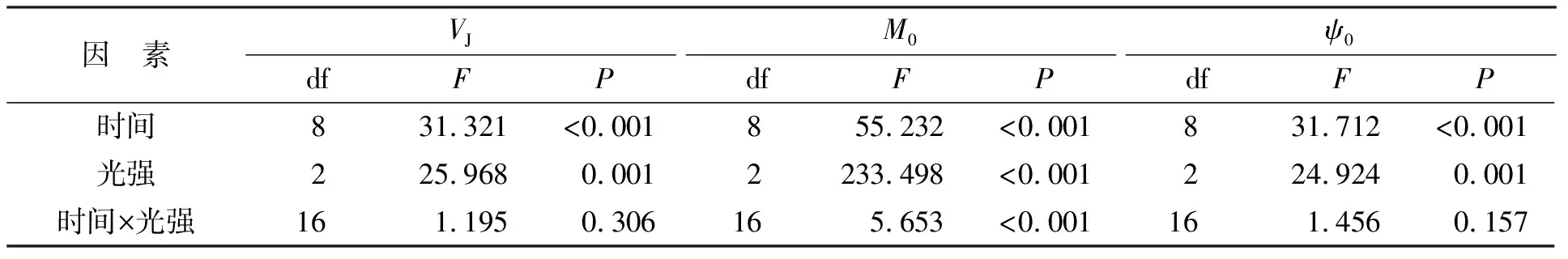
表2 不同时间和光强条件下VJ、M0和ψ0的双因素重复测量方差分析结果
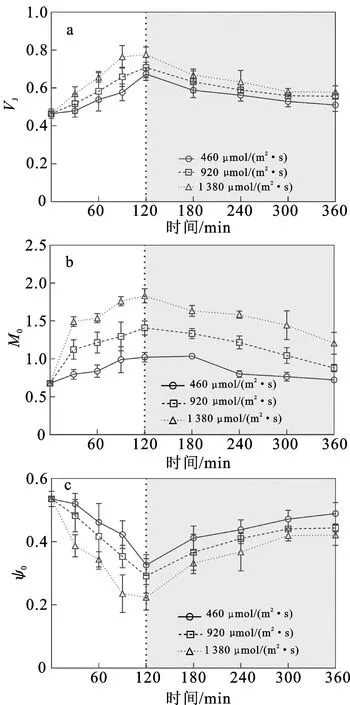
图2 强光处理(白色背景部分)和弱光恢复(灰色背景部分)过程中铜藻VJ(a)、M0(b)和ψ0(c)的变化
强光处理和弱光恢复阶段铜藻单位反应中心所吸收的光能(EABS/RC)、捕获的用于还原质体醌A的能量(ETR0/RC)、用于电子传递的能量(EET0/RC)和耗散的能量(EDI0/RC)变化如图3所示。时间和光强对铜藻的EABS/RC(时间:P<0.05,df=8,F=61.772;光照:P<0.05,df=2,F=439.305;表3)、ETR0/RC(时间:P<0.05,df=8,F=20.459;光照:P<0.05,df=2,F=15.445;表3)、EET0/RC(时间:P<0.05,df=8,F=73.794;光照:P<0.05,df=2,F=204.686;表3)和EDI0/RC(时间:P<0.05,df=8,F=72.222;光照:P<0.05,df=2,F=74.919;表3)均具有显著影响。时间和光强对EABS/RC(P<0.05,df=16,F=2.842;表3)、EET0/RC(P<0.05,df=16,F=3.560;表3)和EDI0/RC(P<0.05,df=16,F=2.644;表3)具有交互作用,对ETR0/RC无交互作用(P>0.05,df=16,F=1.307;表3)。
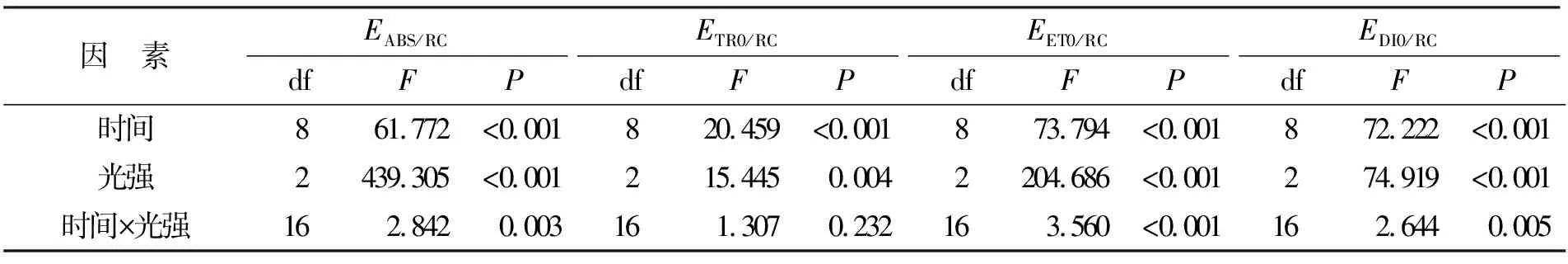
表3 不同时间和光强条件下EABS/RC、ETR0/RC、EET0/RC和EDI0/RC的双因素重复测量方差分析结果
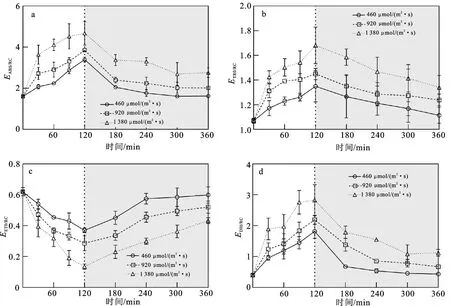
图3 强光处理(白色背景部分)和弱光恢复(灰色背景部分)过程中EABS/RC(a)、ETR0/RC(b)、EET0/RC(c)、EDI0/RC(d)的变化
随处理时间和光照强度的增加,EABS/RC、ETR0/RC和EDI0/RC均显著升高(P<0.05)。强光处理120 min后,高光处理组与中、低光处理组间的EABS/RC差异显著(P<0.05);低、中光处理组的EDI0/RC差异不显著(P>0.05),但高光处理组的EDI0/RC显著高于低光处理组(P<0.05);各组间的ETR0/RC同样显著升高(P<0.05),升高程度在高光、中光、低光处理组依次减小,高、低光处理组间差异显著(P<0.05)。恢复弱光240 min后,3种光强下的EABS/RC、ETR0/RC和EDI0/RC均随修复时间的延长而逐渐降低,低光处理组的EABS/RC、ETR0/RC和EDI0/RC分别恢复了98.96%、94.27%、91.93%。EET0/RC在3种光强处理下均显著降低(P<0.05),经120 min强光处理后,EET0/RC在3个处理组间的降低程度具有显著差异(P<0.05)。恢复弱光240 min后,低光处理组恢复至初始状态,但中、高光处理组仍显著低于初始状态。
2.3 快速光响应曲线
强光处理和弱光恢复下铜藻的快速光响应曲线的初始斜率(α)、最大相对电子传递速率(Rmax)和光饱和点(Ek) 变化如图4所示。时间和光强均对铜藻的α(时间:P<0.05,df=8,F=86.247;光照:P<0.05,df=2,F=58.106;表4)、Rmax(时间:P<0.05,df=8,F=267.223;光照:P<0.05,df=2,F=38.227;表4)和Ek(时间:P<0.05,df=8,F=6.885;光照:P<0.05,df=2,F=7.583;表4)有显著影响,且时间和光强对α(P<0.05,df=16,F=2.089;表4)和Rmax(P<0.05,df=16,F=7.579;表4)具有交互作用,对Ek(P>0.05,df=16,F=1.691;表4)无交互作用。3种光处理铜藻的α、Rmax和Ek均显著降低(P<0.05),光照强度越强降低程度越大。随着后续弱光的恢复,α和Rmax均逐渐升高,恢复240 min后,低、中、高光强处理下铜藻的α分别恢复了91.82%、84.91和77.04%;Rmax分别恢复至初始状态的90.86%、75.87%、74.86%;低光处理组的Ek恢复到初始值(P>0.05,t=-1.267,df=2),中、高光处理组分别恢复到初始值的87.78%、85.95%。高光强阻碍了电子传递,从而抑制了光合作用。

表4 不同时间和光强条件下α、Rmax和Ek的双因素重复测量方差分析结果

图4 强光处理(白色背景部分)和弱光恢复(灰色背景部分)过程中铜藻快速光响应曲线的α(a)、Rmax(b)、Ek (c)的变化
2.4 光合色素含量
强光处理和弱光恢复下铜藻中叶绿素a、叶绿素c和类胡萝卜素含量的变化如图5所示。初始状态下,铜藻中叶绿素a、叶绿素c和类胡萝卜素的质量分数分别为0.737±0.072 mg/g、0.150±0.010 mg/g和0.103±0.015 mg/g。强光处理120 min后,铜藻中的叶绿素a与叶绿素c含量均有所减少。各处理组间叶绿素a含量变化显著(P<0.05);叶绿素c含量在低、中光处理组与初始状态差异不显著(P>0.05),但在高光处理组中较初始状态显著减少(P<0.05)。铜藻中的类胡萝卜素含量在3种光强处理下均有所增加,低光处理组较初始状态差异不显著(P>0.05),中、高光处理组较初始值显著增加(P<0.05),高光处理组的类胡萝卜素含量显著高于低光处理组(P<0.05)。恢复弱光240 min后,除高光处理组的叶绿素a与叶绿素c含量未恢复到初始状态(P<0.05),其他组的叶绿素a、叶绿素c和类胡萝卜素含量均恢复至初始状态。可见,高光强使铜藻中的叶绿素含量降低,但促进了类胡萝卜素的合成。

图5 光处理对铜藻中叶绿素a (A)、叶绿素c(B)、类胡萝卜素(C)含量的影响
3 讨论
光照是所有植物生长和光合作用的能量来源,大型海藻的生长与光照强度紧密相关[30]。光照直接作用于藻体的光合器官,光系统Ⅱ对可见光的变化非常敏感,能够迅速做出响应[31-32]。高光强会降低藻类的光合活性和光合电子传递效率,引发光抑制[33]。本研究中,随着光照强度的增强及辐射时间的延长,铜藻的最大光化学量子产量(Fv/Fm)显著降低(图1a)。Fv/Fm代表当所有光系统Ⅱ反应中心都处于开放态时的量子产量,是衡量植物光合作用效率的重要指标,也能够作为藻类生物应对光胁迫等逆境条件的有效探针[34]。当藻类受到胁迫时,Fv/Fm降低[35],在本研究中的3种强光条件下,铜藻的Fv/Fm均显著降低,且光强越强,降低幅度越大。恢复弱光240 min后,铜藻的Fv/Fm出现不同程度恢复,低光处理组比中、高光处理组的恢复程度要高,说明光强越强,对藻体的损伤程度越深,其恢复越难。此外,叶绿素荧光也可以准确、迅速、无损伤地检测高光胁迫下植物光合作用的状态,其通过荧光参数的变化反映胁迫对植物的影响[36]。根据本研究中叶绿素荧光诱导曲线的结果可知,在3种光强处理下,铜藻光系统Ⅱ捕获的能量从还原态质体醌A传递到质体醌B的概率显著降低(图2c),但铜藻的VJ(处于还原状态下的电子受体质体醌A占总质体醌A的比例)随光强的增加而增加(图2a),说明光强越强,越阻碍光系统Ⅱ电子从还原态质体醌A到质体醌B的传递,进而导致大量电子在还原态质体醌A堆积,呈现出荧光从O点到J点的迅速上升[37]。铜藻光系统Ⅱ反应中心净关闭率的升高(图2b)以及最大相对电子传递速率的降低(图4b)也证实了光强越强电子传递的阻力越大。另外,铜藻反应中心吸收的、耗散的和捕获的用于还原质体醌A的能量随3种光强处理时间的延长而增加,而用于电子传递的能量降低(图3),这是因为高光胁迫使有活性的光系统Ⅱ反应中心数量减少,只有藻细胞剩余的有活性反应中心耗能效率提高,才能更好地耗散电子传递链中过多的能量[38],这与李金洵[39]对血球(Haematococcuspluvialis)的研究结果一致。综上,高光强条件下铜藻的光合作用受到抑制,光强越强,藻体的响应越明显,其光合活性的抑制程度越高。
为更好地适应环境,藻类经过长期进化,具备了多种光保护途径来抵御光胁迫[18]。非光化学淬灭是一种重要的植物光保护机制,它可以将植物吸收的过剩光能以热能的形式耗散,从而避免植物发生光损伤[40]。在本研究中,随着3种光强处理时间的延长,非光化学淬灭系数(qN)显著升高(图1b),且光强愈强,qN越大,即光系统Ⅱ的光保护能力越强,故光系统Ⅱ的光保护能力与qN的增加程度呈线性相关[41-43]。此外,光合色素可以吸收、传递和转换光能,其组成和含量直接影响植物的光合作用[44]。在本研究中,随着光强度的增加,叶绿素含量显著减少,类胡萝卜素含量显著增加(图5)。恢复弱光240 min后,色素含量有了很大程度的恢复。在王祎哲等[45]对纤细裸藻(Euglenagracilis)的研究中,低、中光强组藻体内的叶绿素a含量随光强的增大而增加,而在高光强组藻体内的光合作用受到抑制,叶绿素a含量减少;许俊宾等[46]的研究也出现相似结果。有研究表明,类胡萝卜素不仅是重要的光辅助色素,而且对叶绿素有重要保护作用,在逆境胁迫中还可以启动叶黄素循环、淬灭活性氧及淬灭激发态叶绿素等[21,47],因此认为类胡萝卜素含量的升高是藻体的一种重要保护机制。
4 结论
高光强会抑制铜藻PSⅡ反应中心的电子传递率,影响叶绿素合成,降低光合活性;但铜藻能够通过非光化学淬灭和增加类胡萝卜素合成等光保护途径来抵御高光胁迫。在后续弱光恢复阶段,最大光化学效率、非光化学淬灭、最大电子传递速率和光合色素含量均有不同程度的恢复,甚至恢复到强光暴露前的初始状态,反映出漂浮铜藻对海水表面强光的高效适应能力。这些结果可以为揭示铜藻金潮暴发时其在海水表面较强的扩散入侵能力及其生理生态学机制提供一定的理论参考。

