c-Myc、CDK12 在胃癌组织中的表达及临床意义
杨雪 程园园 田瑞华
胃癌是常见的消化系统恶性肿瘤, 近年来其发病率和死亡率均呈不断升高趋势[1]。目前胃癌治疗主要为手术治疗, 胃癌的发病与抑癌基因失活、原癌基因激活及细胞凋亡相关基因异常表达密切相关[2]。有研究证实, c-Myc 是一类经典的癌基因, 其在肿瘤组织中呈异常高表达, 并与恶性肿瘤的发生、进展及浸润关系密切相关, 并在细胞分化、增殖和凋亡等生理过程中发挥重要作用[3]。CDK-12 在调控DNA 损伤和应激损伤的细胞应答基因转录方面发挥特定作用, 其在多种恶性肿瘤中呈异常高表达[4]。研究证实, CDK-12表达可上调c-Myc 及其相关基因表达, 从而加速DNA的复制[5]。两者在恶性肿瘤中存在一定相关性, 并共同参与恶性肿瘤的发生和进展。CDK-12 是c-Myc 前体mRNA 加工必须基因。为此, 本研究对80 例胃癌患者手术标本中的c-Myc、CDK12 表达进行免疫组化法检测, 分析两者的相关性及临床意义, 现报告如下。
1 资料与方法
1.1 一般资料 收集2016 年1 月~2019 年1 月期间本院收治的80 例胃癌患者的胃癌组织和癌旁组织标本。纳入标准:均符合胃癌诊断标准[6], 并经病理学检查及影像学检查证实;符合胃癌根治手术指征;无心肝肾等脏器功能不全者;术前未行放疗和化疗;患者知情同意。排除标准:心肝肾等脏器功能不全者;合并肠道器质性、功能性疾病者;合并免疫缺陷疾病、血液系统疾病者;合并其他恶性肿瘤者;术前接受放疗、化疗等治疗者;妊娠期及哺乳期妇女;不能配合本研究随访或失访者。80 例患者中男57 例, 女23 例;年龄44~84 岁, 平均年龄(59.1±8.4)岁;有饮酒史35 例,有吸烟史30 例;肿瘤最大直径:<5 cm 56 例, ≥5 cm 24 例;分化程度:高分化30 例, 中低分化50 例;组织学分型:腺癌55 例, 黏液癌18 例, 其他7 例;TNM分期:Ⅰ~Ⅱ期26 例, Ⅲ~Ⅳ期54 例;浸润深度:未侵犯浆膜44 例, 侵犯浆膜36 例;有淋巴结转移30 例。本研究获得了医院医学伦理委员的批准。
1.2 方法
1.2.1 试剂和仪器 鼠抗人c-Myc、CDK12 单克隆抗体、羊抗鼠二抗由北京中杉金桥生物技术有限公司提供。金相显微镜WMJ-9688 由上海豫光仪器有限公司提供。
1.2.2 免疫组化法检测 将标本病理蜡块连续切片,经脱蜡、水化后用柠檬酸盐抗原修复液进行修复, 磷酸盐缓冲液(PBS)洗涤5 min, 连续3 次。用10%山羊血清在室温下密封30 min, 加入一抗, 置于4℃冰箱中过夜, 滴加二抗, 室温下孵育1 h, 用二氨基联苯氨(DAB)显色并冲洗, 苏木精复染, 脱水、透明后中性树胶封片, 镜下观察。阴性对照用PBS 代替一抗。
1.3 观察指标及评定标准 比较胃癌组织和癌旁组织中c-Myc、CDK12 阳性表达情况;分析胃癌组织中c-Myc、CDK12 阳性表达与患者临床病理特征的关系;分析c-Myc 与CDK12 阳性表达的相关性, 胃癌组织中c-Myc、CDK12 阳性表达与胃癌患者预后的关系。由2名病理科医师采用双盲法阅片, 评估每张标本切片的染色强度和细胞阳性率。细胞质和细胞核内出现棕褐色或棕黄色颗粒为阳性表达。染色程度及阳性细胞占比采用双评分、半定量法评定:无染色为0 分;淡黄色为1 分;棕黄色为2 分;棕色为3 分。每张切片任意选5个视野(×400)观察阳性细胞占比:几乎无染色计0 分;阳性细胞比例<10%计1 分;10%≤阳性细胞比例<35%计2 分;35%≤阳性细胞比例<70%计3 分;阳性细胞比例≥70%计4 分。以两者得分的乘积来判断c-Myc 及CDK12 的阳性表达, 当乘积≤4分判断为阴性, >4分判定为阳性[7]。术后进行3 年的随访, 采用电话、门诊或住院病历随访方式, 于2022 年1 月结束随访。术后6 个月内结合患者情况每隔2~4 周进行门诊复查1 次;术后6 个后每隔3~6 个月门诊复查1 次。记录患者生存情况。
1.4 统计学方法 使用SPSS21.0 统计软件进行分析, 计数资料用率(%)表示, 采用χ2检验;c-Myc、CDK12 表达关系采用Spearman 相关性分析;采用Kaplan-Meier 生存曲线分析患者生存预后, 采用log-rank 检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 胃癌组织和癌旁组织中c-Myc、CDK12 阳性表达情况比较 胃癌组织中c-Myc、CDK12 阳性表达率均明显高于癌旁组织(P<0.05)。见表1。
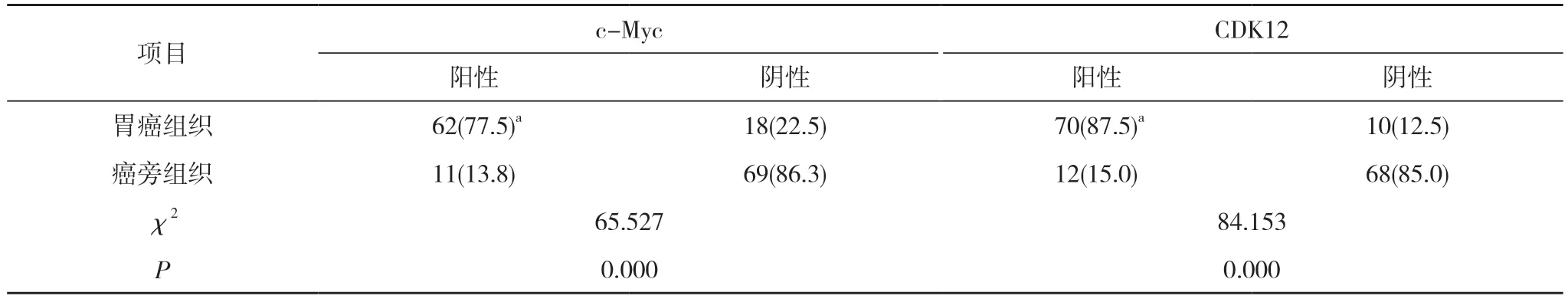
表1 80 例患者的胃癌组织和癌旁组织中c-Myc、CDK12 阳性表达情况比较[n(%)]
2.2 胃癌组织中c-Myc、CDK12 阳性表达与患者临床病理特征的关系 不同年龄、性别、肿瘤最大直径患者胃癌组织中c-Myc、CDK12 阳性表达率比较差异无统计学意义(P>0.05);中低分化、Ⅲ~Ⅳ期、侵犯浆膜、有淋巴结转移患者胃癌组织中c-Myc、CDK12 阳性表达率明显高于高分化、Ⅰ~Ⅱ期、未侵犯浆膜、无淋巴结转移患者胃癌组织(P<0.05)。见表2。
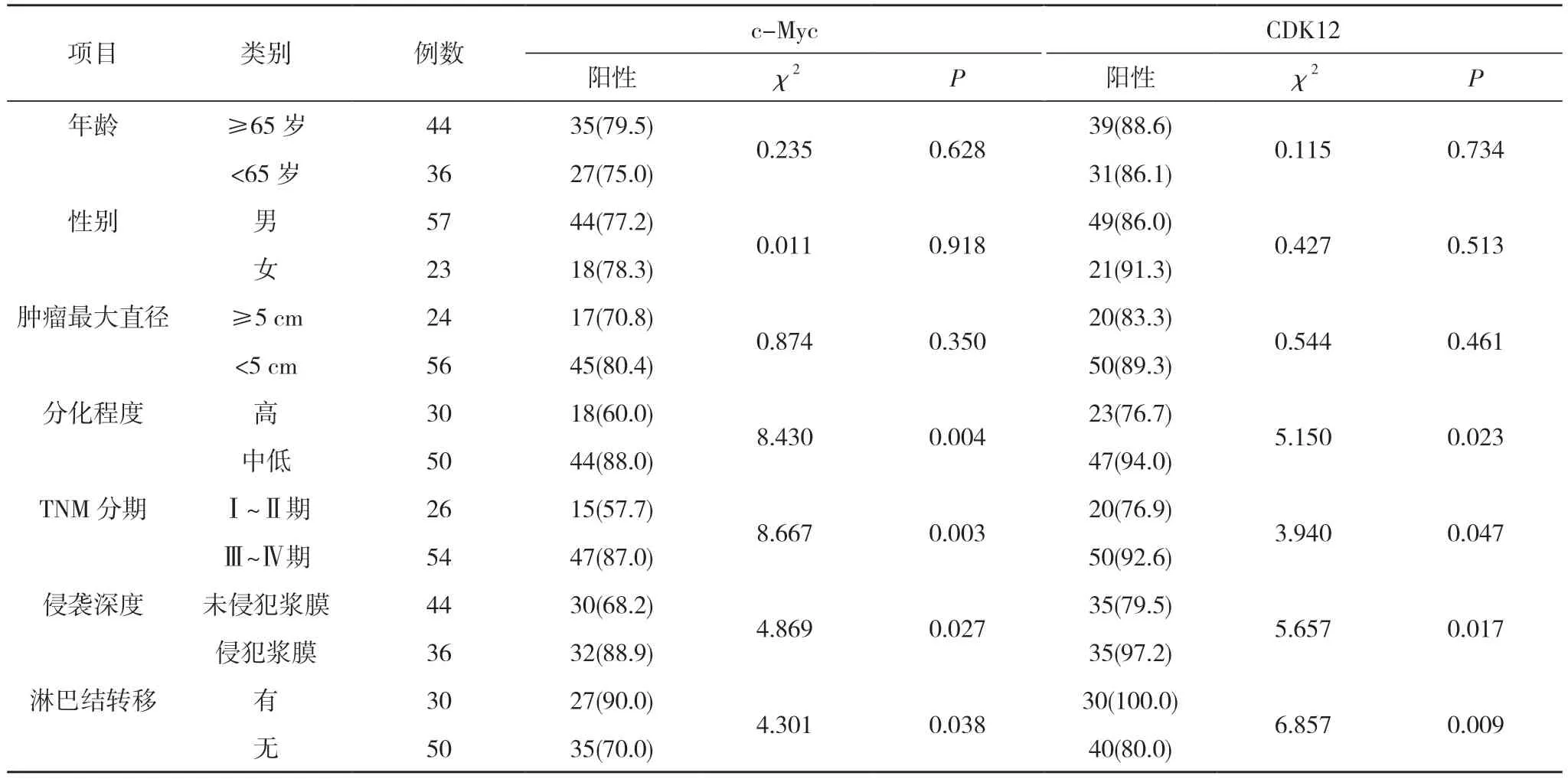
表2 胃癌组织中c-Myc、CDK12 阳性表达与患者临床病理特征的关系[n(%)]
2.3 c-Myc 与CDK12 阳性表达的相关性分析 相关分析发现, c-Myc、CDK12 在胃癌组织中的表达呈正相关性(r=0.487, P=0.016<0.05)。
2.4 胃癌组织中c-Myc、CDK12 阳性表达与胃癌患者预后的关系 胃癌组织中c-Myc、CDK12 阳性患者的3 年生存率均明显低于c-Myc、CDK12 阴性患者(P<0.05)。见表3, 图1, 图2。

图1 c-Myc 阳性和c-Myc 阴性患者的生存率比较
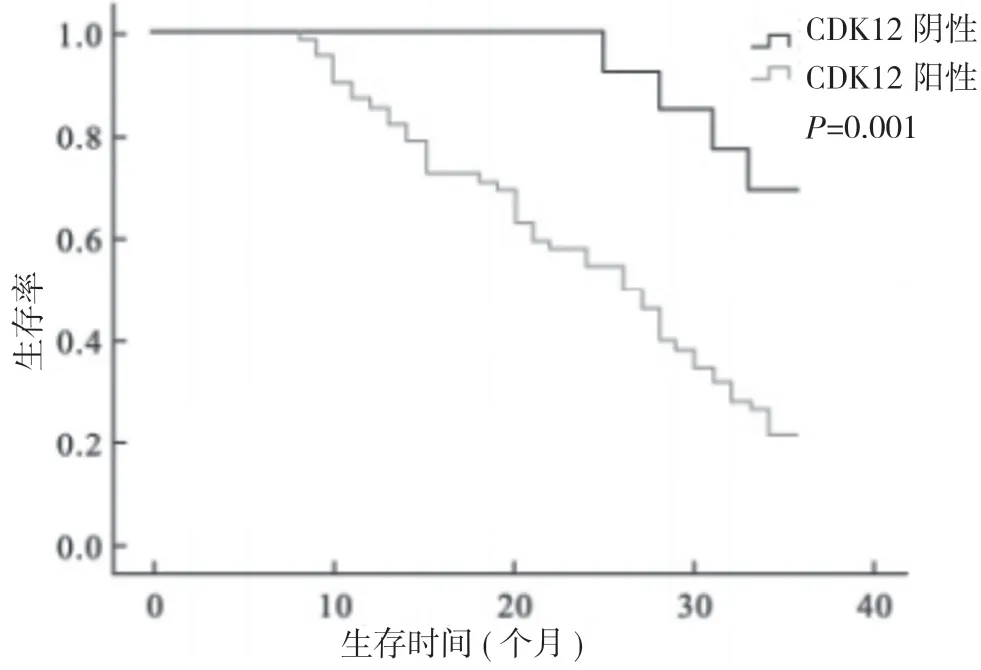
图2 CDK12 阳性和CDK12 阴性患者的生存率比较
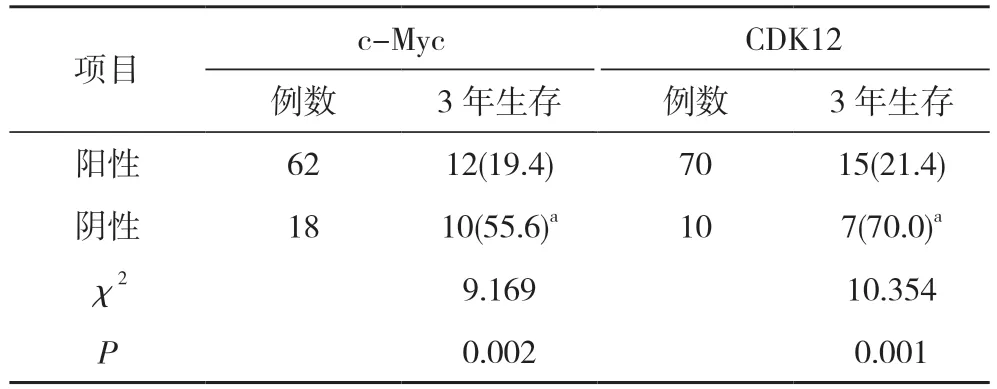
表3 胃癌组织中c-Myc、CDK12 阳性表达与胃癌患者预后的关系[n(%)]
3 讨论
胃癌的发生是由多基因、多因素共同作用的结果,其与腌制食品、高盐饮食、吸烟及幽门螺杆菌(Hp)感染等有关[8]。c-Myc 基因是细胞核内的癌基因, 可在细胞周期的不同阶段诱导细胞凋亡, 刺激细胞增生, 细胞所处生长环境及细胞接受的信号类型对细胞增殖凋亡方向起着关键性作用。c-Myc 表达异常可能是恶性肿瘤发生的重要原因。研究证实, c-Myc 在肺癌、膀胱癌等多种恶性肿瘤中高表达, 可促进肿瘤细胞分化、增殖及血管生成, 增加肿瘤向恶性转变和进一步扩散的风险[9]。有学者研究发现, 胃癌发病早期组织中的c-Myc 表达较胃炎组织明显提高[10]。本研究采用免疫组化法对胃癌组织中的c-Myc 表达水平进行检测, 结果显示, 胃癌组织、癌旁组织中c-Myc 阳性表达率分别为77.5%、13.8%, 胃癌组织中c-Myc 阳性表达率较高, 经单因素分析显示, c-Myc阳性表达率与分化程度、TNM 分期、病灶侵袭深度、淋巴结转移有关, 其表达水平与患者年龄、性别无明显关系。这一结果与黄国全等[11]报道基本相符, 说明c-Myc 表达可能与胃癌细胞侵袭、淋巴结转移等有关。CDK12 对细胞基因组的稳定性有调节作用, 并可修复受损伤的DNA, 参与细胞的分化过程。Ji 等[12]研究指出, CDK12 与卵巢癌和乳腺癌存在密切的关系。研究发现, 如乳腺癌、肺癌等恶性肿瘤患者存在CDK12 高表达, 其随着CDK12表达水平的升高, 患者肿瘤的侵袭能力也明显增强[13-19]。本 组80 例 胃 癌 组 织 标 本 中 有87.5% 的CDK12 阳性表达率, 明显高于癌旁组织的15.0%, 说明CDK12 的表达水平可能与胃癌的发生、进展有关, 经单因素分析发现, CDK12 表达水平与癌组织的TNM 分期、分化程度、肿瘤侵袭深度及淋巴结转移有关, 提示CDK12 表达水平可能在胃癌转移和浸润及进展过程中发挥重要作用。另外, 本研究对患者生存期进行随访研究, 结果显示, c-Myc 阳性表达患者的3 年生存率明显低于c-Myc 阴性表达患者, CDK12 阳性表达患者与CDK12 阴性表达患者3 年生存率比较也有相似的结果, 说明c-Myc 和CDK12 高表达可能对疾病的进展及预后均有明显的影响。而本研究对c-Myc、CDK12 在胃癌组织中的关系进行分析发现, 两者具有明显的正相关性, 表明c-Myc、CDK12 可能在胃癌的发生、进展过程中及肿瘤侵袭转移过程中发挥相互协同、相互影响的作用, 但其具体作用机理并未明确, 需在后续研究中扩大样本量, 从分子学角度进一步探讨。
总之, c-Myc、CDK12 在胃癌组织中异常高表达,两者呈正相关性, 并与肿瘤的TNM 分期、分化程度、肿瘤侵袭深度及淋巴结转移有关, 并对患者的预后有明显影响, 可通过检测两者水平评估胃癌患者的预后。

