NoSAS评分在识别深度镇静支气管镜检查期间低氧血症高风险群体中的应用
祝丁 周家明 张雯
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是睡眠时周期性出现部分或完全的上气道阻塞,以呼吸暂停和低通气为特征的疾病。该类患者一旦被麻醉镇静,容易导致上气道阻塞发作及低氧血症[1]。支气管镜检查是诊治呼吸疾病的重要手段,麻醉镇静可提高受检者的耐受性及舒适度,但会影响呼吸循环,且与支气管镜操作者共用气道,对OSAS患者而言,气流受限风险将增大,更易发生低氧血症[2]。
近年来OSAS的筛查量表不断开发,如Berlin问卷、STOP-Bang问卷、NoSAS评分等,它们筛查OSAS的应用价值已得到验证[3],本次研究旨在探索NoSAS评分能否识别深度镇静支气管镜检查期间发生低氧血症高风险的群体。
1 资料与方法
1.1 一般资料 收集2021年3 月至2021年4 月在浙江省肿瘤医院行深度镇静支气管镜检查的293 例患者的临床资料。纳入标准为:①在深度镇静(Ramsay 评分>4 分)下行支气管镜检查;②年龄>18 岁;③美国麻醉医师协会(America society of aneshesiologists,ASA)分级Ⅰ~Ⅲ级;④有完整的临床数据及麻醉前评估、麻醉术中监测、麻醉后复苏记录;⑤初始给氧方式为面罩吸氧(6 L/min)。排除标准为:①镇静麻醉前有显著的氧饱和度(saturation of peripheral oxygen,SpO2)下降(不吸氧情况下SpO2<90%);②行支气管肺泡灌洗、超声支气管镜、导航支气管镜、支气管镜介入治疗。本研究经浙江省肿瘤医院伦理委员会批准。
1.2 方法 收集患者麻醉前评估指标:包括ASA分级、基础疾病、颈围、打鼾与否、改良Mallampati 评分、甲颏距离、NoSAS评分;术中监测指标:有无发生低氧血症(轻度、严重),有无发生咳嗽、体动、心动过速、心动过缓、气道塌陷、低血压等,有无采取气道干预(托下颌、提高氧流量、储氧面罩通气、气管插管);生命体征:包括特定时间节点的血压、心率、SpO2(围支气管镜检查期间);麻醉药物用量:丙泊酚初始剂量(mg/kg)、丙泊酚总剂量(mg/kg)。
1.3 评定标准
1.3.1 NoSAS 评分包含颈围、肥胖、打鼾、年龄和性别5 个项目。颈围>40 cm 计4 分,年龄≥55 岁计4 分,体重指数(body mass index,BMI)≥30 kg/m2计5 分,25<BMI<30 kg/m2计3 分,打鼾计2 分,男性计2 分。总分≥8 分提示OSAS 高风险,否则为低风险[3]。
1.3.2 心动过速定义为心率超过100 次/分或较基线增加25%以上。心动过缓定义为心率小于55 次/分或较基线降低25%以上。低血压定义为收缩压小于90 mmHg 或较基线降低20%以上。轻度低氧血症定义为75%≤SpO2<90%,持续时间<60 s;严重低氧血症定义为SpO2<75%或75%≤SpO2<90% 并且持续时间>60 s[4]。
1.4 统计学方法 采用SPSS 20.0统计软件。分类变量以例(%)表示,连续变量以均值±标准差()或中位数(四分位数)表示。通过Kolmogorov-Smirnov检验评估连续变量的正态性。针对连续变量,使用独立样本t检验或Mann-Whitney U检验进行比较。针对分类变量,使用χ2检验或Fisher精确概率法进行比较。多因素分析采用二分类logistic回归模型。设P<0.05为差异有统计学意义。
2 结果
2.1 按NoSAS评分标准将患者分为OSAS高风险组67 例和OSAS低风险组226 例。两组的一般临床资料比较见表1。
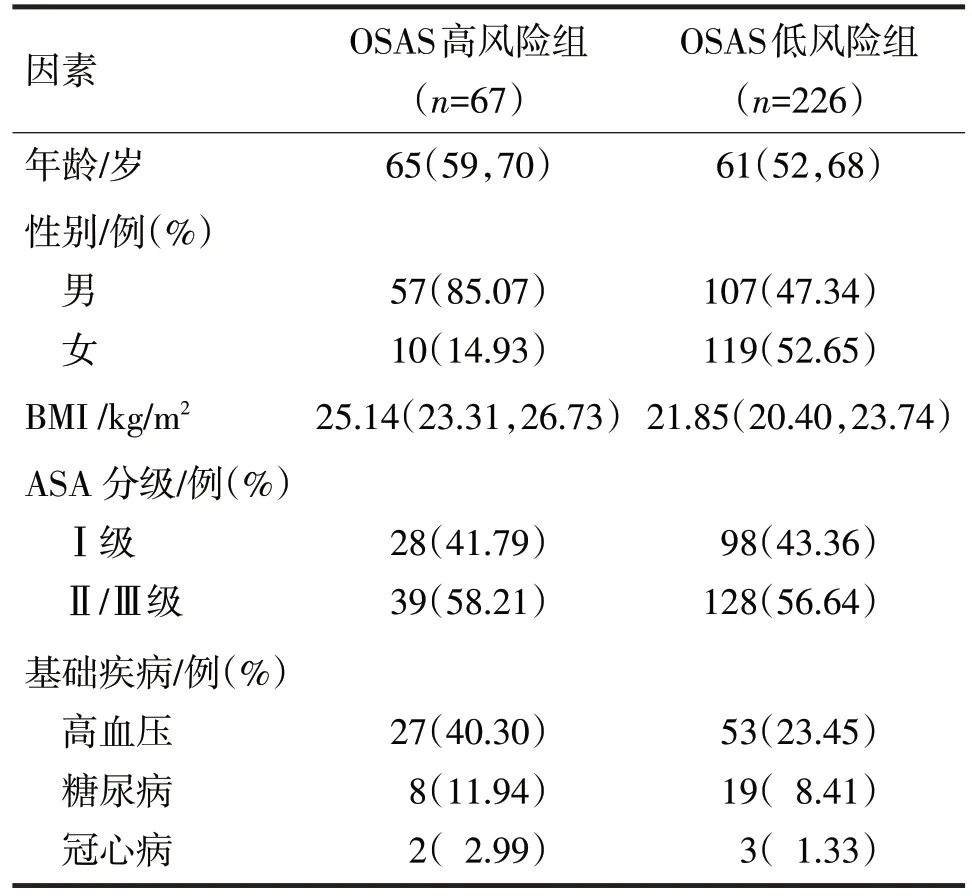
表1 两组的一般临床资料比较
由表1 可见,两组患者在年龄、BMI、性别、高血压患病率方面,差异均有统计学意义(Z分别=-3.35、-6.76,χ2分别=29.85、7.39,P均<0.05)。两组在ASA 分级、糖尿病患病率、冠心病患病率方面比较,差异均无统计学意义(χ2分别=0.05、0.77、0.15,P均>0.05)。
2.2 两组患者发生心肺不良事件及气道干预情况比较见表2

表2 两组患者发生心肺不良事件及气道干预情况比较
由表2可见,OSAS高风险组比低风险组低氧血症发生率更高,严重低氧血症发生率亦更高(χ2分别=8.47、5.51,P均<0.05)。OSAS 高风险组较OSAS 低风险组发生托下颌、提高氧流量、储氧面罩通气这三项气道干预的频率均更高(χ2分别=14.36、4.52、8.48,P均<0.05)。气管插管在两组患者中均未发生。两组患者不良反应发生率(包括咳嗽、体动、心动过速、心动过缓、气道塌陷和低血压)比较,差异均无统计学意义(P均>0.05)。
2.3 对深度镇静下支气管镜检查期间发生低氧血症的影响因素进行单因素分析,见表3。

表3 深度镇静下支气管镜检查期间发生低氧血症影响因素的单因素分析
由表3 可见,低氧血症组的患者BMI、NoSAS 评分、打鼾者比例高于非低氧血症组,差异均有统计学意义(Z分别=-5.16、-2.99、12.16,P均<0.05),基线氧饱和度指标低于非低氧血症组,差异有统计学意义(Z=-3.02,P<0.05)。而两组患者在年龄、丙泊酚总剂量、丙泊酚初始剂量、性别构成、ASA分级、吸烟状态、颈围>40 cm 者比例、改良Mallampati 评分分级、甲颏距离方面的比较,差异均无统计学意义(Z分别=-0.18、-1.13,t=-1.27,χ2分别=0.87、0.36、1.33、2.76、1.78,P均>0.05)。
2.4 将低氧血症作为因变量,以单因素分析有统计学意义的因素作为自变量,构建多因素logistic回归方程。由于NoSAS 评分是基于年龄、性别、BMI、打鼾、颈围五项因素得到的综合评分,故这五项因素不再纳入logistic回归分析。深度镇静下支气管镜检查期间发生低氧血症影响因素的多因素logistic回归分析见表4。
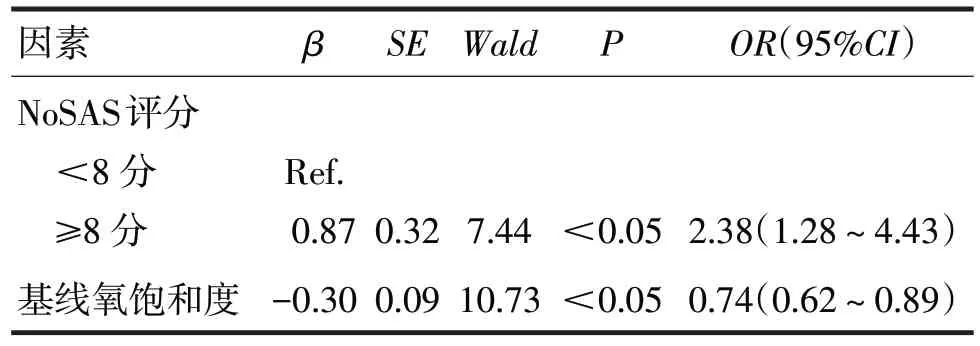
表4 深度镇静下支气管镜检查期间发生低氧血症影响因素的多因素logistic回归分析
由表4可见,相较于NoSAS评分<8分(OSAS低风险)组,NoSAS 评分≥8 分(OSAS 高风险)组显著增加发生低氧血症的风险(OR=2.38,95%CI1.28~4.43,P<0.05)。而基线氧饱和度升高显著降低发生低氧血症的风险(OR=0.74,95%CI0.62~0.89,P<0.05)。
3 讨论
据报道,镇静状态常规氧疗下行支气管镜检查,低氧血症发生率为56%~91%[5,6]。Khan 等[7]发现经多导睡眠监测(polysomnography,PSG)证实的OSAS 患者在中度镇静支气管镜检查中比非OSAS患者更容易因发生低氧血症而导致检查提前终止。Darie等[5]采用PSG证实了在清醒镇静支气管镜检查期间无氧饱和度下降的患者呼吸暂停低通气指数显著低于氧饱和度下降的患者。虽然OSAS的诊断金标准是PSG,但其较高的经济成本、耗时不便的检测过程限制了它的应用,于是各类OSAS 筛查量表应运而生。
尽管将各类OSAS 筛查量表用于评估镇静下胃肠镜检查期间低氧血症风险已有诸多报道[2],但将其用于评估镇静下支气管镜检查期间低氧血症风险却鲜有报道,至今仅有两项研究,采用的量表均为STOP-Bang 问卷[2,8]。无论是NoSAS 评分阳性者还是STOP-Bang 评分阳性者,均作为目标人群OSAS 确诊者的一种替代。相比于STOP-Bang 问卷,NoSAS评分使用更简便,而且NoSAS评分的诊断效能与STOP-Bang 问卷相类似[3],两者各自的研究相互有借鉴意义。May 等[2]报道了STOP-Bang 评分与中度镇静下支气管镜检查期间呼吸并发症(低氧血症、呼吸过缓及两者的复合结局)的发生均无相关性,而年龄、基线时耗氧量和检查时长与呼吸并发症相关。Cho等[8]发现STOP-Bang评分≥3 分比<3 分的患者在中度镇静下支气管镜检查期间更易发生心肺不良事件(含低氧血症及低血压的复合结局)(P<0.05),而对低氧血症单一结局,差异无统计学意义(P>0.05)。对无脑血管病史的亚组,STOPBang评分≥3 分与支气管镜期间心肺不良事件的发生显著相关。本次研究首次报道了NoSAS 评分≥8 分即OSAS 高风险的患者在深度镇静支气管镜检查期间会更容易出现低氧血症,因此更需要气道干预(托下颌、提高氧流量、储氧面罩通气)。多因素logistic回归分析显示NoSAS评分≥8分即OSAS高风险是低氧血症发生的独立危险因素。研究设计的差别可能可解释上述结论的不同。第一,May等[2]将低氧血症定义为支气管镜检查期间发生SpO2<85%,而Cho 等[8]和本研究定义为SpO2<90%。故May 等[2]的研究诊断低氧血症的阈值明显高于Cho 等[8]的研究和本研究。若按SpO2<90%的标准,May等[2]的研究中OSAS高风险者低氧血症的发生率是被低估的。第二,May等[2]的研究纳入基线时需吸氧的群体,得出基线时耗氧量与呼吸并发症相关的结论,故其呼吸并发症不仅是因镇静后上气道阻塞引起,还可能由基础疾病加重所致。而Cho等[8]的研究和本研究排除基线SpO2<90%的群体,减弱了基础疾病对呼吸并发症的干扰。第三,为削弱支气管镜操作对呼吸并发症的影响,Cho等[8]的研究和本研究将支气管肺泡灌洗、超声支气管镜、导航支气管镜及支气管镜介入治疗的群体排除在外,而May等[2]未将上述群体排除在外。此外,本研究还发现基线SpO2升高显著降低发生低氧血症的风险,这与May 等[2]的研究得出的结论基线时耗氧量增加会增加呼吸并发症风险基本一致。
气道干预方面,本研究发现相较于OSAS 低风险组,OSAS高风险组发生托下颌、提高氧流量、储氧面罩通气的频率均更高。Cho等[8]的研究中,两组发生托下颌的频率无明显差异,且均未发生储氧面罩通气和气管插管。下列原因可能可解释两结论的差异。第一,本研究是深度镇静下行支气管镜检查,而Cho 等[8]的研究为中度镇静。镇静深度越浅,会使部分OSAS 患者尚未达到发生上气道阻塞的镇静阈值,维持在上气道狭窄但不完全阻塞的状态,SpO2就不会下降,也就无需气道干预。第二,Cho 等[8]的研究未将提高氧流量作为气道干预的指标进行分析。第三,在本研究中,当出现SpO2<95%时,采取托下颌;当出现轻度低氧血症,则采取托下颌和提高氧流量;当出现严重低氧血症,采取储氧面罩通气。而Cho等[8]的研究中,当发生低氧血症,先将鼻导管氧疗流量由3 L/min 调至10 L/min,后续视SpO2情况行气道干预。而多数患者经10 L/min氧疗后,可能低氧情况改善,也就无需再采取托下颌等气道干预。
本研究的不足:①研究范围局限,本院为肿瘤专科医院,前来就诊的多为肿瘤患者,可能影响结论在普通人群中的解释及应用。②镇静镇痛状态下,通过呼气末二氧化碳监测发现的通气异常要早于SpO2下降和可观察到的通气不足及呼吸暂停[9],未能监测该指标,可能会漏诊通气异常的患者。③纳入患者ASA分级多为Ⅰ~Ⅱ级,而ASA分级更高的患者才是发生低氧血症的高危人群,对该类人群开展研究意义更大。④麻醉复苏阶段,虽已停用麻醉镇静药,但部分患者药效仍存在,尚未恢复清醒,若患有OSAS,则存在低氧血症、舌根后坠、窒息等风险,本研究对此未进一步分析。
综上所述,NoSAS 评分有助于识别深度镇静支气管镜检查期间发生低氧血症高风险的群体,为预防及干预低氧血症提供重要依据。

