LPS诱导巨噬细胞M1型极化对肿瘤生长的影响
魏晓环 单前前 朱军
[摘要] 目的 研究脂多糖(lipopolysaccharide,LPS)誘导巨噬细胞M1型极化对肿瘤生长的影响。方法 将Balb/c雌性小鼠随机分为对照组和实验组。Renca细胞皮下建模,待肿瘤体积生长至50mm3时瘤旁注射生理盐水(100μl/只, 1次/2d)或LPS(100μg/只,1次/2d),采用流式细胞术检测肿瘤相关巨噬细胞M1型极化水平。将小鼠肿瘤细胞系(ML-1、MC38、Renca)分成三组:空白组(完全培养基加入50%DMEM基础培养基)、对照组(完全培养基加入50%巨噬细胞培养基上清液)和实验组(完全培养基加入50%LPS预处理的巨噬细胞培养基上清液)。采用细胞计数试剂-8(cell counting kit-8,CCK-8)实验检测肿瘤细胞增殖情况;采用流式细胞术检测肿瘤细胞周期及凋亡情况。 结果 经LPS处理后肿瘤相关巨噬细胞M1型比例增多(P<0.001),从而增强其抗肿瘤功能;LPS诱导巨噬细胞M1型极化可显著抑制肿瘤细胞的增殖(Renca:P=0.023;ML-1:P=0.045);LPS诱导巨噬细胞M1型极化可引起肿瘤细胞周期G0/G1(MC38:P=0.011;ML-1:P=0.022)或S期(Renca:P=0.022)阻滞,进而抑制细胞分裂;LPS诱导巨噬细胞M1型极化可引起肿瘤细胞凋亡(Renca:P=0.04;ML-1:P=0.007)。结论 LPS可通过诱导巨噬细胞M1型极化发挥抗肿瘤功能。
[关键词] 巨噬细胞;M1型极化;脂多糖;抗肿瘤
[中图分类号] R735 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.03.012
Effect of LPS-induced M1 polarization of macrophages on tumor growth
WEI Xiaohuan1, SHAN Qianqian2, ZHU Jun3
1.Department of Science and Education, Xuzhou Central Hospital, Xuzhou 221004, Jiangsu, China; 2.Department of Pain, General Hospital of Xuzhou Mining Group, Xuzhou 221006, Jiangsu, China; 3.Department of Emergency, Xuzhou Central Hospital, Xuzhou 221004, Jiangsu, China
[Abstract] Objective To study the effect of lipopolysaccharide (LPS)-induced M1 polarization of macrophages on tumor growth. Methods Female Balb/c mice were randomly divided into control group and experimental group. Renca cells were used to establish subcutaneous tumor model. NaCl (100μl/mice, once every two days) or LPS (100μg/mice, once every two days) was injected to the tumor side when the tumor grew to 50mm3. The M1 polarization level of tumor-associated macrophages was detected by flow cytometry. Mouse tumor cell lines (ML-1, MC38, Renca) were divided into three groups: blank group (complete medium with 50% DMEM basal medium), control group (complete medium with 50% medium supernatant of cultured macrophages) and experimental group (complete medium with 50% medium supernatant of LPS pretreated cultured macrophages). The proliferation of tumor cells was detected by cell counting kit-8 (CCK-8). The cell cycle and apoptosis of tumor cells were detected by flow cytometry. Results The proportion of tumor-associated macrophages M1 increased after LPS treatment (P<0.001), thus enhancing its anti-tumor function. LPS-induced M1 polarization of macrophages can significantly inhibit the proliferation of tumor cells (Renca: P=0.023, ML-1: P=0.045). LPS-induced M1 polarization of macrophages blocked G0/G1 phase (MC38: P=0.011, ML-1: P=0.022) or S phase (Renca: P=0.022) of tumor cell cycle, and then cell division was inhibited. LPS-induced M1 polarization of macrophages significantly induced apoptosis of tumor cells (Renca: P=0.04, ML-1: P=0.007). Conclusion LPS can play an anti-tumor role by inducing M1 polarization of macrophages.
[Key words] Macrophage; M1 polarization; Lipopolysaccharide; Anti-tumor
巨噬细胞(macrophages,M)是一种位于组织内的白细胞,由血液中的单核细胞穿出血管进入组织后分化形成,具有体积增大、溶酶体增多及吞噬功能增强的特点[1]。M在免疫系统中可被分为经典活化的M1型和选择性活化的M2型,分别执行促炎和抗炎功能,M的极性对恶性肿瘤的进展非常重要[2]。M2是引起肿瘤进展、转移和治疗抗性的关键驱动因素,而M1具有抑制和杀伤肿瘤的作用[3-4]。因此诱导M向M1型极化在抗肿瘤过程中具有重要意义。
脂多糖(lipopolysaccharide,LPS)是革兰阴性菌外膜的主要成分,由脂类A、核心多糖和O-特异性多糖三部分组成[5]。研究表明LPS可直接诱导M向M1型极化;此外,LPS持续刺激可下调M半乳糖凝集素-9(galectin-9,GAL-9)的表達和分泌,减弱T细胞免疫球蛋白黏蛋白结构域分子3(T cell immunoglobulin and mucin domain,TIM-3)与GAL-9之间的作用,间接诱导M向M1型极化[6-9]。本研究旨在探讨LPS诱导M向M1型极化后对肿瘤抑制作用的影响。
1 材料与方法
1.1 材料与试剂
DMEM基础培养基购自美国Gibco公司。生理盐水购自Sigma Aldrich公司。细胞计数试剂-8(cell counting kit-8,CCK-8)购自徐州微科曼生物工程有限公司。PI周期试剂盒购自南京凯基生物科技发展有限公司。流式抗体购自美国Biolegend公司。小鼠巨噬细胞RAW264.7、小鼠肝癌细胞ML-1、小鼠肾癌细胞Renca、小鼠结肠癌细胞MC38购自上海中科院细胞库。6~8周龄的Balb/c雌性小鼠(SPF级别)购于北京维通利华生物科技有限公司,饲养于SPF级实验动物中心。本研究经徐州矿务集团总医院生物医学研究伦理委员会审批通过(伦理审批号:[2022]072804)。
1.2 细胞培养
小鼠RAW264.7、MC38、Renca、ML-1细胞均使用DMEM培养基,常规培养箱培养。
1.3 CCK-8检测细胞增殖
收集肿瘤细胞离心后计数,按细胞密度为3× 103个/孔接种至96孔板中,并设空白组(使用完全培养基加入50%DMEM基础培养基)、对照组(完全培养基加入50%DMEM基础培养基培养M 24h后收集的培养基上清液)、实验组(完全培养基加入50%DMEM基础培养基培养24h经LPS预处理后的M培养基上清液),总体积为100µl/孔。培养肿瘤细胞3d后每孔加入10μl体系的CCK-8试剂,轻拍使其分散均匀,放入培养箱中继续孵育,2h后酶标仪测定450nm波长处吸光度值(A值)。
1.4 流式细胞术检测细胞周期
接种1×106个/孔肿瘤细胞于6孔板中,分组同上述CCK-8实验。48h后收集细胞,离心弃上清液,磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗两遍,调整细胞浓度为2×106个/ml。取1ml单细胞悬液,离心弃上清液,在细胞中加入70%的冷乙醇1ml,4℃固定过夜。用PBS洗去固定液,加入提前配制好的400μl体系PI/RNaseA染色工作液,室温避光30~60min内流式检测。
1.5 流式细胞术检测细胞凋亡
接种3×105个/孔肿瘤细胞于6孔板中,分组同上述CCK-8实验。48h后收集细胞,离心弃上清液,PBS清洗两遍,调整细胞浓度为2×105个/ml。取1ml单细胞悬液,2000转/min离心3min,弃上清液;加入500µl体系Binding Buffer重悬细胞,并加入5µl体系Annexin V-FITC和5µl体系PI染色液充分混匀后,室温避光孵育15min后流式检测。
1.6 动物实验
将小鼠随机分为对照组和实验组,使用小鼠肾癌Renca细胞系建立皮下移植瘤模型,待肿瘤体积生长至50mm3时瘤旁注射生理盐水(100μl/只, 1次/2d)或LPS(100μg/只,1次/2d)。3周后处死小鼠,剥离肿瘤,测量肿瘤重量和体积,将肿瘤组织研磨制备成单细胞悬液,使用PE anti-mouse-iNOS等抗体染色,采用流式细胞术检测巨噬细胞M1型极化情况。
1.7 统计学方法
采用SPSS 16.0统计学软件对数据进行处理分析。计量资料以均数±标准差(![]() )表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。统计图使用GraphPad Prism 5软件绘制。
)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(One-way ANOVA)。P<0.05为差异有统计学意义。统计图使用GraphPad Prism 5软件绘制。
2 结果
2.1 检测LPS对肿瘤生长的影响
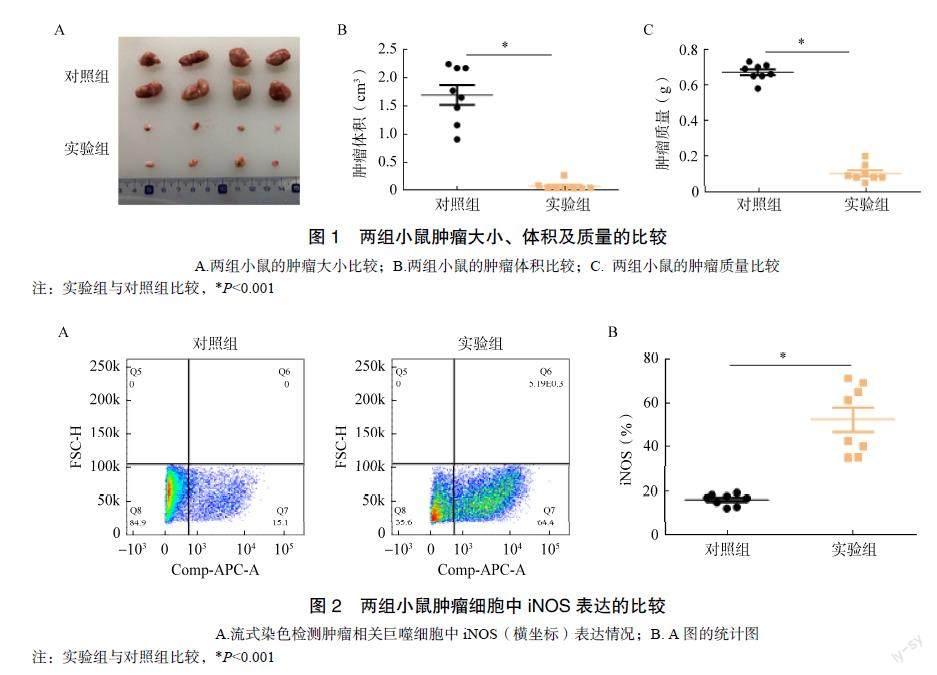
与对照组相比,实验组小鼠肿瘤体积明显缩小、体质量减轻(瘤旁注射LPS使肿瘤体积由对照组的1.691cm3下降至0.076cm3,P<0.001;肿瘤质量由对照组的0.671g降低至0.103g,P<0.001)。这说明瘤旁注射LPS可抑制肿瘤生长,见图1。
2.2 检测LPS对肿瘤相关巨噬细胞极化的影响
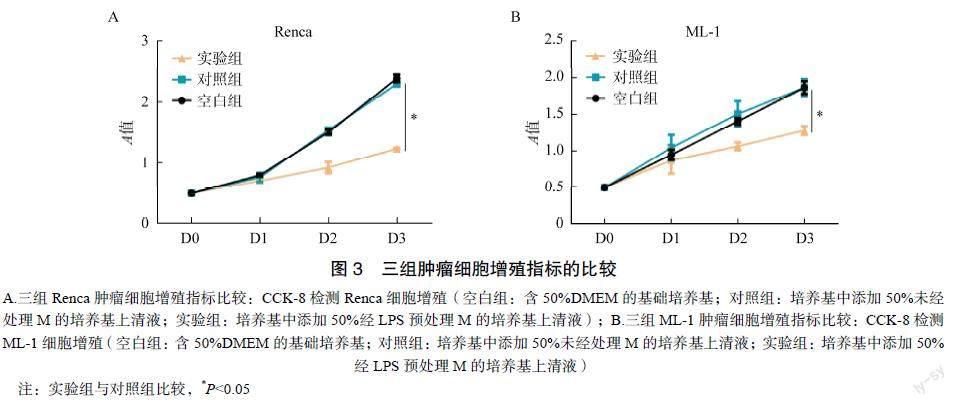
为探究LPS抑制肿瘤生长的原因,本研究对肿瘤相关M1型极化进行检测。剥离小鼠肿瘤组织并经研磨制备成单细胞悬液,流式分析在F4/80(+)、CD11b(+)M中诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达情况。实验结果显示,与对照组比较,实验组小鼠的肿瘤相关M中iNOS表达比例增多(16.2%∶52.55%,P<0.001)。这说明LPS可通过诱导肿瘤相关M1型极化而增强其抗肿瘤功能,见图2。
2.3 检测LPS诱导M1型极化后对肿瘤细胞增殖的影响
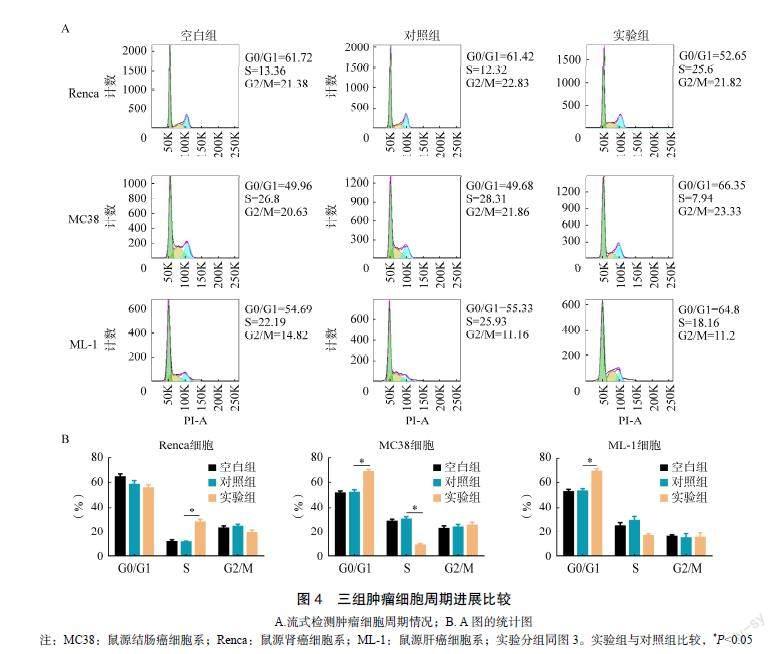
为检测LPS诱导M1型极化对肿瘤细胞增殖的影响,本研究收集M培养基上清液与Renca、ML-1细胞进行共培养实验,研究M经LPS预处理后培养基上清液对肿瘤细胞增殖功能的影响。实验结果顯示,与对照组相比,实验组的M培养基上清液显著抑制肿瘤细胞生长(Renca细胞空白组A值为2.390;对照组A值为2.300;实验组A值为1.235;P=0.023。ML-1细胞空白组A值为1.865;对照组A值为1.865;实验组A值为1.280;P=0.045)。结果证明,LPS诱导M1型极化后可显著抑制肿瘤细胞的增殖,见图3。
2.4 检测LPS诱导M1型极化对肿瘤细胞周期的影响
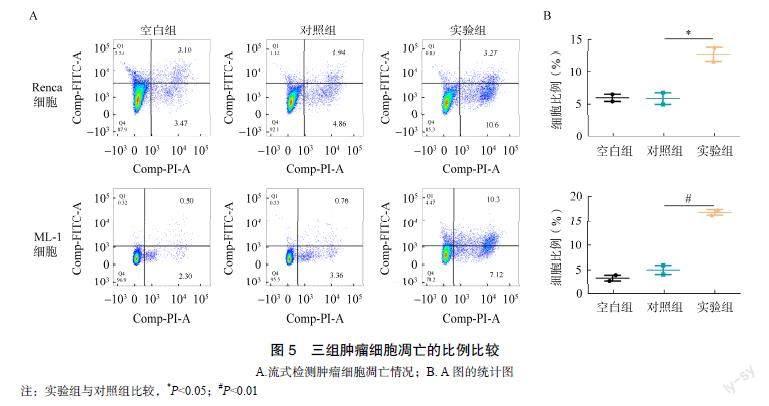
为检测LPS诱导M1型极化抑制肿瘤细胞增殖的原因,本研究利用流式检测肿瘤细胞的细胞周期。实验结果显示,与对照组比较,实验组的M培养基上清液显著诱导小鼠肿瘤细胞发生S或G0/G1期阻A.三组Renca肿瘤细胞增殖指标比较:CCK-8检测Renca细胞增殖(空白组:含50%DMEM的基础培养基;对照组:培养基中添加50%未经处理M的培养基上清液;实验组:培养基中添加50%经LPS预处理M的培养基上清液);B.三组ML-1肿瘤细胞增殖指标比较:CCK-8检测ML-1细胞增殖(空白组:含50%DMEM的基础培养基;对照组:培养基中添加50%未经处理M的培养基上清液;实验组:培养基中添加50%经LPS预处理M的培养基上清液)滞,其中Renca细胞接受实验组的M培养基上清液处理,S期比例与空白组(13.36%)或对照组(12.32%)相比增加至25.6%(P=0.022);MC38细胞接受实验组的巨噬细胞培养基上清液处理,G0/G1期比例与空白组(49.96%)或对照组(49.68%)相比增加至66.35%(P=0.011);ML-1细胞接受实验组的M培养基上清液处理,G0/G1期比例与空白组(54.69%)或对照组(55.33%)相比增加至64.8%(P=0.022)。表明LPS诱导M1型极化后可通过阻止肿瘤细胞周期进展而抑制细胞分裂,见图4。
2.5 检测LPS诱导M1型极化对肿瘤细胞凋亡的影响
为检测LPS诱导M1型极化对肿瘤细胞凋亡的影响,本研究利用流式检测肿瘤细胞的凋亡情况。实验结果显示,与对照组相比,实验组的M培养基上清液可显著诱导肿瘤细胞凋亡,其中Renca细胞接受实验组的M培养基上清液处理,凋亡细胞比例与空白组(6.57%)和对照组(6.80%)相比增加至13.87%(P=0.040);ML-1细胞接受实验组的M培养基上清液处理,凋亡细胞比例与空白组(2.80%)和对照组(4.12%)相比增加至17.42%(P=0.007)。结果表明,LPS诱导M1型极化后可显著诱导肿瘤细胞凋亡,见图5。
3 讨论
LPS结构复杂性暗示该分子在细菌细胞中执行多种功能,作为细菌内毒素,其脂质A成分是免疫细胞识别的病原相关分子,可有效激活机体的先天免疫反应[10]。因此,LPS是一种重要的免疫激活剂,当LPS进入机体后首先激活M,诱导M1型极化,引起炎症反应;而M1型具有直接抗肿瘤功能[11-13]。尽管对于LPS功能的研究已有很多,但LPS对肿瘤微环境中免疫细胞功能的影响仍有较多的争论。
鉴于适应性免疫应答是机体杀伤肿瘤的直接途径,研究调控适应性免疫应答的手段已成为当前肿瘤免疫治疗研究的热点[14];但适应性免疫系统的激活依赖于先天性免疫应答[15]。在肿瘤发生的初始阶段,肿瘤细胞首先逃避机体先天性免疫应答,因此先天性免疫应答对肿瘤进展具有重要作用。M作为先天性免疫细胞中最重要的细胞群之一,其功能具有重要的可塑性,而这种可塑性基于M的两种亚型,即经典活化的M1型和选择性活化的M2型。众多研究者也利用该特性对M进行极化调控,因此在已发表的文章中并不缺乏利用各种途径调控M免疫功能的研究,如通过使用一些益生菌菌株(如大肠杆菌、粪肠球菌共生菌群-1)或微生物感染和相关的副产物(如LPS和干扰素-γ)可激活M至M1表型以清除病原体,而另一些益生菌(如金黄色葡萄球菌、土拉弗朗西斯菌)可诱导M2发挥抗炎作用[16-21]。由于M是机体抵抗肿瘤的第一道防线,联合其功能的可塑性,该领域研究有望给肿瘤的临床治疗带来更多的希望。本研究发现,瘤旁注射诱导M1型极化的经典刺激物LPS可显著抑制肿瘤的生长,流式分析发现LPS刺激诱导肿瘤相关M1型极化,说明LPS可通过诱导肿瘤相关M1型极化发挥抗肿瘤效果。
研究表明,LPS可通过诱导M分泌多种细胞因子,如恶病质素或肿瘤坏死因子从而达到杀伤肿瘤的作用[22-23]。因此本研究探究M经LPS预处理后的培养基上清液对多种肿瘤细胞增殖、周期及凋亡的影响,结果显示LPS预处理的M培养基上清液可直接抑制肿瘤细胞增殖,引起细胞周期阻滞,并且诱导肿瘤细胞凋亡。该结果证实LPS可诱导M分泌抑制肿瘤增殖和存活的细胞因子。
综上所述,本研究证明在抗肿瘤的复杂过程中,LPS诱导M1型极化后,使肿瘤细胞周期发生G0/G1或S期阻滞,抑制肿瘤细胞生长,且诱导肿瘤细胞凋亡,从而达到有效的抗肿瘤功能。该研究为LPS通过干预M1型极化发挥抗肿瘤功能提供部分细胞和动物水平的直接证据;LPS对于M调控其他免疫细胞抗肿瘤功能的影响及其机制有待进一步探讨。
利益沖突:所有作者均声明不存在利益冲突。
[参考文献]
[1] GENTEK R, MOLAWI K, SIEWEKE M H. Tissue macrophage identity and self-renewal[J]. Immunol Rev, 2014, 262: 56–73.
[2] KADOMOTO S, IZUMI K, MIZOKAMI A. Macrophage polarity and disease control[J]. Int J Mol Sci, 2021, 23(1): 144.
[3] WU K, LIN K, LI X, et al. Redefining tumor-associated macrophage subpopulations and functions in the tumor microenvironment[J]. Front Immunol, 2020, 11: 1731.
[4] LI P, HAO Z, WU J, et al. Comparative proteomic analysis of polarized human THP-1 and mouse RAW264.7 macrophages[J]. Front Immunol, 2021, 12: 700009.
[5] KNIREL Y A, ANISIMOV A P, KISLICHKINA A A, et al. Yersinia pseudotuberculosis lipopolysaccharide of the complex[J]. Biomolecules, 2021, 11(10): 1410.
[6] PARK B S, LEE J O. Recognition of lipopolysaccharide pattern by TLR4 complexes[J]. Exp Mol Med, 2013, 45(12): e66.
[7] PERVIN M, KARIM M R, KURAMOCHI M, et al. Macrophage populations and expression of regulatory inflammatory factors in hepatic macrophage-depleted rat livers under lipopolysaccharide (LPS) treatment[J]. Toxicol Pathol, 2018, 46(5): 540–552.
[8] SHAPOURI-MOGHADDAM A, MOHAMMADIAN S, VAZINI H, et al. Macrophage plasticity, polarization, and function in health and disease[J]. J Cell Physiol, 2018, 233(9): 6425–6440.
[9] ZHANG W, ZHANG Y, HE Y, et al. Lipopolysaccharide mediates time-dependent macrophage M1/M2 polarization through the Tim-3/Galectin-9 signalling pathway[J]. Exp Cell Res, 2019, 376(2): 124–132.
[10] WANG X Y, QUINN P J. Lipopolysaccharide: Biosynthetic pathway and structure modification[J]. Prog Lipid Res, 2010, 49(2): 97–107.
[11] JEWORREK C, EVERS F, HOWE J, et al. Teasing half-bilayers: LPS versus phospholipid monolayers, mechanics, asymmetry and implications for drug permeation[J]. Biophys J, 2011, 100(9): 2169–2177.
[12] COLEMAN D L, CULVER K E, RYAN J L. Effect of lipopolysaccharide on the stimulation of macrophage Fc-dependent phagocytosis by splenic B lymphocytes[J]. Cell Immunol, 1985, 91(2): 520–527.
[13] ZANONI I, GRANUCCI F. Differences in lipopolysaccharide-induced signaling between conventional dendritic cells and macrophages[J]. Immunobiology, 2010, 215(9-10): 709–712.
[14] SUN L, WANG X, SAREDY J, et al. Innate-adaptive immunity interplay and redox regulation in immune response[J]. Redox Biol, 2020, 37: 101759.
[15] VESELY M D, KERSHAW M H, SCHREIBER R D, et al. Natural innate and adaptive immunity to cancer[J]. Annu Rev Immunol, 2011, 29: 235–271.
[16] GORDON S. The macrophage[J]. Bio Essays, 1995, 17(11): 977–986.
[17] YU Y, YUE Z, XU M, et al. Macrophages play a key role in tissue repair and regeneration[J]. Peer J, 2022, 10: e14053.
[18] ESSANDOH K, LI Y, HUO J, et al. MiRNA-mediated macrophage polarization and its potential role in the regulation of inflammatory response[J]. Shock, 2016, 46(2): 122–131.
[19] WANG Y, LIU H, ZHAO J. Macrophage polarization induced by probiotic bacteria: A concise review[J]. Probiotics Antimicro, 2020, 12(3): 798–808.
[20] VERDEGUER F, AOUADI M. Macrophage heterogeneity and energy metabolism[J]. Exp Cell Res, 2017, 360(1): 35–40.
[21] SCHUMANN J. It is all about fluidity: Fatty acids and macrophage phagocytosis[J]. Eur J Pharmacol, 2016, 785: 18–23.
[22] WHITE J R, CHAIT A, KLEBANOFF S J, et al. Bacterial lipopolysaccharide reduces macrophage lipoprotein lipase levels: An effect that is independent of tumor necrosis factor[J]. J Lipid Res, 1988, 29(10): 1379–1385.
[23] OKRUHLICOVA L, CICAKOVA Z, FRIMMEL K, et al. Lipopolysaccharide-induced redistribution of myocardial connexin43 is associated with increased macrophage infiltration in both normotensive and spontaneously hypertensive rats[J]. J Physiol Pharmacol, 2018, 69(5): 709–717.
(收稿日期:2023–02–16)
(修回日期:2023–12–12)
![]()
聲 明
近期,有不法人员通过各种渠道获取本刊第一作者或通信作者电子邮箱,冒用《中国现代医生》编辑部向本刊作者发送诈骗邮件,以延误职称晋升为由,要求作者添加微信处理相关事务骗取作者费用,严重损害作者的利益和我编辑部形象。鉴于此,《中国现代医生》编辑部郑重声明:
1. 本刊暂无微信联系方式,唯一投稿渠道为《中国现代医生》官网(http://www.zgxdys.ac.cn)。杂志官方信箱为:zgxdys@imicams.ac.cn。
2.《中国现代医生》是万方医学、中国知网、中文科技期刊数据库全文收录期刊。期刊出版后1个月左右可在上述数据库的网站查阅作者论文。
3.《中国现代医生》编辑部目前收取版面费仅有对公转账一种方式。开户行:中国建设银行北京雅宝路支行;开户名称:中国医学科学院医学信息研究所;银行帐号:11001028400059856368。

