芽孢杆菌ZL397的鉴定及其对米尔伊丽莎白菌抑菌活性的研究
■ 竺利红 尹小良 施跃峰 皮雄娥*
(1.浙江省农业科学院植物保护与微生物研究所,浙江杭州 310021;2.浙江省绍兴市越城区东湖街道事业综合服务中心,浙江绍兴 312001)
米尔伊丽莎白菌(Elizabethkingia miricola)是一种临床新兴条件致病菌,于2003 年在和平号空间站的冷凝水中首次被分离到[1]。2008 年,美国第一例报告米尔伊丽莎白菌感染病例是一名血液科患者[2]。随后,越来越多的研究表明,在欧洲国家的免疫功能低下和免疫功能正常的患者中,米尔伊丽莎白菌可导致细菌性贫血和败血症[3]。在中国,米尔伊丽莎白菌主要被发现感染两栖类动物中的蛙类,不仅侵染肝脏、肾脏等器官,还入侵脑部组织,从而引起中枢神经系统功能失调[4-6],表现出歪头等症状,俗称“歪头病”。研究人员已从米尔伊丽莎白菌中检测到编码β类碳青霉烯酶的blaGOB-13和blaB-9等耐药性基因,还检测到DNA促旋酶GyrA亚基的Ser83Ile/Asp87Asn/Thr83Ser、GyrB 亚基的Met437Leu 和拓扑异构酶IVParE 亚基的Met437Phe/Ala473Leu 的氨基酸突变点[7],说明该菌具有多重耐药性。药敏试验结果表明,米尔伊丽莎白菌仅对米诺环素、氟苯尼考、利福平和万古霉素敏感[8],进一步证实了该菌的多重耐药性。由米尔伊丽莎白菌引起的蛙类疾病具有发病急、防治难和死亡率极高等特点,对我国蛙类养殖造成了巨大的经济损失,成为制约规模化养殖发展的瓶颈,迫切需要一种高效、安全的防治手段。
微生态制剂是利用有益微生物经特殊加工而成的制剂,对生物和环境安全,可用于预防畜禽疾病、提高饲料转化率、改善产品品质及养殖环境等方面,尤其对提高动物免疫力具有诸多优势,在畜禽及水产养殖业上广泛应用[9-11]。黑斑蛙作为一种新兴产业,人们对其研究主要集中在病原菌的分离鉴定和防治药物的筛选上,市场上缺乏黑斑蛙专用微生态制剂。关于黑斑蛙益生菌的筛选,仅见王莹等[12]报道一株抗生链霉菌(Streptomyces antibioticus)对米尔伊丽莎白菌有颉颃作用。
前期,从黑斑蛙养殖场污泥中分离到一株对米尔伊丽莎白菌有强抑菌活性的细菌,编号为ZL397,本研究对其进行了分类鉴定、抑菌活性、抗菌谱及黑斑蛙攻毒保护试验研究。以期获取更多有应用前景的益生菌资源,保障黑斑蛙的绿色健康养殖。
1 材料与方法
1.1 供试材料
供试菌株ZL397、米尔伊丽莎白菌及检测菌均由浙江省农科院植物保护与微生物研究所保存。
细菌基因组DNA 提取试剂盒、PCR 试剂盒、16S扩增通用引物27F/1492R 均由生工生物工程(上海)股份有限公司生产或合成。
ZL397种子培养基:黄豆饼粉4.0 g,葡萄糖0.5 g,蔗糖0.5 g,蒸馏水1 000 mL,pH 7.5;
ZL397 发酵培养基:黄豆饼粉15.0 g,可溶性淀粉15.0 g,酵母粉5.0 g,MgSO41.0 g,CaCO30.2 g,蒸馏水1 000 mL,pH 7.5;
LB 培养基:胰蛋白胨10.0 g,酵母提取物5.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 7.5。
1.2 ZL397分类鉴定
1.2.1 形态学观察和生理生化特征分析
将菌株ZL397 用番红复红染液进行染色,在显微镜下观察其形态。用细菌微量生化鉴定管对菌株进行生理生化特性鉴定。观察结果参照《常见细菌系统鉴定手册》[13]进行鉴别。
1.2.2 16S rDNA序列分析
首先采用细菌基因组DNA 提取试剂盒提取菌株ZL397 的总 DNA,然后用16S 通用引物扩增。PCR 扩增程序:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,共30 个循环;72 ℃再延伸10 min。扩增产物用1%琼脂糖凝胶电泳检测,委托生工生物工程(上海)股份有限公司进行测序。在Genbank 基因数据库中对测序结果进行BLAST 比对,采用邻接法构建系统发育树。
1.3 ZL397发酵上清液和粉剂的制备
用接种环挑取新鲜的ZL397 斜面于种子培养基中,37 ℃下180 r/min 振荡培养15 h,作为种子液按5%的接种量接入发酵培养基中,37 ℃下200 r/min 振荡培养36 h,即得发酵液。取100 mL 经8 000 r/min离心15 min,得到的上清液用0.22 μm 微孔过滤器过滤,即得无菌发酵上清液,4 ℃密封保存。剩余发酵液离心后收集菌体进行喷雾干燥,进风温度160 ℃、出风温度80 ℃,制备得含孢量为1010CFU/g 的粉剂,常温避光保存。
1.4 抑菌活性测定
1.4.1 对米尔伊丽莎白菌的抑菌活性
取12 瓶装有50 mL LB 培养液的三角烧瓶,等量接入米尔伊丽莎白菌。分成4 组,每组3 瓶,其中3 组分别加入ZL397 发酵上清液原液、2 倍稀释液、4 倍稀释液1 mL,得到发酵上清液终浓度为50 倍、100 倍、200 倍的3 个试验组,对照组加入无菌水1 mL。30 ℃下200 r/min 振荡培养,8 h 后取培养液测定其OD600,按公式计算抑菌率。
抑菌率(%)=(对照组OD600-试验组OD600)/对照组OD600×100
1.4.2 抗菌谱测定
将20 mL LB 培养基融化并冷却至45 ℃,分别加入12 种检测菌液(108CFU/mL)200 μL,轻轻振荡混匀,迅速倒平板。待凝固后,将无菌滤纸片(直径为7 mm)均匀放置在平板上,吸取20 μL ZL397 发酵上清液50 倍稀释液于纸片中,37 ℃培养24 h,测量抑菌圈直径。每种菌液各3个重复,取平均值。
1.4.3 对米尔伊丽莎白菌形态结构的影响
处理组为在装有50 mL LB 培养液的三角烧瓶中接入米尔伊丽莎白菌,30 ℃下200 r/min振荡培养8 h,加入ZL397 发酵上清液2 倍稀释液1 mL;而对照组为加入无菌水1 mL。继续培养3 h,取少量菌体于电镜下观察菌体形态。
1.5 攻毒保护试验
取健康成年黑斑蛙120只,随机分成4组,即预防组、治疗组、攻毒对照组和不攻毒对照组,每组各3 个重复。预防组为在饲料中按终浓度为0.1‰添加ZL397 粉剂,其余组按照常规饲喂。7 d 后对预防组、治疗组和攻毒对照组黑斑蛙皮下注射含106CFU/mL米尔伊丽莎白菌的菌液100 μL,不攻毒对照组黑斑蛙注射同等体积的无菌生理盐水。接着对预防组和治疗组黑斑蛙饲喂含0.1‰ ZL397 粉剂的饲料,攻毒对照组和不攻毒对照组按照常规饲料饲喂。攻毒7 d后统计死亡数,计算存活率,并从各组存活的黑斑蛙中随机抽取5只称重,计算增重率。
1.6 数据处理与分析
采用SPSS 16.0 软件进行数据统计分析,并用t检验比较组间差异。P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 ZL397菌株鉴定结果
2.1.1 形态学、生理生化特征
ZL397 菌落在LB 培养基上呈现淡黄色,表面褶皱突起,边缘不规则。革兰氏染色呈阳性,短杆状,两端钝圆,单个、成对或成串出现,椭圆形中生芽孢(见图1)。好氧,能利用葡萄糖、乳糖、蔗糖、甘露醇和麦芽糖等,淀粉酶、蛋白酶、纤维素酶、接触酶和H2S 反应均呈阳性,硝酸盐还原阴性。根据上述特征,初步判断ZL397为芽孢杆菌属(Bacillussp.)。
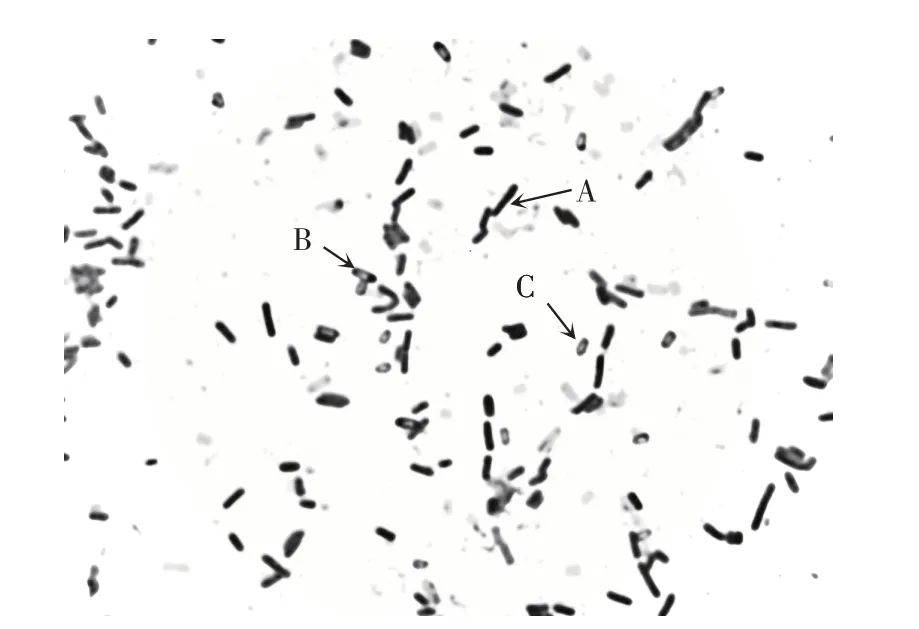
图1 菌株ZL397的杆状体(A)、孢囊体(B)、芽孢(C)形态(100×)
2.1.2 16S rDNA序列分析
对菌株ZL397 的16S rDNA 序列进行扩增、测序,将测定的序列(登录号:OQ799135)在Genbank 上比对,并与相关属种构建系统发育树如图2 所示。可以看 出ZL397 与B.tequilensisstrain HBUM07074 和B.tequilensisstrain 10b聚合在一枝,同源性达99%以上。结合形态学和生理生化特征,将芽孢杆菌ZL397 鉴定为特基拉芽孢杆菌(Bacillus tequilensis)。
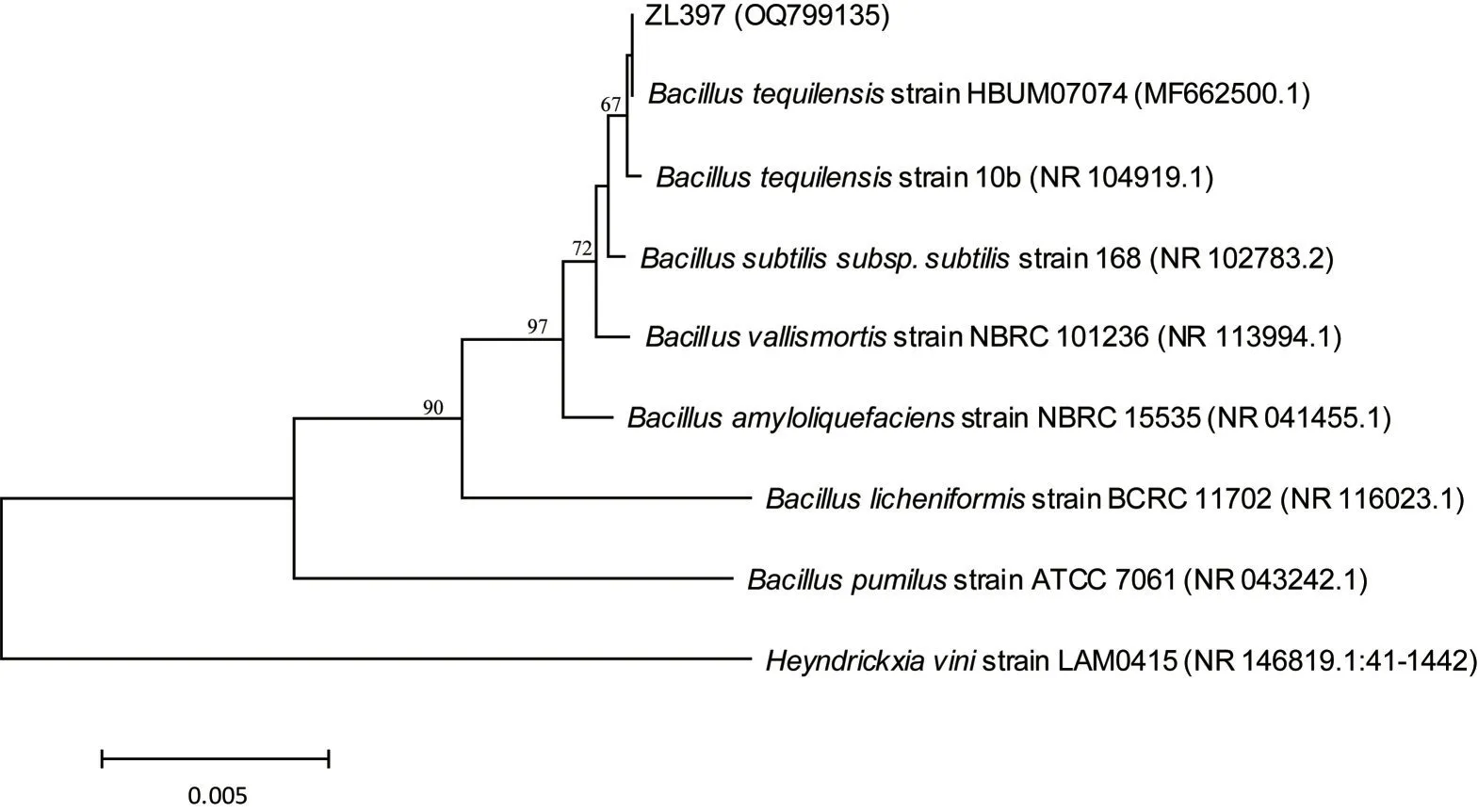
图2 菌株ZL397基于16S序列的进化树
2.2 抑菌活性测定结果
2.2.1 对米尔伊丽莎白菌的抑菌活性
从表1 可以看出,不同浓度的ZL397 发酵上清液均能抑制米尔伊丽莎白菌的生长。随着ZL397 浓度的增加,米尔伊丽莎白菌的OD600越低。抑菌活性以50 倍液最强,对靶标菌的抑制率高达90.29%,与其余2组相比差异显著(P<0.05)。

表1 ZL397发酵上清液对米尔伊丽莎白菌的抑菌活性
2.2.2 抗菌谱测定结果
菌株ZL397 对各类细菌的抑制作用见表2。ZL397对藤黄八叠球菌(Micrococcus luteus)、鸡沙门氏菌(Salmonella gullinarum)、金黄色葡萄球菌(Staphyloccocus aureus)、米尔伊丽莎白菌(E.miricola)、乙酸钙不动杆菌(Acinetobacter caleoaceticus)的抑制作用最强,对普通变形杆菌(Proteus vulgaris)、寡养单胞菌(Stenotrophomonassp.)、鲍曼不动杆菌(Acinetobacter baumannii)、嗜水气单胞菌(Aeromonas hydrophila)和Chryseobacterium arthrosphaerae的作用次之,对致病性大肠杆菌(Escherichia coli)和铜绿假单胞杆菌(Pseudomonas aeruginosa)的作用最弱。米尔伊丽莎白菌、乙酸钙不动杆菌、寡养单胞菌、嗜水气单胞菌和C.arthrosphaerae均为从患病黑斑蛙分离出来的细菌,具有一定的致病性。说明菌株ZL397 对黑斑蛙多种病原细菌具有抑菌活性。
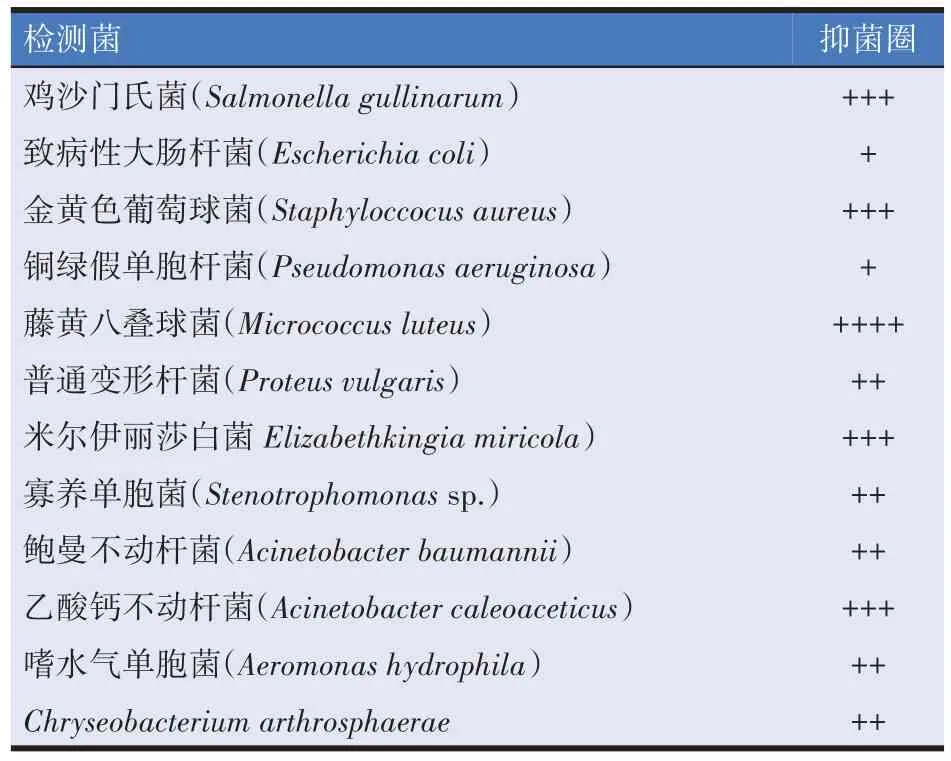
表2 菌株ZL397的抗菌谱
2.2.3 ZL397对米尔伊丽莎白菌形态结构的影响
图3(A)为对照组米尔伊丽莎白菌在扫描电镜下的观察结果,表现为完整、健壮的杆状体,长约2 μm。经ZL397 发酵上清液处理3 h 后,米尔伊丽莎白菌细胞破裂、部分菌体断裂,见图3(B),证实了ZL397对米尔伊丽莎白菌的抑菌活性。

图3 扫描电镜观察ZL397对米尔伊丽莎白菌形态结构的影响(×8 000)
2.3 攻毒保护试验结果
ZL397粉剂对米尔伊丽莎白菌的防治效果见表3。从表3 可以看出,米尔伊丽莎白菌人工攻毒7 d 后,预防组中黑斑蛙的存活率高达92.22%;治疗组黑斑蛙存活率为61.11%,防治效果不佳;攻毒对照组存活率仅为41.11%,差异显著(P<0.05)。说明对由米尔伊丽莎白菌引起的黑斑蛙病害采用ZL397 预防效果更佳。预防组黑斑蛙存活率虽低于不攻毒对照组,但两组黑斑蛙的体重增长率差异不显著(P>0.05),进一步证实了ZL397 对米尔伊丽莎白菌病的防治效果。攻毒7 d后预防组和治疗组黑斑蛙体重增重率分别为35.15%和11.42%,与攻毒对照组相比差异显著(P<0.05),说明菌株ZL397对黑斑蛙具有促生长功效。
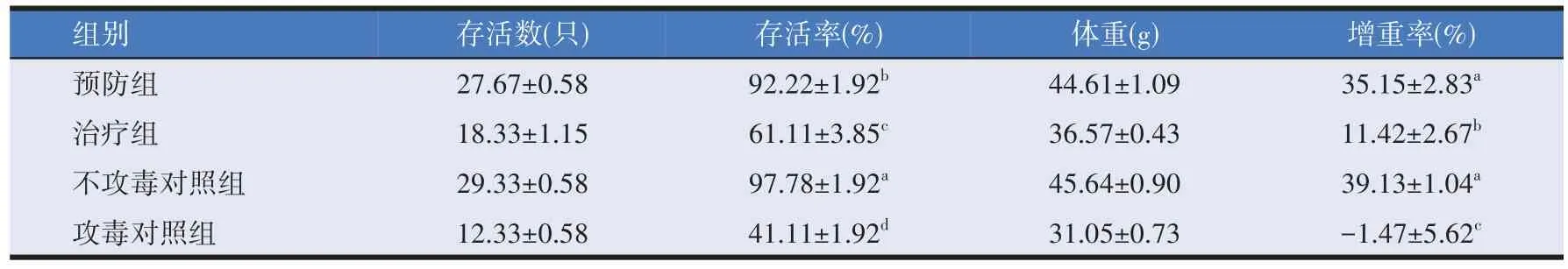
表3 ZL397粉剂对米尔伊丽莎白菌病的防治效果
3 讨论
2006 年,特基拉芽孢杆菌首次从墨西哥一座有2000年历史的墓穴中被分离出来[14]。随后,研究人员陆续发现该菌株能够产生脂肽类物质抑制病原菌生长,促进植物种子萌发和幼苗生长,具有优良的植病生防潜力[15-16]。研究表明,特基拉芽孢杆菌可产蛋白酶、脂肪酶和淀粉酶,提高血清溶菌酶、脂肪酶和肝脏谷丙转氨酶的活性,可抑制动物多种病原菌,具有抗病、促消化、提高免疫力和饲料转化率等功能,是一类有潜力的饲用微生态制剂[17-20]。
根据形态学特征、生理生化特性和16S rDNA 序列分析结果,将一株对黑斑蛙源米尔伊丽莎白菌有强抑菌活性的菌株ZL397 鉴定为特基拉芽孢杆菌。抑菌活性测定结果表明,该菌株发酵上清液50 倍液对米尔伊丽莎白菌的生长抑制率为90.29%,说明菌株ZL397 在发酵过程中产生了一种或几种具有抑菌活性的代谢产物。从超微结构看,该类活性物质的抑菌机制主要是破坏靶标菌细胞壁和膜,致使菌体断裂,胞内物质外泄,细菌生长受到抑制或死亡。至于该类活性物质的化学结构和特性有待进一步解析。菌株ZL397 抗菌谱较广,尤其对蛙类多种病原细菌米尔伊丽莎白菌、乙酸钙不动杆菌、寡养单胞菌、嗜水气单胞菌和黑斑蛙病原菌C.arthrosphaerae具有较好的抑菌活性,和他人研究结果一致[4,21-23]。下一步可通过菌种诱变和发酵工艺的研究提高其活性物质的产量,进一步提高其抑菌活性。
米尔伊丽莎白菌在侵染黑斑蛙时,除了侵染肝脏、肾脏等内脏器官,还突破了血脑屏障侵入了脑部组织。目前用抗生素治疗效果并不理想,究其原因主要有三方面:一是很多抗生素不能通过血脑屏障或通过不多,在脑脊液和脑组织中不能达到有效的治疗浓度;二是米尔伊丽莎白菌具有多重耐药性,导致很多抗生素对其无效;三是患病黑斑蛙往往食欲降低甚至断食,通过饲料中添加抗生素这条途径很难起效。本研究在黑斑蛙攻毒保护试验中分别设置了预防组、治疗组、攻毒对照组和对照组,采用米尔伊丽莎白菌人工攻毒后,预防组中黑斑蛙的存活率高达92.22%,治疗组为61.11%,攻毒对照组仅为41.11%。说明在健康黑斑蛙饲料中添加0.1‰ ZL397粉剂(100亿CFU/g)饲喂7 d,可有效抵抗由米尔伊丽莎白菌引起的病害,有助于解决目前黑斑蛙规模化养殖中的病害防治难题。攻毒对照组黑斑蛙体重与攻毒前比体重略有减轻,可能是由于病原菌的感染导致其食欲降低引起,而预防组黑斑蛙的体重较治疗组有显著增加,说明用ZL397粉剂预防可提高黑斑蛙的产量。
4 结论
特基拉芽孢杆菌对黑斑蛙多种病原细菌具有较好的抑菌活性,尤其对由米尔伊丽莎白菌引起的病害有较好的防治效果,并有显著的增重效果,展现出饲用微生态制剂的开发前景。

