介孔碳包覆纳米氧化铁及其负极储锂特性
——推荐一个综合化学实验
梅鹏,马占营
中南民族大学化学与材料科学学院,武汉 430074
清洁、高效、可持续利用的锂离子电池(LIBs)被视作应对当前能源紧缺与环境恶化双重挑战的理想新能源技术。在碳中和愿景的驱动下,由锂过渡金属氧化物/磷酸盐正极和石墨负极组成的LIBs成为许多新兴应用(如电动汽车等)的首选,人们对LIBs的性能要求(尤其是能量密度)亦与日俱增。理论上电池的能量密度(也称比能量)主要取决于电极的比容量和工作电位。目前主流的磷酸铁锂等正极和石墨负极理论比容量较低,且实际容量发挥已趋近极限,因此基于以上材料构建的LIBs比能量非常有限。此外,石墨负极的嵌锂电位接近锂析出电位,使用不当可能产生锂枝晶造成电池短路,存在安全隐患。因此,开发兼具高比容量和适度低工作电位的负极材料,对高性能LIBs的研发至关重要[1]。同时,为主动应对新一轮科技革命和产业变革,教育部力推“新工科”建设,引导高校理工科专业综合改革,布局未来战略必争领域人才培养[2]。作为理工科的代表选手——化学,实验是其专业教学过程的必要环节之一,既是培养学生动手和创新能力的重要抓手,也是践行实践育人理念、促进学生全面发展的重要载体[3]。然而,基础化学实验课程内容设计相对独立,无法培养学生的综合实验技能;传统的化学专业实验大多以验证性操作为主,难以有效提升学生的实践创新能力[4]。综合化学实验是在前期专业实验的基础上跨越多个二级学科设立的创新型实验课程,是基础实验到科学研究的过渡与衔接。综合化学实验的开设,成功为高年级本科生搭建起各基础化学专业理论及实验知识间的桥梁。为适应新形势下国家战略发展与需求,综合化学实验的教学内容要拓展广度和深度,课题设计要以化学相关专业的培养目标和社会需求为导向,更加紧密衔接战略性新兴产业和相关前沿科学,培养“新工科”背景下的创新型和复合型科技人才[5]。
鉴于此,笔者结合自身以往的教学与科研经历,将“介孔碳包覆纳米氧化铁及其负极储锂特性”转化为综合化学实验,构建应用研究型的实验课题,选择应用广泛、重现性好的水热反应合成前驱体纳米氧化铁,通过简单可控的软模板法在其表面包覆聚多巴胺,经分步碳化处理制得目标产物即介孔碳包覆纳米氧化铁材料;采用X射线衍射仪、扫描及透射电子显微镜等先进仪器分析手段表征其物相组成及微观结构等信息并利用电池测试系统研究其负极储锂性能。通过16个学时的综合化学实验,帮助学生巩固基础化学知识及实验操作,锻炼学生运用专业所学解决实际问题的能力,建立应用基础研究的科学思维,激发学生从事科学研究的热情。首先在课程导入阶段,除教师讲授外,指导学生利用学校图书馆数据库和网络资源,自主学习LIBs的学术前沿和氧化铁负极材料的研究进展并进行成果汇报,培养学生文献检索和综述的能力。然后组织学生学习材料的合成方法、仪器的操作及基本原理,指导学生进行材料制备、表征、测试及数据处理。整个实验项目涵盖了前期文献调研、实验方案设计、具体实验开展、数据处理与分析、论文撰写等环节,对学生的科研能力进行了较为全面系统的训练,为学生后期的毕业论文工作及研究生学习打下基础。
1 实验目的
通过本实验的训练,使学生熟悉并初步掌握介孔碳包覆纳米氧化铁电极的制备及电化学性能测试,巩固所学的化学基础知识与专业技能,包括纳米材料的合成与结构表征、性能测试与数据分析,进一步探究材料的结构与性能之间的构效关系。因此,本实验对学生最终达到的能力要求如下:
(1) 培养学生收集、分析和整理文献资料的能力。
(2) 熟悉水热反应制备纳米材料的方法,了解软模板法制备介孔材料的方法和原理。
(3) 掌握纳米金属氧化物及其介孔碳复合材料的结构表征与性能测试的操作方法及基本原理。
(4) 掌握LIBs的极片制作与电池组装的工艺流程及充放电测试分析方法。
(5) 掌握实验数据的处理与分析方法,学习科学作图的技巧和科技论文撰写的规范要求。
2 实验原理
氧化铁(α-Fe2O3)材料因其理论比容量高(~1000 mAh·g−1)、工作电位适度低(< 1.0 Vvs. Li/Li+)、环境友好、生产成本低、地球储量丰富等优势,被认为是构筑高比能LIBs的理想负极候选之一。氧化铁的储锂反应机制为:6Li++ Fe2O3+ 6e−↔ 3Li2O + 2Fe。然而氧化铁本征导电性差、充放电过程体积变化显著导致结构不稳定,以及储锂反应动力学受限,因此其实际容量较低且衰减快,无法满足实际应用的需求[6]。材料尺寸纳米化可以减小Li+传输距离,增强电化学反应动力学,是改善氧化铁储锂特性的有效方法之一[7]。此外,由于碳材料价格便宜、来源广、理化性质稳定,可明显提高材料的导电性,防止纳米颗粒团聚,因此常用于金属氧化物的复合改性[8]。在此基础上引入介孔结构,借助高比表面积和丰富孔隙可进一步提升复合材料的综合电化学性能[9]。
鉴于此,本实验设计合成纳米氧化铁/介孔碳复合材料(Fe2O3@MC)用于LIBs负极,不仅使“笨拙的大块头”氧化铁体相材料“瘦身”为灵活小巧的氧化铁纳米粒子,还为原本刚性而脆弱的氧化铁装备上透气且坚韧的介孔碳“防护衣”。预期在赋予电极高暴露活性表面和高导通电子/离子传输路径的同时,有效缓解电极反应过程材料体积变化产生的机械应力,维持电极整体结构的稳定性和牢固的电接触,协同强化其实际储锂容量和循环寿命。
3 实验试剂
无水氯化铁、磷酸二氢钠、氨水、无水乙醇、N-甲基吡咯烷酮、聚偏氟乙烯(以上均为分析纯,国药),盐酸多巴胺(98%,阿拉丁),聚氧乙烯-聚氧丙烯嵌段共聚物(F127,分子量~12600 g·mol−1,Sigma-Aldrich),铜箔、锂片、乙炔黑(电池级,科路得),隔膜(Celgard-2400),六氟磷酸锂电解液(南京莫杰斯能源科技)。
4 实验仪器
磁力搅拌器、水热反应釜、鼓风干燥箱、高速离心机、数控超声波清洗器、真空干燥箱、管式炉、涂覆烘干机(MSK-AFA-III,深圳科晶)、电动对辊机(MSK-HRP-01,合肥科晶)、扣式电池切片机(MSK-T10,深圳科晶)、扣式电池封口机(MSK-E110,深圳科晶)、手套箱(Super (1220/750),米开罗那(中国))、电池测试系统(CT2001A,武汉市蓝电电子)、X射线衍射仪(XRD,MiniFlex600C,日本Rigaku)、拉曼光谱仪(DXR2 XI,美国Thermo Fisher)、扫描电子显微镜(SEM,SU 8010,日本Hitachi)、透射电子显微镜(TEM,Tecnai G2 F20 S-TWIN,美国FEI)、多功能气体吸附仪(ASAP 2020 PLUS HD88,美国Micromeritics)。
5 实验安排
为保质保量地开展综合实验教学活动,本课程建议采用小班授课模式,将学生分成若干小组轮换教学,每组人数控制在3–4人左右,共计16课时,具体教学计划安排如表1所示。

表1 详细实验教学安排
6 实验步骤
6.1 介孔碳包覆纳米氧化铁(Fe2O3@MC)的制备
实验合成流程如图1所示。称取0.1622 g FeCl3和0.01 g NaH2PO4溶于50 mL去离子水,磁力搅拌5 min后转入100 mL高压反应釜内,置于150 °C烘箱保温48 h。冷却至室温后通过高速离心(转速12000 r·min−1,时间8 min),去离子水和无水乙醇洗涤数次后干燥即得前驱体Fe2O3。称取0.1 g前驱体通过超声分散于10 mL去离子水。在另一烧杯内,称取0.5 g F127溶于水/无水乙醇混合溶剂(15 mL/25 mL),并在磁力搅拌下加入0.25 g盐酸多巴胺溶解完全,然后与Fe2O3分散液混合搅拌0.5 h。加入2.5 mL氨水后反应2 h得即中间体F127-聚多巴胺包覆氧化铁(Fe2O3@FP)。在氩气流下分步碳化中间体:(1) 2 °C·min−1升至350 °C保温2 h;(2) 5 °C·min−1升至600 °C保温2 h。所得即介孔碳包覆纳米氧化铁(Fe2O3@MC)。上述凡涉及高温高压等危险性实验操作,须有专人全程监督指导。
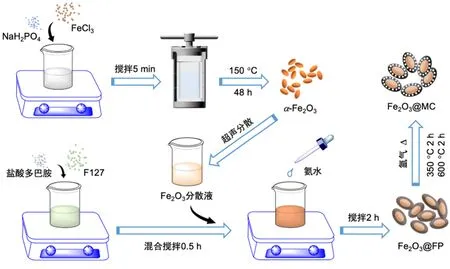
图1 Fe2O3@MC的合成示意图
6.2 工作电极的制作及扣式电池的组装
将质量比7 : 2 : 1的活性物质(Fe2O3或Fe2O3@MC)、乙炔黑和聚偏氟乙烯,以及适量N-甲基吡咯烷酮充分混合研磨至半粘稠状,均匀涂覆于铜箔后在80 °C真空干燥12 h。经辊压切片得直径10 mm的圆片,称重后转入手套箱组装半电池。对电极为锂片,电解液为1.0 mol·L−1LiPF6溶于体积比1 : 1的碳酸乙烯酯/碳酸二甲酯混合溶剂,隔膜为多孔聚丙烯。组装后电池陈化12 h后即可测试。
7 实验结果与讨论
7.1 结构分析
Fe2O3@MC及Fe2O3的XRD图谱如图2(a)所示,两者呈现类似的特征衍射峰(2θ= 24.3°、33.2°、35.9°、41.0°、49.6°、54.0°、62.6°、64.3°),均归属于六方相α-Fe2O3(空间点群R-3c(167),No. 33-0664),表明水热反应成功制得前驱体α-Fe2O3,同时与碳复合后并未改变其晶体结构。图2(b)为Fe2O3@MC的拉曼光谱,在1354 cm−1和1593 cm−1处的两个特征峰分别对应于碳材料的D带和G带信号峰,说明聚多巴胺等聚合物组分被成功碳化。
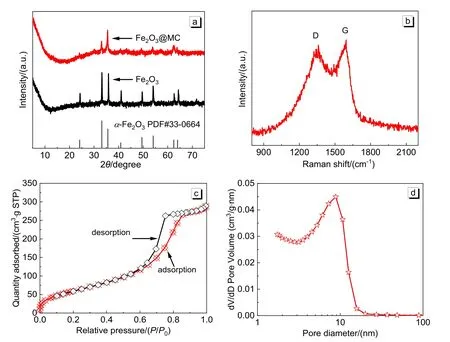
图2 Fe2O3@MC和Fe2O3的XRD图谱(a);Fe2O3@MC的拉曼光谱(b)、氮气吸脱附曲线(c)和孔径分布图(d)
Fe2O3@MC的氮气吸脱附曲线如图2(c)所示,根据IUPAC分类可归属于典型的IV(a)类曲线并具有H2(b)型滞后环,证实材料的内部存在着孔径在4 nm以上的介孔。利用Brunauer-Emmet-Teller (BET)法计算得出Fe2O3@MC的比表面积高达232.29 m2·g−1,远高于未包覆Fe2O3(21.43 m2·g−1)。进一步使用Barrett-Joyner-Halenda (BJH)法分析Fe2O3@MC的吸附支曲线数据,可知其孔径分布(图2(d))主要集中在8.83 nm左右,与文献报道的以F127为造孔模板得到的结果相近[1]。综合以上分析结果可证,本实验方案成功地制备得到了高比表面积的介孔碳/氧化铁复合材料。
7.2 形貌分析
通过SEM和TEM进一步研究材料的微观构造。图3(a)显示前驱体Fe2O3呈椭球形,粒径相对均匀(约140–160 nm)。纳米化的尺寸有利于Li+在固相材料中的快速扩散。由图3(b)可以清晰地观察到Fe2O3@MC的核壳型结构。图中深色的实心内核为Fe2O3,而浅色的外壳为碳包覆层,其厚度较为均一(约20–30 nm)且含丰富的介孔。进一步确证了在F127的辅助下聚多巴胺成功转化为介孔碳并将Fe2O3纳米粒子封装在其内部。介孔碳层既可保证电解液的充分浸润,又可提供良好的电子/离子通路以及高度暴露的电化学活性表面,同时可有效缓冲充放电时体积变化产生的机械应力。

图3 (a) Fe2O3的SEM图;(b) Fe2O3@MC的TEM图
7.3 电化学性能
为了研究介孔碳包覆纳米氧化铁的储锂特性,本实验以Fe2O3@MC (或Fe2O3)为工作电极,锂片为对电极,组装扣式半电池进行充放电测试。图4(a)和(b)分别为Fe2O3@MC和Fe2O3前三圈的充放电曲线。相比于未包覆的Fe2O3,Fe2O3@MC表现出更加显著的特征电压平台和更高的初始容量。图4(c)为Fe2O3@MC的循环性能。在100 mA·g−1下,其首圈放电比容量高达1204 mAh·g−1,库伦效率约60%,循环100圈后容量可保持在567 mAh·g−1左右。由此可见,在导电、坚韧且透气的介孔碳“护甲”的加持下,Fe2O3@MC的实际容量和循环稳定性均改善明显。

图4 Fe2O3@MC (a)和Fe2O3 (b)的充放电曲线以及Fe2O3@MC的循环性能(c)
8 教学讨论及教学效果
传统的化学实验课程大多注重实验结果而不注重实验过程,课后学生往往机械地照抄实验原理、操作步骤等形成实验报告,极大地削弱了学生的体验感和主观能动性。在综合化学实验中,学生可以通过自主实践和观察来巩固和应用理论课所学知识。本实验是融合了教师自身的科研成果和教学经历的创新型综合课题,将更加有利于学生对所学专业知识的交叉融合,把握专业前沿动向,为适应时代需求的拔尖人才培养提供有效的支持。本研究提供了多样化的实验项目(强制水解法合成纳米氧化铁、软模板法制备介孔碳等),涵盖不同的化学领域(无机、物化、分析、高分子)和实验技术(水热反应、高温碳化、极片制作、电池组装与测试等),以便学生习得更广泛的化学知识和技能。综合实验的开展以小组为单位进行,鼓励学生互相交流和讨论实验的进展、结果和数据解析,促进团队合作和科学思维。综合化学实验也是培养学生实验室安全意识和实验室技能的重要机会,学生需要学会正确地使用实验室设备、遵循实验规范、处理化学废弃物,并采取必要的安全措施来保证实验的安全性。
本实验已在我校材料化学专业高年级学生的综合化学实验课程中开展并收到学生的正向反馈。通过与学生交流、听取学生PPT汇报和批阅学生的实验论文发现,学生的综合科研素质(包括文献检索、实验操作、数据处理和论文撰写等)得到了良好的锻炼,并激发了浓厚的科研兴致。同时,许多学生表示未来毕业论文、研究生课题和择业等均会重点考虑新能源领域。
9 结语
本文设计通过简单水热反应制得纳米α-Fe2O3,继而利用软模板法以聚多巴胺为碳源合成介孔碳包覆氧化铁纳米材料,并对其进行结构表征和储锂性能测试。本实验选题紧扣时代需求和专业前沿,原材料价廉易得、原理明晰操作简便、结果重现性好,适用于学生综合科学实践教学。本实验的教学对学生的全面发展具有重要意义,不仅能够提高学生的理论水平和实践能力,激发创造力和科学探索的兴趣,还能培养学生解决实际问题的能力和创新思维,提升团队合作意识和沟通能力,为将来从事科学研究或工程实践打下坚实的基础。

