超声造影结合血清P53抗体鉴别肝细胞癌分化程度的价值探讨
陈媛媛,朱春雨
(周口市中心医院 1.超声科;2.RICU,河南 周口 466000 )
肝细胞癌是临床上最为常见的一种原发性肝癌类型,占比约为90%,其发病率与死亡率均非常高,是威胁全球人类健康与生命安全的重大恶性疾病之一[1]。肝细胞癌分化程度是影响疾病治疗方案的制定与预后情况的重要因素,及早准确评估其分化程度对指导临床早期实施合理的干预、促进预后改善具有重大意义。目前,通过外科手术或肝穿刺活检做病理组织学检查是判断肝细胞癌分化程度的金标准,但此二者均属于侵入性、有创性操作,可存在并发症,临床应用具有局限性。因此,需探寻便捷、安全且有效的检测手段。随着医学影像学技术的发展进步,超声造影已成为现阶段临床鉴别诊断肝癌的常用方法,其可实时、动态对病灶进行观察,清晰显示病灶数目、大小、位置、形态、微循环血流灌注等情况,诊断准确率较高,有研究[2]指出超声造影可提示肝细胞癌分化程度,但该检查可受气体、肥胖、位置等影响,继而影响判断的准确性。血清生物标志物检测是当前肿瘤诊断、病情评价与预后评估的另一常用方法,其中P53 抗体是指P53 蛋白刺激机体产生的免疫球蛋白,其异常表达可引起免疫系统紊乱,导致肿瘤生成[3]。有研究[4]表明,原发性肝癌患者血清P53 抗体水平显著高于健康体检者;另有研究[5]报道,血清P53 抗体表达与非小细胞肺癌患者肿瘤分化程度有关。超声造影、血清P53 抗体均有助于鉴别肝细胞癌分化程度,但各自单独应用时的准确性仍有待提升,而将此二者联合是否能够提高鉴别诊断价值尚需进一步探索证实。基于此,本研究特探讨分析超声造影结合血清P53 抗体对肝细胞癌分化程度的鉴别价值,以期为临床诊治提供参考,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2020 年3 月至2023 年3 月周口市中心医院收治的经病理学检查确诊的185 例肝细胞癌患者的临床资料。其中男112 例,女73 例;年龄41~79 岁,平均(55.92±8.63)岁;肿瘤最大直径2.1~9.6 cm,平均(6.75±1.13)cm;分化程度:高分化48 例,中分化82 例,低分化55 例。本研究经医院伦理委员会审批。
纳入标准:均经病理学检查确诊为原发性肝细胞癌,分化程度明确;入院后行超声造影检查,并进行过血清P53 抗体检测;年龄超过18 周岁;超声、血清指标等临床资料保留完整。
排除标准:行超声、血清指标检查前已有过射频消融、介入、放化疗等治疗史;使用过免疫抑制剂者;伴有其他恶性肿瘤者或远处转移者;超声造影图像质量不佳者;有肝脏囊肿等其他肝脏疾病。
1.2 方法
1.2.1 超声造影检查 采用德国西门子公司(Siemens)的ACUSON Sequoia 512 型超声诊断仪,频率5~25 MHz,凸阵探头;造影剂使用意大利博莱科公司(BRACCO)的声诺维(SonoVue)六氟化硫微泡,59 mg/支。指导患者仰卧位与平静呼吸,先行常规腹部二维超声检查,观察病灶并记录病灶部位、大小、内部回声、边界、血流信号等。再取直径最大的病灶,切换至造影模式,将SonoVue 造影剂和生理盐水混匀稀释,通过上肢肘部浅静脉团注2.4 mL 造影剂,速度1.8 mg/mL,同时启动计时器计时,经动脉相(10~30 s)、门脉相(30~120 s)、延迟相(120~360 s)实时造影观察,至少观察6 min,使用超声造影专用软件记录造影全过程。主要观察病灶内造影剂开始增强时间、达峰时间、峰值强度、增强持续时间、开始廓清时间。由2 名临床经验丰富(工作年限>3 年)的超声科医师对图像进行分析,若意见不一致,则请教上级医师,共同商讨,给出最终判断结果。
1.2.2 血清P53 抗体检测 采集患者空腹肘静脉血4 mL,以4 000 r/min(离心半径10 cm,4℃)离心15 min,取上清液,置于-80℃冰箱保存待测。采用酶联免疫吸附实验检测血清P53 抗体,试剂盒购自法国Pharma Cell 公司,严格按照说明书操作与判定结果。根据说明书,P53 抗体>1.15 kU/L 为阳性。
1.2.3 病理学检查 经外科手术切除或超声引导下肝穿刺活检取病灶组织,对其进行处理做病理检查。根据HE 染色结果,判定肝细胞癌Edmondson 分级[6],其中Ⅰ级为高分化,Ⅱ级、Ⅲ级为中分化,Ⅳ级属于低分化。
1.3 观察指标
①不同分化程度患者超声造影参数与血清P53抗体比较。②超声造影、血清P53 抗体单独及联合对肝细胞癌分化程度的鉴别价值。其中超声造影、血清P53 抗体任一项检查提示为肝细胞癌低分化即认为联合诊断为低分化,两项检查均提示为肝细胞癌中高分化方认为联合诊断为中高分化。
1.4 统计学方法
采用SPSS 26.0 软件对数据行统计学处理。符合正态分布的计量资料以均数±()表示,多样本比较采用单因素方差分析与SNK-q检验;计数资料以百分率(%)表示,采用χ2检验;对肝细胞癌分化程度的鉴别价值评估采用受试者工作特征(ROC)曲线,曲线下面积(AUC)采用秩和检验。P<0.05 为差异有统计学意义。
2 结果
2.1 不同分化程度患者超声造影与血清P53 抗体比较
高分化、中分化、低分化肝细胞癌患者超声造影开始增强时间、峰值强度比较,差异均无统计学意义(P>0.05);超声造影达峰时间、增强持续时间、开始廓清时间在高分化、中分化、低分化患者中逐渐降低,血清P53 抗体水平在高分化、中分化、低分化患者中逐渐升高,差异均有统计学意义(P<0.05)。见表1。
表1 不同分化程度患者超声造影参数、血清P53 抗体比较()

表1 不同分化程度患者超声造影参数、血清P53 抗体比较()
注:1)与高分化组比较,P<0.05;2)与中分化组比较,P<0.05。
2.2 超声造影参数鉴别肝细胞癌分化程度的价值
经ROC 曲线分析(见图1、表2),超声造影达峰时间、增强持续时间、开始廓清时间联合鉴别肝细胞癌低分化与中高分化的灵敏度高于各参数单独鉴别,差异有统计学意义(χ2=5.939、5.037、4.193,P=0.015、0.025、0.041),联合鉴别的特异度、AUC 与各参数单独鉴别比较差异无统计学意义(特异度:χ2=2.552、1.478、0.724,P=0.110、0.224、0.395;AUC:Z=1.187、1.277、0.986,P=0.235、0.202、0.324)。

图1 超声造影参数鉴别肝细胞癌低分化与中高分化的ROC 曲线

表2 超声造影参数对肝细胞癌低分化的鉴别价值
2.3 超声造影联合血清P53 抗体对肝细胞癌分化程度的鉴别价值
经ROC 曲线分析(见图2、表3),超声造影联合血清P53 抗体鉴别肝细胞癌低分化与中高分化的灵敏度、AUC 均高于各项单独鉴别,差异有统计学意义(灵敏度:χ2=3.960、4.949,P=0.047、0.026;AUC:Z=2.417、2.132,P=0.016、0.033),联合特异度与各项单独鉴别差异无统计学意义(χ2=0.026、0.106,P=0.872、0.745)。

图2 超声造影、血清P53 抗体鉴别肝细胞癌低分化与中高分化的ROC 曲线
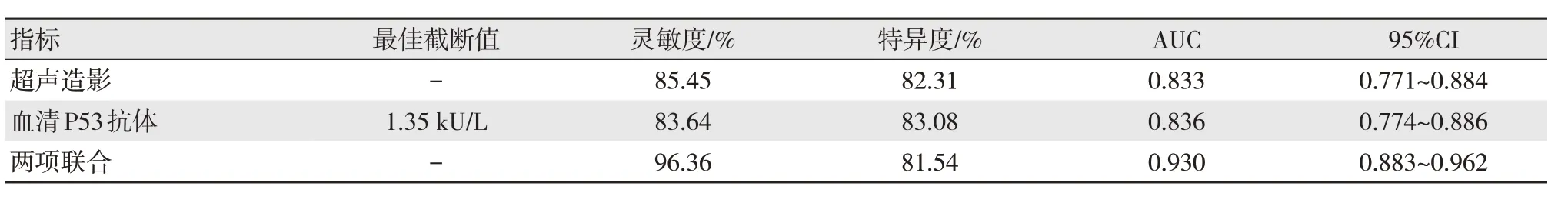
表3 超声造影、血清P53 抗体单项及联合对肝细胞癌低分化的鉴别价值
3 讨论
肝细胞癌是全球范围内常见的消化系统恶性肿瘤,早诊断、早治疗是挽救患者生命的重要举措。但不同分化程度的肝细胞癌患者的治疗方式有所不同,预后也存在差异。及早判断肿瘤分化程度以为患者制定针对性治疗方案提供参考依据很有必要。病理学检查虽是判断肿瘤分化程度的主要手段,但对患者有一定的损害。影像学检查、血清学标志物检测是临床判断肝细胞癌分化程度的常用无创性手段。近年来,超声造影已广泛应用于肝细胞癌的鉴别诊断中,且应用价值较好,安全可靠[7]。另血清P53 抗体亦在多种肿瘤的诊断中显示出一定的敏感性[8-9]。本研究特对超声造影联合血清P53 抗体在肝细胞癌分化程度的鉴别价值展开探索分析。
本研究显示,超声造影达峰时间、增强持续时间、开始廓清时间在高、中、低分化肝细胞癌患者中逐渐降低,且ROC 曲线分析表明此三项参数各自单独及联合鉴别肝细胞癌低分化与中高分化的灵敏度分别为65.45%、67.27%、69.09%、85.45%,特异度分别为 89.23%、87.69%、86.15%、82.31%,AUC 分别0.771、0.772、0.781、0.833,表明超声造影参数与肝细胞癌分化程度有关,对肝细胞癌分化程度具有较好的鉴别诊断作用。SonoVue 造影剂中含有大量的六氟化硫气体,属于真正的血池显像剂,可明确显示病灶血供情况。超声造影通过注入SonoVue 造影剂可实时、动态、连续不间断地观察病灶区域血流灌注信息,跟踪血流微循环情况,有助于临床医师通过分析病灶血供情况而了解肿瘤分化情况[10]。肝细胞癌分化程度不同,其血供则不同,分化程度越低,肿瘤组织内血供越丰富,血管结构紊乱越严重。若肝细胞癌低分化,则病灶组织血管结构较为紊乱,新生血管数量多,血管管径较粗,血循环加快,进而在同一单位体积与时间的条件下,造影剂进入的速度较中高分化更快,进入量增多,容易达到峰值强度,则达峰时间缩短;另分化程度低,异常新生血管形成、供血增多,动静脉瘘丰富,正常肝动脉与门静脉供血降低,则增强持续时间缩短,开始廓清时间变短。而分化程度高的肝细胞癌患者,有一些正常肝窦组织、肝血窦残留,也有一定的门静脉供血,可导致造影剂滞留。有研究[11]表明,高、中、低分化肝细胞癌始超声造影增时间无差异,但高分化达峰时间长于中、低分化,中分化达峰时间长于低分化,本研究结果与此相一致。潘旭等[12]研究报道,高分化肝细胞癌超声造影开始廓清时间较中、低分化长,中分化较低分化长,本研究结果与此相符合。因此,超声造影可为临床早期鉴别肝细胞癌分化程度提供较为可靠的参考信息,但其诊断结果可受到体位、扫描角度等的影响,鉴别的灵敏性、准确性仍存在一定不足。
本研究显示,血清P53 抗体水平在高、中、低分化肝细胞癌患者中逐渐升高,ROC 曲线分析显示其鉴别肝细胞癌低分化与中高分化的灵敏度、特异度、AUC 分别为83.64%、83.08%、0.836,表明血清P53 抗体水平表达变化与肝细胞癌分化程度有一定关系,对其分化程度具有较好的鉴别价值。正常状态下,P53 基因属于抑癌基因,与细胞分化、增殖、凋亡等关系密切,能够预防癌变。但是,当P53 基因突变、失活后,其抑癌功能丧失,且能促进细胞转化,加快癌细胞增殖,具有致癌作用。突变型P53 蛋白可聚积在细胞核,随着细胞自溶死亡裂解而被释放至细胞外,进入体液循环,促使机体对其发生自身体液免疫应答,进而产生P53 抗体[13]。因此,P53 抗体的生成与P53 基因突变存在明显的关联,通过检测P53 抗体水平可了解P53 基因突变情况。血清P53 抗体水平与肿瘤生物学行为具有一定的关系,肿瘤分化程度越低,恶性越大,其水平升高越明显。有研究[14]表明,血清P53 抗体有助于确定口腔潜在恶性疾病的恶性转化风险潜力,与癌变有关。另有研究[15]指出,食管癌患者血清P53 抗体滴度明显高于健康人群,且不同组织分化程度患者的血清P53 抗体滴度不同,以低分化者最高,表明血清P53 抗体表达与肿瘤发生发展相关。因此,血清P53 抗体水平能够反映肝细胞癌分化程度,可为临床鉴别肝细胞癌分化情况提供辅助参考依据。
此外,本研究显示,超声造影联合血清P53抗体鉴别肝细胞癌低分化与中高分化的灵敏度、特异度、AUC 分别为96.36%、81.54%、0.930,灵敏度与AUC 均高于各项单独鉴别,而特异度未明显削弱,表明超声造影与血清P53 抗体联合用于肝细胞癌分化程度的鉴别诊断中可获得更佳的应用价值。超声造影、血清P53 抗体分别从影像学角度、生物学角度对肝细胞癌患者分化情况进行反映,综合此两方面分析,可减少干扰与误差,优势互补,从而可提升鉴别价值,为临床鉴别诊断提供更为有力的证据。
综上所述,超声造影、血清P53 抗体水平均对肝细胞癌分化程度具有一定的鉴别诊断作用,两者联合可进一步提升鉴别效能,为肝细胞癌早期个体化治疗及预后评判提供可靠的依据。

