益脉降脂汤含药血清对THP⁃1 源性泡沫细胞模型miRNA 差异表达分析
赖春冰,古展鑫,刘 锐
(1.广西中医药大学研究生院,广西 南宁 530000;2.广西中医药大学附属瑞康医院,广西 南宁 530000)
动脉粥样硬化(atherosclerosis,AS)是大中型动脉壁上形成的纤维脂肪性病变,是引起冠状动脉疾病、心肌梗塞、外周血管疾病、脑卒中等疾病的重要危险因素[1]。机体因受到多种因素影响损伤血管内皮,在内皮表达的黏附因子使单核细胞通过趋化作用进入内膜后,产生氧化低密度脂蛋白,巨噬细胞则被募集到损伤部位吞噬氧化低密度脂蛋白颗粒,并转化为泡沫细胞,死亡的泡沫细胞释放的内容物逐步形成脂质蓄积导致区域性病变,并进展为斑块、钙片[2]。由此可见,巨噬细胞泡沫化是动脉粥样硬化发生发展的关键。miRNA 是一种内源性非编码RNA,研究发现miRNA 过表达可延缓动脉粥样硬化发生发展的进程,同时miRNA 也可以作为动脉粥样硬化的生物标志物[3,4]。
动脉粥样硬化并无中医病名,根据其临床表现,可归属到“胸痹”、“脉痹”、“真心痛”、“痰浊”、“膏脂”等范畴[5]。结合现代生物学角度,动脉粥样硬化首要病理因素为“痰湿”,脾主水谷精微运化,若脾运化功能失调,则出现水湿内停化生为痰,痰阻则气滞,气滞血瘀,痰瘀交结,脉道阻塞[6],治宜健脾化痰、活血化瘀、滋养肝肾[7]。益脉降脂汤是广西中医药大学附属瑞康医院老年病科协定方,全方具有健脾化痰、祛湿泄浊、活血通脉化瘀之功效。临床实验表明,益脉降脂汤能有效降低高脂血患者血清总胆固醇和血清低密度脂蛋白胆固醇的含量[8]。
本研究以人单核细胞白血病细胞(human my‑eloid leukemia mononuclear cells,THP‑1)建立泡沫细胞模型,旨在探讨益脉降脂汤含药血清干预THP‑1 源性泡沫细胞miRNA 表达的影响,对关键miRNA 靶基因进行生物信息学分析及初步验证。
1 材料与方法
1.1 一般材料
1.1.1 实验动物 30 只SD 大鼠,SPF 级,雌性,体重180~200 g,购买于湖南斯莱克景达实验动物有限公司[SCXK(湘)2018‑0002]。饲养在广西中医药大学科学实验中心SPF 级动物饲养中心,饲养温度20~25 ℃,相对湿度50%~65%,自然昼夜光照节律,大鼠自由摄食、饮水。
1.1.2 实验细胞 人单核细胞白血病细胞系THP‑1,来源于ATCC 细胞库,购买于广西卓一生物技术有限公司。
1.1.3 实验药物 实验药物为益脉降脂汤,组成如下:黄精20 g、茯苓10 g、山楂20 g、白术10 g、丹参10 g、泽泻10 g、绞股蓝10 g、何首乌10 g、黄芪10 g、杞子10 g、菊花10 g、草决明10 g 组成,广西中医药大学附属瑞康医院提供。
1.1.4 益脉降脂汤制备 益脉降脂汤制备以及灌胃浓度参考文献[9]进行。将益脉降脂汤加入超纯水浸泡30 min,加入超纯水煎煮两次,过滤后混合两次煎煮的药液,于旋蒸仪中浓缩至含生药2.84 g/mL,置于4 ℃冰箱保存。
1.1.5 主要实验试剂与仪器 RPMI 1640 培养基(Gibco 公司)、澳洲进口胎牛血清(Gibco 公司)、氧化型低密度脂蛋白(OX‑LDL)(北京Solarbio 公司)、RNA 分析试剂盒(美国AATI 公司)、Tatal RNA 提取试剂盒(上海Progmega 公司)、生物安全柜(青岛海尔)、实时荧光定量PCR 仪(ABI,Quant‑Studio 6)、细胞培养箱(日本Sanyo 电机)、BGISEQ‑500 测序平台(深圳华大基因)、RT‑qPCR试剂盒(VAZYME)。
1.2 方法
1.2.1 制备益脉降脂汤含药血清 30 只SD 大鼠按随机数字表法分为空白组、益脉降脂汤组,每组15只。益脉降脂汤大鼠每日予益脉降脂汤灌胃1 次,连续7 d。末次给药1 h 后对各组大鼠麻醉,经腹主动脉采血提取空白大鼠血清、益脉降脂含药血清。将全血室温静置3 h,3 000 rpm 离心10 min,血清灭活,过滤除菌后冻存于−80 ℃冰箱。
1.2.2 泡沫细胞模型建立与鉴定 泡沫细胞模型的建立参考文献[9]进行。THP‑1 细胞加入完全培养基与320 mmol/L 佛波酯在恒温细胞培养箱孵育,24 h 后鉴定THP‑1 细胞可以分化为具备吞噬能力的巨噬细胞。加入ox‑LDL 浓度为80 mg/L 的完全培养基孵育48 h,建立泡沫细胞模型。PBS 洗涤,加入4%多聚甲醛固定,60%异丙醇分化,加入油红O 染色液避光着色。弃染色液,加入异丙醇分化,洗涤后取出细胞爬片后加入甘油明胶,镜下观察泡沫细胞模型是否成功建立。
1.2.3 实验分组及处理 实验分为巨噬细胞组、泡沫细胞模型组、益脉降脂含药血清组。巨噬细胞组、泡沫细胞模型组加入含有10%空白大鼠血清的完全培养基,泡沫细胞加入含10%益脉降脂汤大鼠血清的完全培养基即益脉降脂含药血清组,各组细胞在37 ℃、5%CO2恒温培养箱中干预48 h。
1.2.4 提取Total RNA 将各组细胞以1×106/mL浓度接种于6 孔板中,各组细胞干预结束后,加入RNA 裂解液,转移至EP 管,加入稀释液后离心,取上清,加入无水乙醇混匀离心。收集离心柱加入RNA 洗液,再次离心后弃滤液收集离心柱,加入DNA 酶I 孵育液,静置后加入RNA 洗液,离心后冲洗。转移离心柱至洗脱管,加入无核酶水,静置离心,所提取的液体即为Total RNA。
1.2.5 miRNA 测序 采用Standard Sensitivity RNA Analysis Kit(DNF‑471)检测试剂盒对各组Total RNA 的完整度及浓度进行检测,采用Agilent Bioanalzyer 2100 生物分析仪进行构建文库,通过华大基因公司BGISEQ‑500 测序平台进行small RNA测序,测序结果过滤并采用AASRA 比对软件进行比对。
1.2.6 miRNA 的生物信息学分析 将各组差异表达的miRNA 通过RNAhybrid、miRanda 和Tar‑getScan 等软件预测靶基因,将预测的靶基因进行聚类分析、GO 分析、KEGG 分析,构建靶基因PPI 蛋白网络互作图、miRNA‑靶基因调控网络。
1.2.7 RT‑qPCR 验证改善动脉粥样硬化可能信号通路 各组细胞加入Trizol 裂解,加入氯仿静置离心,取上清加入异丙醇后离心,弃上清加入无水乙醇离心,将细胞沉淀溶于DEPC 水,微量分光光度计测定RNA 的纯度和浓度。根据试剂盒要求加入试剂进行逆转录以及qPCR 检测,内参为β‑actin,目标基因引物委托擎科生物科技有限公司设计合成。见表1。
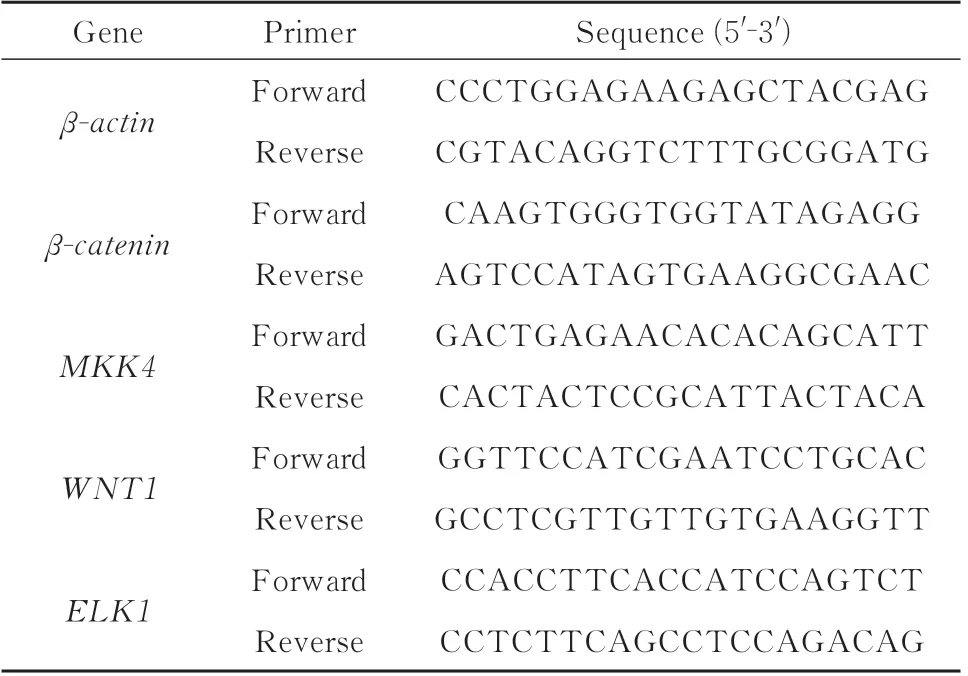
表1 实时荧光定量 PCR 基因引物序列Tab 1 Primer sequences for real⁃time fluorescence quanti⁃tative PCR
1.2.8 数据统计及分析 实时荧光定量PCR 实验结果采用2‑△△t 的分析法进行定量分析。GraphPad Prism 9.0(GraphPad 软件,美国)用于统计分析和图形生成,P<0.05 为差异具有统计学意义。
2 结果
2.1 泡沫细胞模型建立
经佛波酯诱导24 h 后的THP‑1 细胞呈贴壁状态,细胞形态呈梭形、类圆形以及不规则形状,可见伪足延伸。在佛波酯诱导分化THP‑1 源性巨噬细胞加入终浓度为 80 mg/L ox‑LDL 孵育,在油红O染色后,细胞呈现红色、橘红色脂滴。而未经ox‑LDL 干预的细胞少见或未见红色、橘红色脂滴,证实泡沫细胞模型的成功建立,见图1。
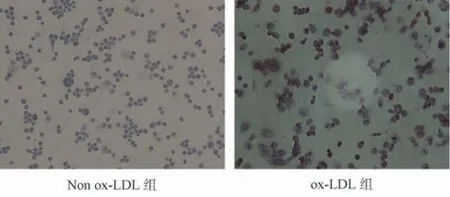
图1 Non ox‑LDL 组与ox‑LDL 组细胞经油红O 染色脂质蓄积情况(20×)Fig 1 lipid accumulation of non⁃ox⁃LDL group and ox⁃LDL group after oil red O staining(20×)
2.2 筛选差异表达miRNA 及聚类分析
miRNA 测序结果提示,空白组与模型组对比,两组差异表达miRNA 共有95 个,28 条miRNA 上调,67 条miRNA 下调。经过益脉降脂含药血清干预之后,益脉降脂含药血清组与模型组差异表达miRNA 共有55 个,39 条miRNA 上调,16 条miRNA下调。为排除假阳性差异,进一步缩小筛选范围,将筛选条件上调为log2≥2,Qvalue<0.01,其中任意一组或两组表达量>1,空白组与模型组共筛选出8 个差异表达显著miRNA:hsa‑miR‑302c‑3p、hsa‑miR‑302d‑3p、hsa‑miR‑30d‑3p、hsa‑miR‑3189‑3p、hsa‑miR‑374b‑5p、hsa‑miR‑423‑5p、hsa‑miR‑4781‑3p、hsa‑miR‑663a。模型组与益脉降脂含药血清组共筛选出7 个差异表达显著miRNA:hsa‑miR‑3150a‑3p、hsa‑miR‑7704、 hsa‑miR‑877‑3p、 hsa‑miR‑150‑5p、hsa‑miR‑423‑5p、hsa‑miR‑374c‑3p、hsa‑miR‑374b‑5p。其中模型组与益脉降脂含药血清组差异倍数最显著 上 调 且 表 达 量 丰 富 的 miRNA 为hsa‑miR‑374c‑3p,差异倍数最显著下调且表达量高的miRNA 为hsa‑miR‑423‑5p、hsa‑miR‑374b‑5p。见表2、3 及图2。
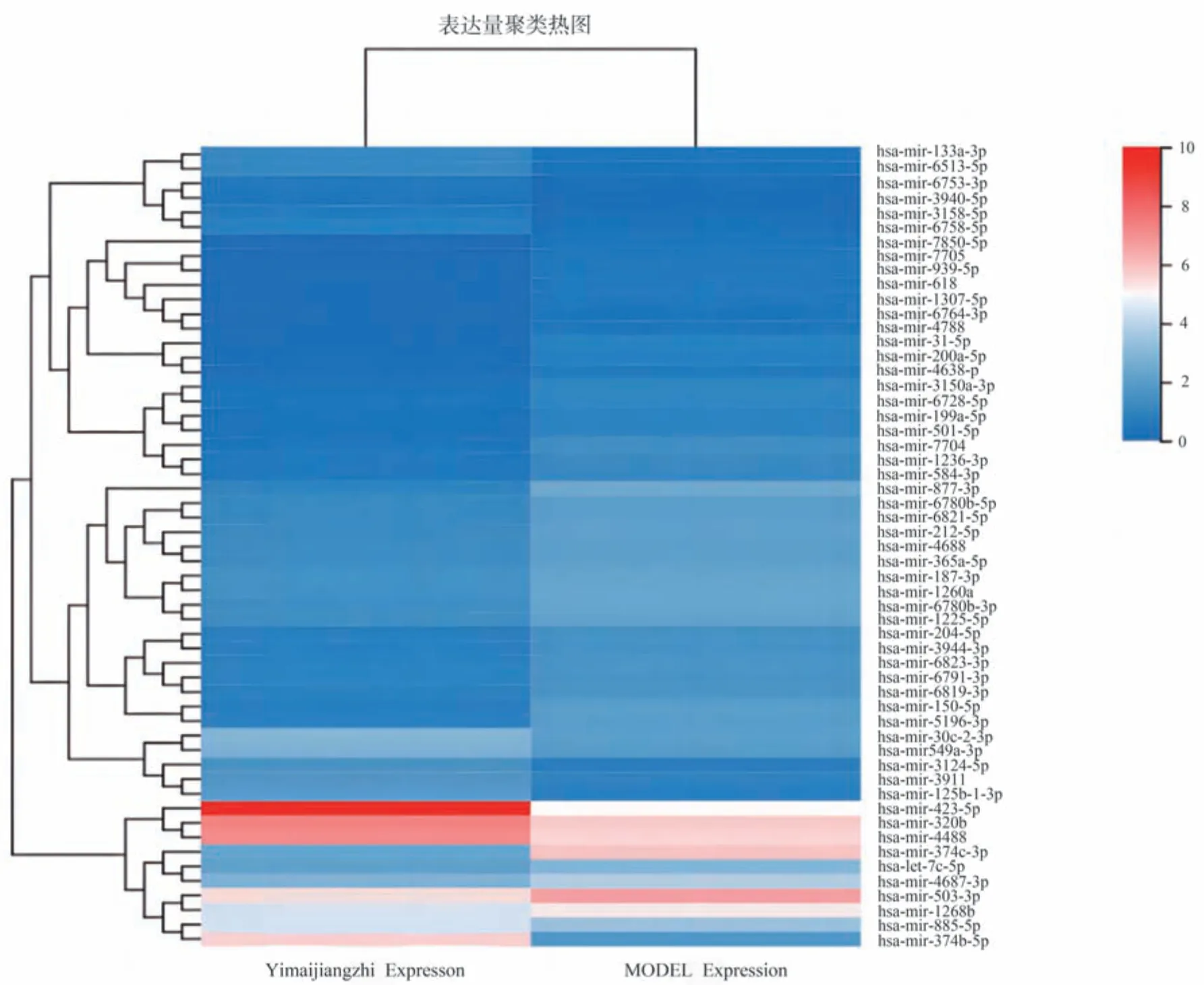
图2 差异基因聚类热图Fig 2 Clustering heat map of differential genes

表2 各组差异表达miRNA 情况Tab 2 miRNA expression in different groups
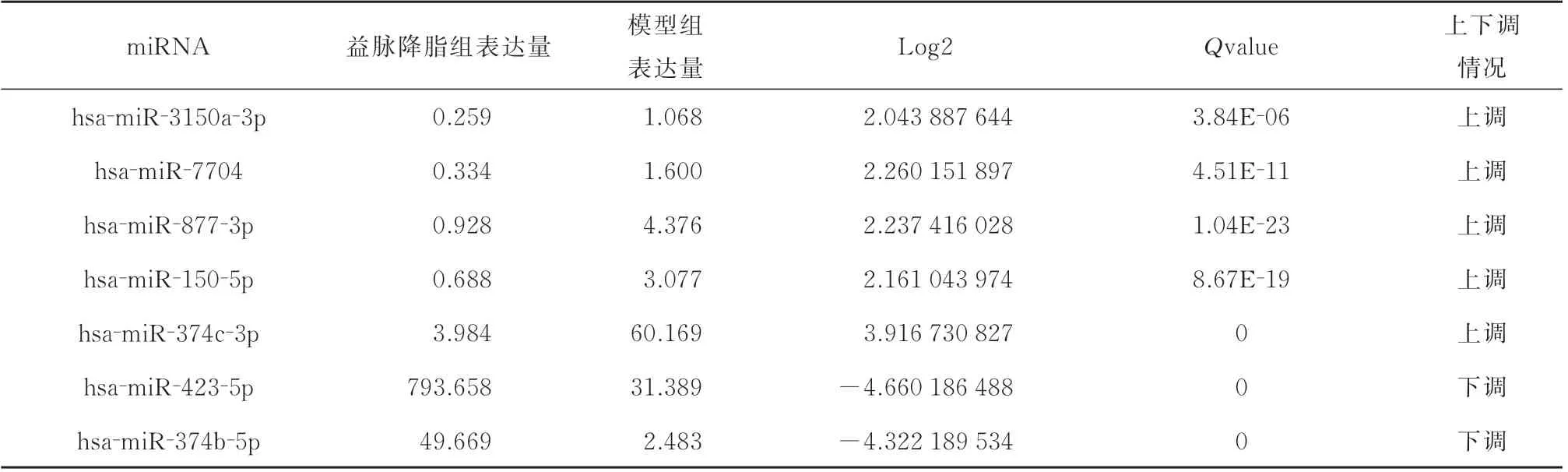
表3 模型组与益脉降脂组差异表达miRNA 情况Tab 3 Difference of miRNA expression between model group and drug⁃containing serum of Yimaijiangzhi group
2.3 空白组与模型组差异差异miRNA 靶基因生物信息学分析
2.3.1 GO 富集分析 将8 个差异表达显著miRNA(hsa‑miR‑302c‑3p、hsa‑miR‑302d‑3p、hsa‑miR‑30d‑3p、hsa‑miR‑3189‑3p、hsa‑miR‑374b‑5p、hsa‑miR‑423‑5p、hsa‑miR‑4781‑3p、hsa‑miR‑663a)进行靶基因预测,并对交集靶基因进行GO 富集分析,结果显示靶基因主要参与RNA 聚合酶Ⅱ启动子转录的正向调控、RNA 聚合酶Ⅱ启动子转录的负向调控、老化、Erk1和Erk2 级联负调控等生物学过程;显示转录因子活性、序列特异性DNA 结合、RNA 聚合酶Ⅱ转录因子活性等分子学功能;参与染色质、转录因子复合体、核浆、肌动蛋白细胞骨架、Cul4‑RING E3 泛素连接酶复合物等细胞组分。见图3。

图3 空白组vs 模型组预测靶基因GO 富集分析Fig 3 GO enrichment analysis of target genes predicted in control group and model group
2.3.2 KEGG Pathway 分析 对空白组与模型组筛选出的miRNA 的靶基因进行KEGG 富集分析,获得具有显著差异表达的miRNA 靶基因调控通路。KEGG 结果显示,预测的miRNA 靶基因共同参与富集了18 条信号通路,其中神经营养因子信号通路、Relaxin 信号通路、MAPK 信号通路、C‑型凝集素信号通路、雌激素信号通路差异较显著。见表4。

表4 交集基因信号通路分析Tab 4 Analysis of intersection gene signaling pathway
2.4 模型组与益脉降脂含药血清组差异miRNA 靶基因生物信息学分析
2.4.1 GO 富集分析 本研究重点在于讨论益脉降脂含药血清对THP‑1 源性泡沫细胞miRNA 的影响,故后续重点分析模型组与益脉降脂含药血清组差异miRNA。对差异表达倍数最显著的7 个miRNA(hsa‑miR‑3150a‑3p、hsa‑miR‑7704、hsa ‑miR‑877‑3p、hsa‑miR‑150‑5p、hsa‑miR‑423‑5p、hsa‑miR‑374c‑3p、hsa‑miR‑374b‑5p)进行靶基因预测。GO 分析显示这些靶基因参与了RNA 聚合酶II 启动子转录的正向调控、软骨细胞分化的正向调节、胆碱能突触传递、脂质分解代谢、谷胱甘肽代谢等生物过程;显示了肝素结合、鸟甘酸环化酶活性、谷胱甘肽转移酶活性等分子功能;参与突触后膜、中密度脂蛋白颗粒、低密度脂蛋白颗粒等细胞组分。见图4。

图4 模型组vs 益脉降脂含药血清组差异miRNA 预测靶基因GO 富集分析Fig 4 GO enrichment analysis of different miRNA prediction target genes in model group and drug⁃containing serum of Yimaijiangzhi group
2.4.2 差异miRNA 靶基因KEGG 分析 对模型组与益脉降脂含药血清组差异miRNA 的靶基因进行KEGG 富集分析,KEGG 结果显示,预测的miRNA靶基因共同参与富集了22 条信号通路,其中MAPK信号通路、ErbB 信号通路、Hippo 信号通路、Wnt 信号通路、Ras 信号通路差异较显著。见表5。
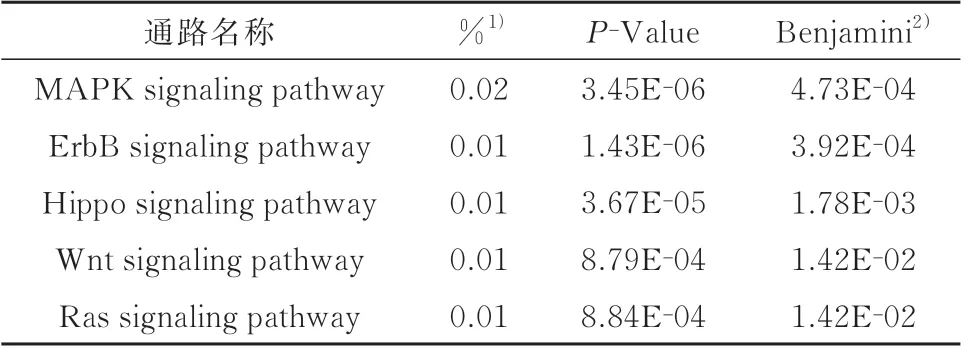
表5 交集基因信号通路分析Tab 5 Analysis of intersection gene signaling pathway
2.4.3 构建预测靶基因蛋白互作网络图 将预测的靶基因导入String 数据库(https://cn.string‑db.org/)构建蛋白互作网络,并用Cytoscape 软件根据degree 值、介数、最短路径进行分析,结果如图5,颜色越深,说明degree 值越大。 其中SCN1A、PRKA‑CA、MECP2、EIF4E、SRSF1、MBNL1、PRKCA、PPARGC1A 颜色最深,说明该靶点degree 值居前列,提示上述靶基因可能是益脉降脂汤含药血清发挥作用的核心潜在靶标,见图5。

图5 预测靶基因蛋白互作网络图Fig 5 Network diagram of predicted target gene protein interaction
2.4.4 构建miRNA‑靶基因调控网络 对上述7 个差异 miRNA 预测的靶基因,使用Cytoscape 构建miRNA‑靶基因调控网络,其中调控靶基因最多的 miRNA 为hsa‑miR‑3150a‑3p、hsa‑miR‑877‑3p、hsa‑miR‑423‑5p,被显著调控关联的基因为SP1、AGAP1、BACH2、BTBD9、GRIN2B、LARP1、MDM4等。见图6。
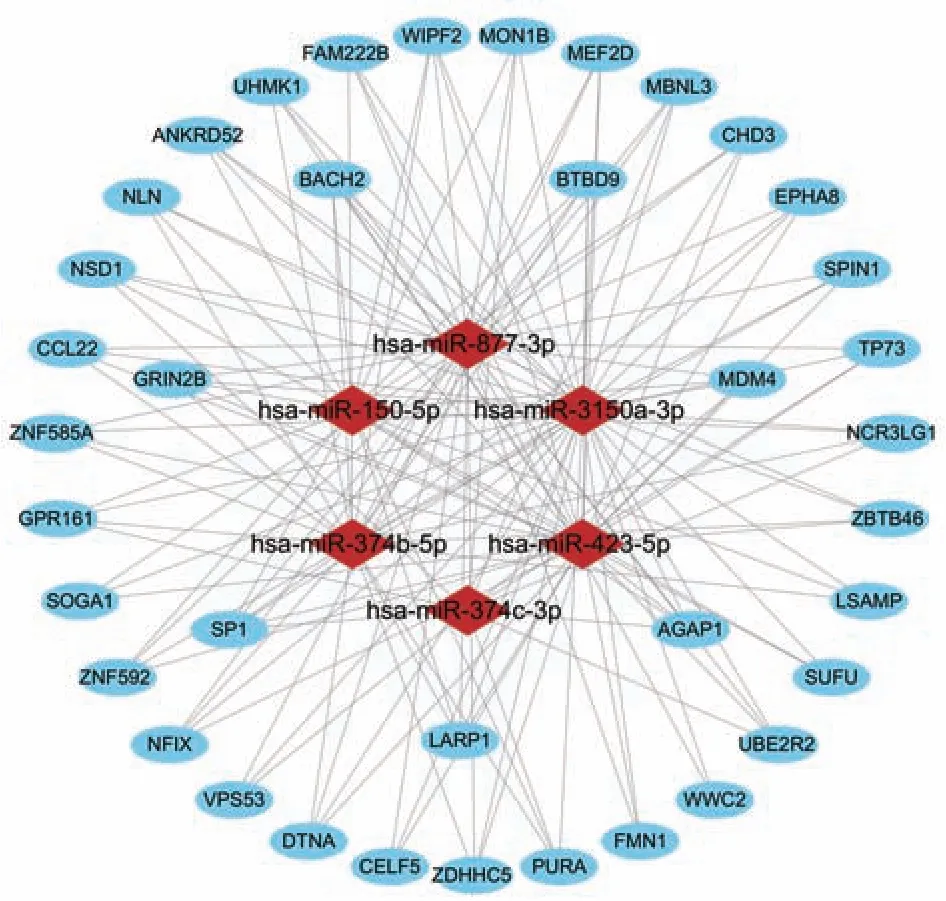
图6 miRNA‑靶基因调控网络Fig 6 miRNA⁃target genes control network diagram
2.5 益脉降脂汤含药血清对THP‑1 源性泡沫细胞差异表达miRNA 靶基因的后续验证
为证实靶基因预测结果可靠性及准确性,本研究选取Wnt 信号通路、MAPK 信号通路上下游基因进行验证。在Wnt 信号通路上,与空白组相比,模型组Wnt mRNA 表达水平升高,差异具有统计学意义(P<0.01);与模型组相比,益脉降脂含药血清组Wnt mRNA 表达水平下调,差异具有统计学意义(P<0.05)。与空白组相比,模型组β‑catenin mRNA表达水平升高,差异具有统计学意义(P<0.01);与模型组相比,益脉降脂含药血清组β‑catenin mRNA表达水平降低,差异具有统计学意义(P<0.01),见图7。

图7 实时荧光定量PCR 验证MAPK 信号通路、WNT 信号通路相关基因Fig 7 Real⁃time fluorescent quantitative PCR was used to verify genes related to MAPK signaling pathway and WNT sig⁃naling pathway
在MAPK 信号通路上,与空白组相比,模型组Mkk4 mRNA 表达水平升高,差异具有统计学意义(P<0.05);与模型组相比,益脉降脂含药血清组Mkk4 mRNA 表达水平降低,差异具有统计学意义(P<0.05)。与空白组相比,模型组Elk1 mRNA 表达水平升高,差异具有统计学意义(P<0.01);与模型组相比,益脉降脂含药血清组Elk1 mRNA 表达水平下降,差异具有统计学意义(P<0.01),见图7。
3 讨论
动脉粥样硬化在于脏腑功能失调导致血液运行不畅,血脉瘀毒,机体本虚,同时存在痰浊、血瘀、邪毒交结[10]。益脉降脂汤方中白术、茯苓、泽泻、草决明、黄芪健脾化痰,益气降浊;丹参、泽泻活血化瘀通脉;野菊花清肝泻火;枸杞子、何首乌、黄精滋补肝肾,绞股蓝、焦山楂为辩病用药,药理研究表明其具有调脂作用[11,12]。诸药合用,共奏健脾化痰降浊、活血化瘀通脉、滋补肝肾之功效。现代药理研究显示,丹参化合物的丹参二醇C 能够通过激活Nrf2/Sirt1 信号通路抑制巨噬细胞泡沫化[13],黄芪化合物黄芪黄酮可通过抑制泡沫细胞的形成延缓动脉粥样硬化的进程,同时黄芪黄酮还可通过下调脂质合成,减少脂质紊乱导致的动脉粥样硬化[14]。更有研究表明,绞股蓝中的绞股蓝总皂苷增强Sirt1/FOXO1 介导的自噬通量恢复可有效抑制ox‑LDL 摄取以及泡沫细胞的形成[15]。由此可见,益脉降脂汤的多种中药有效化合物具有抑制巨噬细胞泡沫化的潜能。
前期研究证实益脉降脂汤含药血清对巨噬细胞泡沫化具有减少脂质蓄积的作用[9],本研究以泡沫细胞模型为研究对象,以益脉降脂含药血清干预泡沫细胞,探讨益脉降脂汤基于miRNA 水平改善巨噬细胞泡沫化的调控机制。结果显示,模型组与益脉降脂含药血清组相比,共筛选出55 个差异表达的miRNA。当差异倍数绝对值|log2(MODEL/DRUG)|≥2,Qvalue<0.01 且两组任意一组或两组须满足表达量>1,筛选出7 个差异miRNA,hsa‑miR‑423‑5p、hsa‑miR‑374c‑3p、hsa‑miR‑374b‑5p表达量丰富,且差异倍数显著,提示这3 个差异表达的miRNA 可能在益脉降脂汤含药血清调节泡沫细胞脂质代谢的调控中发挥重要作用。上调最为显著miRNA 是hsa‑miR‑374c‑3p,现有文献发现hsa‑miR‑374c‑3p 与自身免疫性脑脊髓炎、肺动脉高 压 相 关[16,17]。 下调的 16 个 miRNA 以hsa‑miR‑423‑5p、hsa‑miR‑374b‑5p 最为显著,研究表明miR‑423‑5p 可成为判断急性心肌梗死预后以及预测不良心血管事件的生物标志物[18],目前hsa‑miR‑374b‑5p 的研究大多数与癌症、脓毒症、深静脉血栓、囊型棘球蚴病相关[19‑22]。而在这3 个miRNA 中,仅有miR‑423‑5p 有研究报道可调控心血管疾病,hsa‑miR‑374b‑5p、miR‑374c‑3p 或其他差异表达显著的miRNA 尚未有报道说明与动脉粥样硬化直接关联或潜在联系,这些miRNA 在动脉粥样硬化中发挥的作用仍有待验证。
KEGG 显示,差异miRNA 预测的靶基因富集在MAPK 信号通路、ErbB 信号通路、Hippo 信号通路、Wnt 信号通路、Ras 信号通路等22 个与动脉粥样硬化密切相关的通路。本研究选取Wnt 信号通路与MAPK 信号通路上关键靶基因进行PCR 验证,模型组Wnt、β‑catenin、Mkk4、Elk1 的mRNA 表达较空白组升高,而加入益脉降脂含药血清干预后,Wnt、β‑catenin、Mkk4、Elk1 的mRNA 表达均较模型组下调,说明益脉降脂含药血清可能是通过Wnt 信号通路、MAPK 信号通路对泡沫细胞进行调控,从而发挥改善动脉粥样硬化的作用。
蛋白质互作网络图中发现,可能与巨噬细胞泡沫化相关的基因簇为SCN1A、PRKACA、MECP2、EIF4E、SRSF1、MBNL1、PRKCA、PPARGC1A。miRNA‑靶基因调控网络显示,调 控 靶 基 因 最 多的 miRNA 为 hsa‑miR‑3150a‑3p、hsa‑miR‑877‑3p、hsa‑miR‑423‑5p,被显著调控关联的基因为SP1、AGAP1、BACH2、BTBD9、GRIN2B、LARP1、MDM4。本研究尚未能完全阐明前期研究中益脉降脂汤调节巨噬细胞泡沫化的分子机制,miRNA 调控机制复杂,差异表达显著的miRNA 具体参与何种机制发挥调节THP‑1 源性泡沫细胞,改善动脉粥样硬化的作用仍需进一步研究。
结合上述,本研究通过miRNA 测序,对益脉降脂汤含药血清干预THP‑1 源性泡沫细胞模型的差异表达miRNA 进行了靶基因预测,通过对差异表达显著的miRNA 靶基因进行GO、KEGG 分析,构建蛋白质互作网络图以及miRNA‑靶基因网络图,根据相关性和重要性对主要的预测结果进行了RT‑qPCR 验证,初步阐明了益脉降脂汤含药血清在泡沫细胞模型中发挥关键作用的生物结构和分子功能,为益脉降脂汤治疗动脉粥样硬化提供实验基础和思路。
作者贡献度说明:
赖春冰:负责生物信息学分析、RT‑qPCR、论文撰写;古展鑫:负责细胞实验操作、数据处理;刘锐:负责实验设计、实验指导、论文修改。
所有作者声明不存在利益冲突关系。

