毛蕊花糖苷对冠心病大鼠炎症及脂代谢的影响
任引刚,祝松涛(空军军医大学第二附属医院老年医学科,西安 710038;通讯作者,E-mail:SONGTAO850126@163.com)
冠心病(coronary heart disease,CHD)是一种由于脂代谢异常导致脂类物质沉着在动脉内膜上从而引起血管腔狭窄或阻塞的缺血性心脏病,随着饮食结构、生活方式、人口老龄化的改变,冠心病的患病率不断升高,严重威胁人类生命安全。冠心病的发生与脂代谢异常、炎症、血管内皮功能受损等多种因素有关。毛蕊花糖苷(verbascoside,Verb)是一种从许多双子叶植物中分离出来的糖苷类物质,毛蕊花糖苷具有多种药理活性,包括抗氧化、抗炎、抗癌、神经保护、心血管保护、抗糖尿病、软骨保护、肝脏保护和抗微生物等[1]。AMP激活的蛋白激酶(AMP activated protein kinase,AMPK)信号通路是能量代谢的调控中枢,在脂代谢调节中具有重要作用[2,3]。激活AMPK信号通路可纠正脂代谢异常[2,3],并且可改善血管内皮功能[4]。冠心病患者体内脂代谢异常与AMPK失调有关[5]。核因子-κB(nuclear factor- κB,NF-κB)是经典的炎症调节蛋白,与冠心病相关炎症密切相关[6]。据报道,毛蕊花糖苷是一种AMPK激动剂[7],并且对NF-κB具有抑制作用[8]。目前,有文献报道毛蕊花糖苷能抑制动脉粥样硬化的进展[9],但尚无学者研究其在冠心病治疗中的作用和机制。因此,本研究从炎症和脂代谢两个角度探讨了毛蕊花糖苷治疗冠心病的效果及可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 70只8周龄雄性SPF级SD大鼠(300~350 g)购自陕西医药控股集团生物制品有限公司,生产许可证号:SCXK(陕)2018-001,大鼠饲养条件如下:12 h/12 h光暗照明、(23±2)℃、55%±5%湿度。
1.1.2 实验试剂 毛蕊花糖苷(HY-N0021,纯度:99.83%)购自美国Med Chem Express公司;垂体后叶素注射液(国药准字H31022751)购自上海禾丰制药有限公司;高脂饲料(D12492)、正常饲料(D12450J)购自美国Research Diets公司;游离脂肪酸(free fatty acids,FFA)试剂盒(A042-1-1)购自南京建成生物工程研究所;大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)(SEKR-0009)、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)(SEKR-0030)、单核细胞趋化因子-1(monocyte chemoattractant protein-1,MCP-1)(SEKR-0024)ELISA试剂盒购自北京索莱宝科技有限公司;苏木素伊红(HE)染液、Trizol试剂(R0016)、BeyoRTTMⅢ cDNA第一链合成试剂盒(D7178M)、RIPA裂解液(P0013B)、BCA试剂盒(P0010S)购自碧云天生物技术研究所;SYBR Premix Ex Taq Ⅱ试剂盒(RR820A)购自日本TaKaRa公司;PVDF膜(YB101123-1)购自美国Millipore公司;p-NF-κB p65一抗(ab86299)、NF-κB p65一抗(ab288751)、p-AMPKα一抗(ab133448)、AMPKα一抗(ab32047)、β-actin一抗(ab213262)、IgG H&L(HRP)二抗(ab6721)购自美国Abcam公司。
1.2 方法
1.2.1 冠心病大鼠模型的建立 参考文献[10]方法,通过高脂饮食联合腹腔注射垂体后叶素建立冠心病大鼠模型。取55只大鼠进行建模,使用高脂饲料喂养大鼠8周,最后3 d对大鼠腹腔注射30 U/(kg·d)的垂体后叶素。建模后,随机处死3只大鼠进行病理学检查,观察冠脉内膜损伤、管壁脂质沉积、心肌排列紊乱、细胞肿胀等病变,另外,检测大鼠心电图,观察到T波高耸、心律不齐、ST段抬高超过0.1 mV表示造模成功[11]。剔除饲养过程中出现外伤的大鼠。
1.2.2 动物分组及处理 将48只建模成功的大鼠随机分为模型组、毛蕊花糖苷低剂量组(低剂量组)、毛蕊花糖苷中剂量组(中剂量组)和毛蕊花糖苷高剂量组(高剂量组),每组12只。另取12只正常饲料喂养的大鼠作为对照组。对照组和模型组大鼠每天灌胃2 mL生理盐水,低、中和高剂量组大鼠每日灌胃2 mL剂量为20,40,80 mg/kg的毛蕊花糖苷(溶于生理盐水)[12,13]。共灌胃4周。
1.2.3 心功能参数EF和FS的测定 末次给药24 h后,使用加拿大VisualSonics公司生产的VEVO 3100小动物超声成像系统评估大鼠的心功能。大鼠用异氟醚麻醉(5%用于诱导,2%~2.5%用于维持麻醉),仰卧位固定。左胸区脱毛,涂上偶联剂。测定射血分数(ejection fraction,EF)和短轴缩短率(fraction shortening,FS)。
1.2.4 血清心肌损伤标志物、脂代谢指标和炎症指标的测定 末次给药24 h后,大鼠腹主动脉采血,3 000 r/min 4 ℃离心15 min,取血清。采用日立7600-010型生化分析仪检测心肌损伤标志物[肌酸激酶同工酶MB(creatine kinase-MB,CK-MB)、乳酸脱氢酶(lactate dehydrogenase,LDH)]和脂代谢指标[总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)]水平。根据试剂盒说明检测血清炎症指标(FFA、TNF-α、ICAM-1和MCP-1)水平。
1.2.5 心肌组织HE染色 处死大鼠并分离心脏,4%多聚甲醛固定24 h,然后石蜡包埋,制作4 μm厚的切片。根据试剂盒说明书进行HE染色。在奥林巴斯CKX53倒置显微镜下拍摄图像。
1.2.6 qRT-PCR检测AMPKα、PPAR-α、PPAR-γ和PGC-1α的mRNA水平 qRT-PCR检测心肌组织中AMPKα、过氧化物酶体增殖物激活受体-α(PPAR-α)、PPAR-γ和PPAR-γ激活分子1α(PGC-1α)的mRNA水平。使用Trizol试剂提取心肌组织总RNA,使用Thermo Scientific NanoDrop 1000超微量分光光度计计算RNA纯度和浓度。使用BeyoRTTMⅢ cDNA第一链合成试剂盒将RNA逆转录为cDNA。然后使用SYBR Premix Ex Taq Ⅱ试剂盒在Bio-Rad CFX384实时荧光定量PCR仪上进行PCR。PCR反应条件如下:95 ℃ 1 min;95 ℃ 15 s,61 ℃ 10 s,72 ℃ 10 s,40个循环。引物序列见表1。β-actin作为内参基因。使用2-ΔΔCt法计算基因相对表达量。

表1 引物序列Table 1 Primer sequences
1.2.7 Western blot检测p-NF-κB p65、NF-κB p65、p-AMPKα和AMPKα蛋白水平 通过Western blot检测心肌组织中NF-κB p65和AMPKα的磷酸化水平。使用RIPA缓冲液提取总蛋白,采用BCA法进行蛋白浓度定量。10% SDS-PAGE电泳分离蛋白,然后转移到PVDF膜上。5%脱脂牛奶封闭1 h后,将膜与p-NF-κB p65(1∶5 000)、NF-κB p65(1∶5 000)、p-AMPKα(1∶3 000)、AMPKα(1∶3 000)和β-actin(1∶2 000,内参)一抗4 ℃孵育过夜,然后与HRP结合的IgG二抗(1∶5 000)37 ℃孵育1 h。ECL显影,ImageJ软件分析条带灰度值,并计算p-NF-κB p65/NF-κB p65和p-AMPKα/AMPK比值。
1.3 统计学分析
2 结果
2.1 毛蕊花糖苷对冠心病大鼠心功能的影响
与对照组比较,模型组大鼠的EF和FS降低(P<0.05);与模型组比较,低、中和高剂量组大鼠的EF和FS剂量依赖性升高(P<0.05,见表2)。

表2 毛蕊花糖苷对冠心病大鼠EF和FS的影响 (%)Table 2 Effect of verbascoside on EF and FS in rats with coronary heart disease (%)
2.2 毛蕊花糖苷对冠心病大鼠血清心肌损伤标志物的影响
与对照组比较,模型组大鼠血清CK-MB和LDH水平升高(P<0.05);与模型组比较,低、中和高剂量组大鼠血清CK-MB和LDH水平呈剂量依赖性降低(P<0.05,见表3)。

表3 毛蕊花糖苷对冠心病大鼠血清CK-MB和LDH水平的影响 (U/mL)Table 3 Effect of verbascoside on serum CK-MB and LDH levels in rats with coronary heart disease (U/mL)
2.3 毛蕊花糖苷对冠心病大鼠血清脂代谢指标的影响
与对照组比较,模型组大鼠血清TC、TG、LDL-C和FFA水平升高,HDL-C水平降低(P<0.05,见表4)。与模型组比较,低、中和高剂量组大鼠血清TC、TG、LDL-C和FFA水平呈剂量依赖性降低,HDL-C水平呈剂量依赖性升高(P<0.05,见表4)。
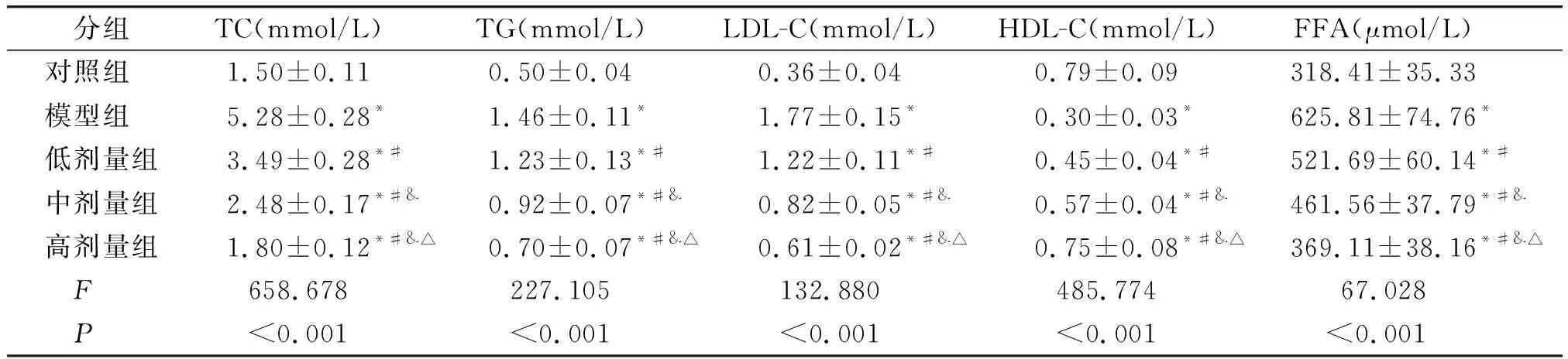
表4 毛蕊花糖苷对冠心病大鼠血清TC、TG、LDL-C、HDL-C和FFA水平的影响Table 4 Effect of verbascoside on serum levels of TC, TG, LDL-C, HDL-C and FFA in rats with coronary heart disease
2.4 毛蕊花糖苷对冠心病大鼠血清炎症指标的影响
与对照组比较,模型组大鼠血清TNF-α、ICAM-1和MCP-1水平升高(P<0.05,见表5)。与模型组比较,低、中和高剂量组大鼠血清TNF-α、ICAM-1和MCP-1水平呈剂量依赖性降低(P<0.05,见表5)。

表5 毛蕊花糖苷对冠心病大鼠血清TNF-α、ICAM-1和MCP-1水平的影响 (pg/mL)Table 5 Effect of verbascoside on serum levels of TNF-α, ICAM-1 and MCP-1 in rats with coronary heart disease (pg/mL)
2.5 毛蕊花糖苷对冠心病大鼠心肌组织病变的影响
HE染色显示,对照组大鼠心肌纤维排列紧密有序,心肌细胞均匀细长,未见明显炎性细胞浸润或水肿;与对照组比较,模型组大鼠心肌纤维粗大无序,心肌细胞肥大、变性坏死,细胞核收缩、溶解,伴有大量炎性细胞浸润;与模型组比较,低、中和高剂量组大鼠心肌纤维排列较整齐,细胞形态趋于正常,炎性细胞减少(见图1)。

注:黑色箭头所指为空泡化细胞;蓝色箭头所指为炎性细胞;黄色箭头所指为肿胀、变形的细胞。图1 毛蕊花糖苷对冠心病大鼠心肌组织病变的影响 (HE染色,×200)Figure 1 Effect of verbascoside on pathological changes of myocardial tissue of rats with coronary heart disease (HE staining,×200)
2.6 毛蕊花糖苷对冠心病大鼠心肌组织中NF-κB磷酸化的影响
与对照组比较,模型组心肌组织中NF-κB p65的磷酸化水平升高(P<0.05);与模型组比较,低、中和高剂量组心肌组织中NF-κB p65的磷酸化水平呈剂量依赖性降低(P<0.05,见图2)。
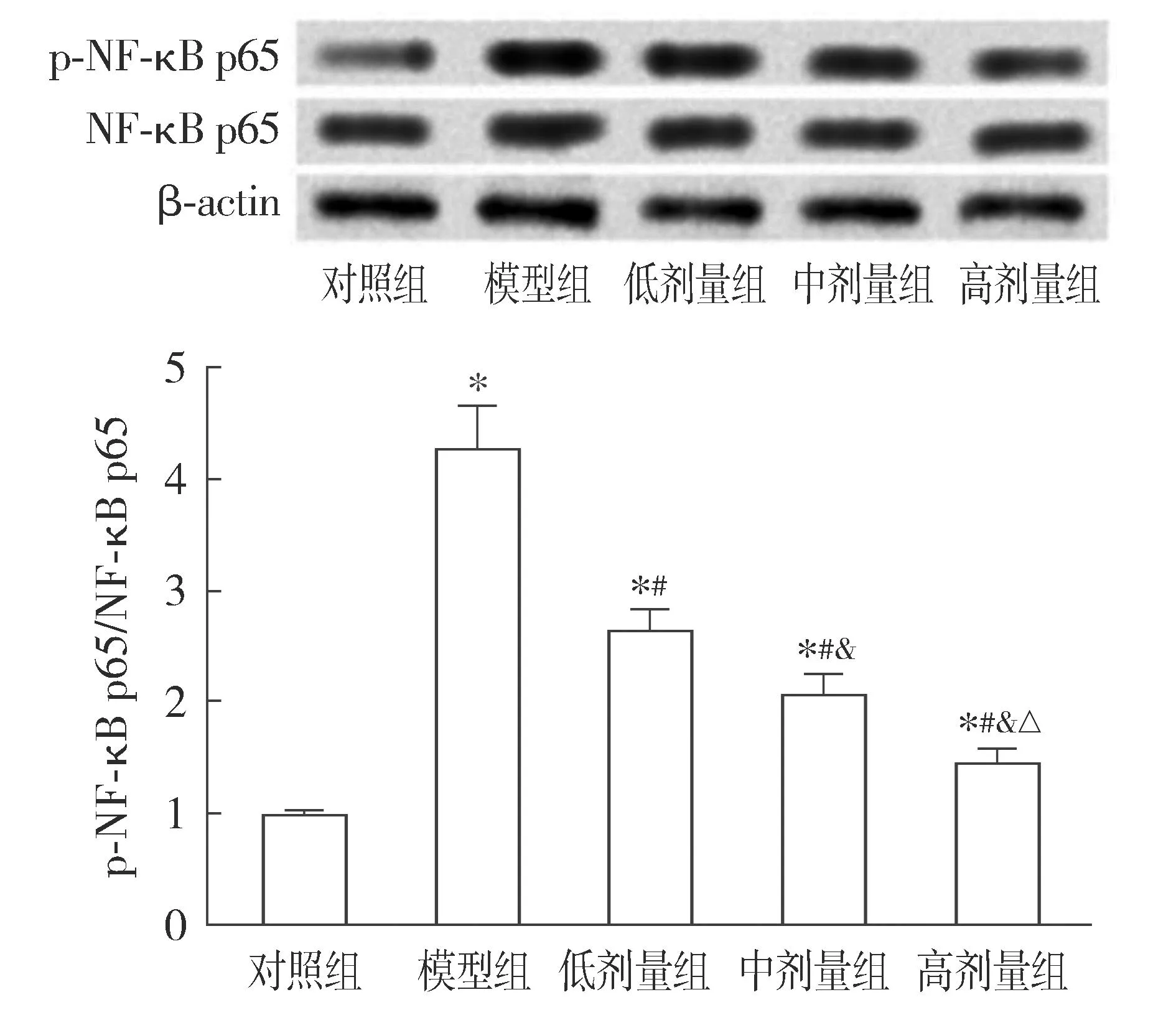
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05;与中剂量组比较,△P<0.05。图2 毛蕊花糖苷对冠心病大鼠心肌组织中的NF-κB磷酸化水平的影响Figure 2 Effect of verbascoside on NF-κB phosphorylation in myocardial tissue of rats with coronary heart disease
2.7 毛蕊花糖苷对冠心病大鼠心肌组织中脂代谢基因转录和表达的影响
与对照组比较,模型组大鼠心肌组织中AMPKα、PPAR-α、PPAR-γ和PGC-1α mRNA水平降低(P<0.05);与模型组比较,低、中和高剂量组大鼠心肌组织中AMPKα、PPAR-α、PPAR-γ和PGC-1α mRNA水平呈剂量依赖性升高(P<0.05,见图3)。
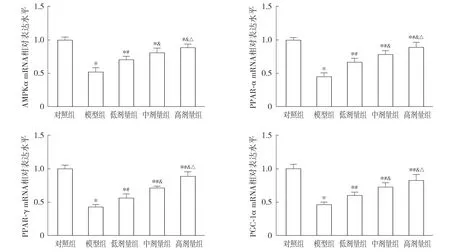
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05;与中剂量组比较,△P<0.05。图3 毛蕊花糖苷对冠心病大鼠心肌组织中的AMPKα、PPAR-α、PPAR-γ和PGC-1α mRNA水平的影响Figure 3 Effect of verbascoside on AMPKα, PPAR-α, PPAR-γ and PGC-1α mRNA levels in myocardial tissue of rats with coronary heart disease
与对照组比较,模型组大鼠心肌组织中AMPKα的磷酸化水平降低(P<0.05);与模型组比较,低、中和高剂量组大鼠心肌组织中AMPKα的磷酸化水平呈剂量依赖性升高(P<0.05,见图4)。

注:与对照组比较,*P<0.05;与模型组比较,#P<0.05;与低剂量组比较,&P<0.05;与中剂量组比较,△P<0.05。图4 毛蕊花糖苷对冠心病大鼠心肌组织中的AMPKα磷酸化水平的影响Figure 4 Effect of verbascoside on AMPKα phosphorylation in myocardial tissue of rats with coronary heart disease
3 讨论
毛蕊花糖苷的心血管保护作用已经在其他研究中报道。例如,Campo等[14]报道,毛蕊花糖苷可显著抑制二磷酸腺苷和花生四烯酸诱导的人血小板聚集。Zhu等[15]报道,毛蕊花糖苷能够改善脂多糖诱导的败血症大鼠的心功能,抑制氧化应激、炎症和心肌细胞凋亡,促进线粒体生物发生。一项随机、单中心、双盲临床实验考察了100名伴有心血管危险因素(年龄>65岁,糖尿病,高血压病,吸烟,高血脂,男性腰围>102 cm或女性腰围>88 cm)的受试者在口服安慰剂或50 mg和100 mg毛蕊花糖苷后的血小板聚集值,研究显示,2周摄入毛蕊糖苷100 mg可显著降低伴有心血管危险因素受试者的血小板聚集值,并且在研究过程中没有严重的不良事件报告[16]。这些文献提示毛蕊花糖苷可能在治疗冠心病方面具有潜力。本研究使用了20,40,80 mg/kg的毛蕊花糖苷治疗高脂饮食联合腹腔注射垂体后叶素诱导的冠心病大鼠模型4周,结果表明毛蕊花糖苷剂量依赖性地升高了冠心病大鼠的EF和FS,降低了血清CK-MB和LDH水平,改善了心肌形态,提示毛蕊花糖苷对冠心病大鼠具有治疗作用。
炎症与冠心病的发生机制有关,TNF-α、ICAM-1和MCP-1等炎症介质在冠心病患者中高表达,可诱导冠心病病理条件下的血管内皮损伤[17]。TNF-α是一种典型的促炎细胞因子,与冠心病炎症密切相关。冠心病中的内皮细胞、白细胞和血小板之间的相互黏附可加剧炎症反应,促进斑块形成。ICAM-1是介导细胞和基质之间相互作用的糖蛋白,可促进内皮细胞和中性粒细胞的黏附[18]。MCP-1可趋化和激活单核或巨噬细胞,诱导黏附分子表达[19]。据报道,冠心病患者经有效治疗后,血清TNF-α水平明显降低[20],降低ICAM-1和MCP-1的水平有利于提高冠心病患者的斑块稳定性[17]。本研究显示毛蕊花糖苷剂量依赖性地降低了冠心病大鼠血清TNF-α、ICAM-1和MCP-1水平,提示毛蕊花糖苷能抑制冠心病大鼠体内炎症介质的分泌。
TNF-α、ICAM-1和MCP-1等炎症介质均受到经典促炎信号通路NF-κB的调节,磷酸化的NF-κB p65转位至细胞核并调控其下游炎症介质的转录和表达,其在冠心病炎症调节中非常重要[21,22]。有学者报道,毛蕊花糖苷通过抑制NF-κB的活化减轻阿尔茨海默病小鼠神经炎症[23]。本研究也发现毛蕊花糖苷剂量依赖性地降低了冠心病大鼠心肌组织中NF-κB p65的磷酸化水平。提示毛蕊花糖苷对冠心病大鼠的治疗作用可能与抑制NF-κB介导的炎症反应有关。
脂代谢异常是冠心病的主要病理特征之一,与斑块形成直接相关[17]。此外,脂肪堆积还会破坏DNA和细胞完整性,对器官和组织造成损伤[24,25]。其他学者已经证实氯吡格雷联合依折麦布治疗冠心病的机制与调节血脂紊乱有关,纠正脂代谢异常是治疗冠心病的有效手段[26]。毛蕊花糖苷具有明显的调脂作用。Sun等[27]通过高浓度油酸处理HepG2细胞建立脂质堆积模型,考察了毛蕊花糖苷对脂质代谢的影响,结果表明毛蕊花糖苷通过调控Scarb1、Scarb2、Srebf1、Dhcr7、Acat2、Hmgcr、Fdft1、Lss等多个基因的表达来改变脂质代谢和合成,这些基因涉及糖酵解、AMPK、脂肪酸降解等多种途径。本研究结果显示毛蕊花糖苷剂量依赖性地降低了冠心病大鼠血清TC、TG、LDL-C和FFA水平,升高了HDL-C水平,表明毛蕊花糖苷纠正了冠心病大鼠的血脂代谢异常。
AMPK在脂代谢调节中具有重要作用[28]。据报道,冠心病患者血浆AMPKα1水平明显下降[29]。另外,冠心病大鼠血管内皮细胞中AMPKα的磷酸化水平显著降低,注射AMPK激动剂后,冠心病大鼠AMPKα的磷酸化水平明显升高,血管内皮功能显著改善[4]。在其他文献中,三七皂苷R1改善冠心病大鼠心肌损伤的机制与激活AMPK信号通路有关[30]。因此,激活AMPK是减轻冠心病的一种有效途径。Olivares-Vicente等[31]开展的分子对接实验表明,毛蕊花糖苷是AMPK的直接激动剂,可结合到γ亚基的AMP结合位点或γ和β亚基之间相互作用区的不同位点。其他学者报道,毛蕊花糖苷能显著降低糖尿病KK-Ay小鼠血清和肝脏脂质含量,提高AMPK的磷酸化水平,并降低脂质合成标志物乙酰辅酶A羧化酶和脂肪酸合成酶的表达水平,此外,毛蕊花糖苷通过增加脂肪甘油三酯脂肪酶(ATGL)和肉碱棕榈酰转移酶(CPT)-1的mRNA表达促进脂肪分解和脂肪酸氧化[32]。然而,目前尚不清楚毛蕊花糖苷对冠心病大鼠AMPKα活化的影响,因此本研究检测了各组大鼠心肌组织中AMPKα的磷酸化情况,结果发现毛蕊花糖苷剂量依赖性地升高了冠心病大鼠心肌组织中AMPKα的磷酸化水平,推测AMPKα的激活可能是毛蕊花糖苷改善冠心病大鼠心功能和减轻心肌损伤的一种途径。
PPAR-α和PPAR-γ在调节脂肪酸氧化、脂肪因子的合成和分泌、炎症和血管反应中起着中枢协调作用[33-35]。有报道称,在心肌缺血的情况下,PPAR-α和PPAR-γ的基因表达减少,加重了心肌缺血损伤[36,37]。另外,PGC-1α是一种在心肌、骨骼肌、脑组织中表达的控制能量稳态的转录共调节因子,参与调控脂肪酸氧化代谢[38]。AMPK通过激活PGC-1α及其下游PPAR-α、PPARγ来促进脂代谢[39]。此外,PPAR-α还通过抑制NF-κB介导的促炎因子的分泌而发挥抗炎作用[40,41]。Esposito等[42]研究表明在实验性结肠炎小鼠中毛蕊花糖苷对PPAR-α具有激活作用,毛蕊花糖苷通过激活PPAR-α抑制了肠道炎症。上述文献说明毛蕊花糖苷对AMPKα下游的脂代谢基因具有调控作用,然而,目前尚不清楚在冠心病中毛蕊花糖苷是否也通过调控AMPKα下游的脂代谢基因来纠正脂代谢紊乱。为了进一步揭示毛蕊花糖苷激活AMPKα调节脂代谢的具体途径,本研究检测了AMPK下游转录因子PPAR-α、PPAR-γ和PGC-1α的表达情况,结果显示毛蕊花糖苷剂量依赖性地升高了冠心病大鼠心肌组织中AMPKα、PPAR-α、PPAR-γ和PGC-1α的转录水平。因此,推测毛蕊花糖苷可能通过调节AMPK介导的脂代谢基因转录和表达纠正冠心病大鼠的脂代谢紊乱。
综上所述,虽然其他学者已经报道了毛蕊花糖苷的心血管保护、抗炎和调脂作用,这些作用均与冠心病的发生发展有关,然而,尚无文献报道毛蕊花糖苷治疗冠心病的作用及机制,因此在冠心病动物模型中探讨毛蕊花糖苷的药效对于冠心病新药研发具有重要意义。本研究首次发现毛蕊花糖苷能有效改善冠心病大鼠的心功能,减轻心肌损伤,其机制可能与抑制NF-κB介导的炎症反应和激活AMPK介导的脂代谢基因转录和表达有关。因此,毛蕊花糖苷在治疗冠心病方面具有较高的开发前景。本研究也存在局限性:首先,本研究证实了毛蕊花糖苷在治疗冠心病方面具有潜力,然而,毛蕊花糖苷具有多种生物活性,其影响冠心病进展的机制可能不限于调节炎症和脂代谢;其次,本研究虽然未发现毛蕊花糖苷引起的明显毒副反应,然而,其使用剂量范围及远期毒性仍有待揭示;最后,本研究为一项动物模型实验,毛蕊花糖苷在人体中的应用效果尚未可知。因此,本研究将在后续实验中进一步揭示毛蕊花糖苷治疗冠心病的其他机制,进一步扩大剂量范围考察其长期毒性,从而为毛蕊花糖苷的临床应用提供基础支撑。

