巨噬细胞极化为M1 型或M2 型对铁代谢的影响
吴莲凤 钱菁菁 詹玲玲 陆红
巨噬细胞的表型具有可塑性,在不同的微环境作用下,能够极化为功能状态截然不同的两种细胞,如脂多糖(lipopolysaccharide,LPS)、IFN-γ 和IL-1β 可诱导巨噬细胞极化为经典激活(M1 型)细胞,而IL-4和IL-13 可诱导巨噬细胞极化为替代激活(M2 型)细胞[1]。其中LPS 和IL-4 为巨噬细胞极化体外实验常用的诱导剂。近年来,对巨噬细胞在极化过程中代谢谱的相关性研究不断增多,特别是铁代谢研究成了学者们的关注热点,认为巨噬细胞在体内铁平衡中起着关键作用。有研究显示,炎症中巨噬细胞通过铁吸收增加和输出减少使体内铁的滞留增加,铁的积累可进一步诱导巨噬细胞极化为M1 型。M1 型巨噬细胞能产生活性氧、一氧化氮及炎症因子等杀伤分子,损害邻近的成纤维细胞,最终导致组织修复能力受损及无法愈合的慢性创伤[2]。同时还发现,M2 型巨噬细胞的条件培养基能更快地维持恶性和非恶性细胞株的生长[3-4]。然而,目前尚不清楚不同极化亚型巨噬细胞铁稳态的调控模式。本研究使用LPS、IL-4 处理巨噬细胞引起其表型极化,再将诱导后的亚型巨噬细胞与红细胞和铁剂共培养,检测铁蛋白含量的变化,观察不同极化亚型巨噬细胞对铁摄入及存储的影响,从而为通过调控巨噬细胞极化影响疾病进展提供实验依据。
1 材料和方法
1.1 材料 小鼠巨噬细胞RAW264.7 细胞系购自中国科学院细胞库,LPS(批号:IL2020)购自北京索莱宝科技有限公司,IL-4(批号:CK74)购自苏州近岸生物有限公司,铁剂(右旋糖酐铁注射液,批号:316012801)购自浙江天瑞药业公司,铁蛋白检测试剂盒(型号:H129-1-2)购自南京建成生物科技有限公司,兔抗鼠TNF-α 抗体(批号:60291-1-Ig)、精氨酸酶1(arginase 1,Arg-1)抗体(批号:16001-1-AP)和一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体(批号:22226-1-AP)均购自美国PeproTech 公司,脱纤维绵羊血(批号:X05002)购自温州康泰生物技术有限公司,瑞吉染液试剂(批号:BA4017C)购自珠海贝索生物技术有限公司,亚铁氰化钾(批号:20210725)购自天津市恒星化学试剂制造有限公司,DMEM 培养基购自美国Gibco 公司,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)购自北京索莱宝科技有限公司,Cy3 山羊抗兔二抗购自美国ProteinTech 公司。缓冲液(磷酸二氢钾13.28 g/2 L 购自上海联试化工有限公司、磷酸氢二钠12.9 g/2 L 购自西陇科学股份有限公司),稀释盐酸购自浙江中星化工试剂有限公司,中性红购自上海三爱思试剂有限公司,光学显微镜(型号:ECLIPSE 50i 及Ti-s)购自日本Nikon 公司,激光共聚焦显微镜(德国Zeiss 公司,型号:LSM710),凝胶成像仪(型号:Amersham Imager 680)购自美国GE 公司,酶标仪(型号:Infinite M200 PRO)购自瑞士TECAN公司。
1.2 方法
1.2.1 细胞培养 将RAW264.7 细胞置于37 ℃水浴锅中快速震荡1~2 min 以解冻,然后置于含有3 mL PBS溶液的15 mL 离心管中,1 000 r/min 离心5 min(离心半径10 cm)后弃去上清液,加入DMEM 培养基(含10%灭活PBS 与双抗)进行重悬浮,细胞浓度约105个/mL,再置于37 ℃、5% CO2培养箱中培养。2~3 d 后更换培养基,待细胞处于对数生长期,细胞浓度约为106个/mL时,加入LPS 20 ng/mL 或IL-4 10 ng/mL 继续培养24 h,诱导巨噬细胞极化。采用光学显微镜观察诱导后的巨噬细胞形态学变化,并采集图像。
1.2.2 观察TNF-α 和Arg-1 表达情况 采用免疫荧光染色法。将极化后的巨噬细胞与TNF-α 抗体(1∶500)或Arg-1抗体(1∶500)在室温下孵育1 h,随后与Cy3 山羊抗兔二抗避光孵育1 h。用PBS 洗涤3 次后,将细胞在含有40 mg/mL DAPI的培养基中孵育5 min,随后在激光共聚焦显微镜下采集图像,观察诱导后巨噬细胞TNF-α 和Arg-1 表达情况。
1.2.3 TNF-α、iNOS 和Arg-1 表达水平的检测 采用Western blot法。将极化后的巨噬细胞经PBS洗涤3 次,加入细胞裂解液裂解细胞后,12 000 r/min 4 ℃离心20 min(离心半径10 cm)。小心吸出上清液,用BCA 法进行上清液的蛋白质定量。用4%和20%聚丙烯酰胺凝胶分离蛋白质样品,湿转法将分离胶的蛋白转移至PVDF 膜上,随后分别加入抗β-actin(1∶1 000)、TNF-α(1∶1 000)、iNOS(1∶1 000)和Arg-1(1∶1 000)抗体4 ℃孵育过夜,第2 天用Cy3 山羊抗兔二抗室温孵育1 h,应用超敏曝光液在凝胶成像仪上形成可视化条带,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参对条带标准化后对照组相比进行均一化处理,检测累积光密度值(integrated optical density,IOD)并进行TNF-α、iNOS 和Arg-1 表达水平的比较。
1.2.4 巨噬细胞吞噬红细胞实验 取脱纤维绵羊红细胞2 μL 分别与极化后的M1 型或M2 型巨噬细胞共培养48 h 后取细胞悬液滴加于玻片上,制备薄血膜片,待玻片充分干燥,滴加瑞吉染液及缓冲液,染色25 min,无菌水冲洗,自然晾干后置于光学显微镜下观察,分别计数1 000 个巨噬细胞,记录吞噬红细胞的巨噬细胞数量,并采集图像。
1.2.5 铁染色实验 取铁剂3 μL 分别与极化的M1 型或M2 型巨噬细胞共培养48 h 后取细胞悬液滴加在玻片上,制备薄血膜,充分干燥后滴加亚铁氰化钾与稀释盐酸溶液(5∶1)混合液,染色25 min,无菌水冲洗,加入稀释中性红溶液复染10 min,无菌水冲洗,待干燥后置于光学显微镜下观察不同极化亚型细胞胞质中吞噬铁颗粒差异,并采集图像。铁颗粒细小、分布稀疏为(±),颗粒约占细胞质1/4 为(+),占细胞质1/4 至1/2 为(++),占细胞质1/2 至3/4 为(+++),布满整个细胞质为(++++)。
1.2.6 铁蛋白含量测定 极化的巨噬细胞加入铁剂共培养,根据说明书采用ELISA 法检测不同极化亚型巨噬细胞内及细胞培养液中铁蛋白含量,并使用酶标仪在450 nm 处测量吸光度(A)。将A值传输到软件GraphPad Prism 中,并使用拟合5 个参数的标准曲线计算样品中铁蛋白含量。
1.3 统计学处理 采用GraphPad Prism 8.0 统计软件。计量资料两组间比较采用两独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 LPS 及IL-4 处理后巨噬细胞的形态学变化 未处理的巨噬细胞胞体规则呈圆形,核染色质细致;LPS处理后巨噬细胞其胞体明显增大且不规则,细胞质突起易见,胞质量丰富可见空泡,核染色质偏粗,偶见多核;IL-4 处理后巨噬细胞其胞体偏大,胞质量偏多,胞质可见少量突起,核染色质偏细致;见图1(插页)。
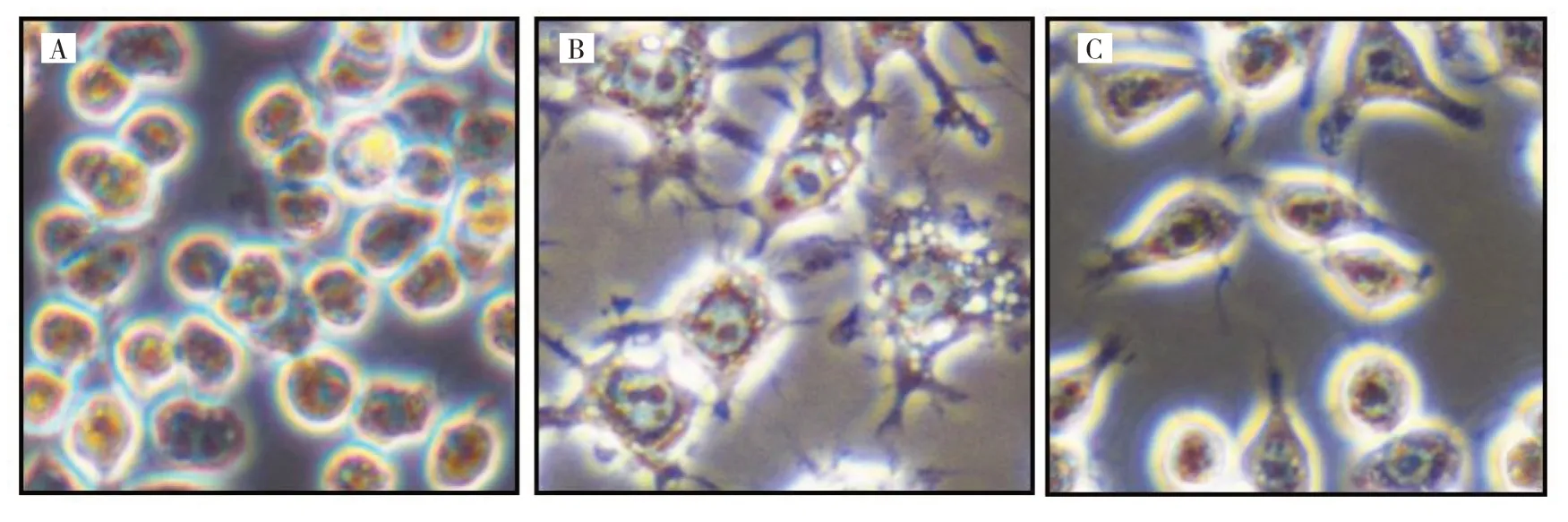
图1 LPS 及IL-4 处理后巨噬细胞的形态特点(A:未处理的巨噬细胞;B:LPS 处理后的巨噬细胞;C:IL-4 处理后的巨噬细胞)
2.2 LPS 及IL-4 处理后巨噬细胞TNF-α 和Arg-1 的表达情况 结果显示,LPS 处理后巨噬细胞表达M1型标志物TNF-α 明显增加,IL-4 处理后巨噬细胞未见明显变化,相反表达了M2 型标志物Arg-1 增加,见图2(插页)。
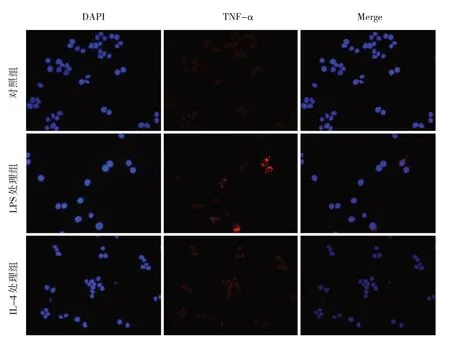
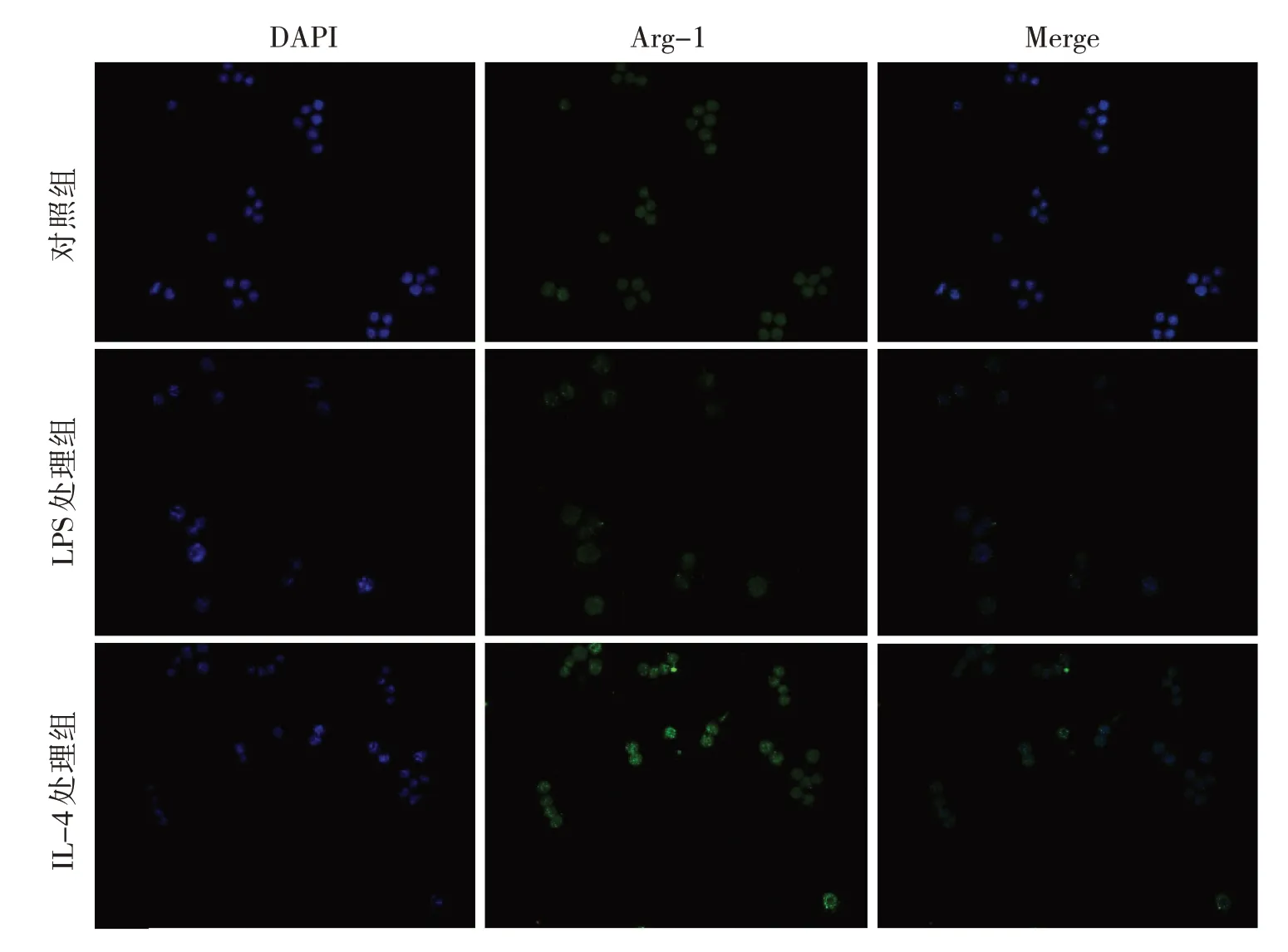
图2 LPS 及IL-4 处理后巨噬细胞TNF-α 及Arg-1 表达差异的免疫荧光染色图
2.3 LPS 及IL-4 处理后巨噬细胞TNF-α、iNOS 和Arg-1 表达水平的比较 Western blot 结果显示,LPS 较IL-4处理的巨噬细胞表达M1 型标志物TNF-α 及iNOS 显著增加(均P<0.05),而IL-4 较LPS 处理的巨噬细胞表达M2型标志物Arg-1显著增加(P<0.01),见图3。
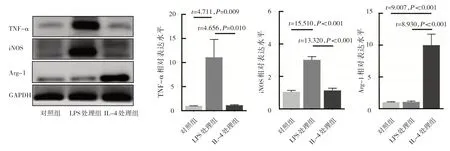
图3 LPS及IL-4处理后巨噬细胞TNF-α、iNOS和Arg-1表达的电泳图及表达水平比较
2.4 M1 型与M2 型巨噬细胞对红细胞的吞噬作用差异 LPS 处理M1 型巨噬细胞和IL-4 诱导的M2 型巨噬细胞与绵羊红细胞共培养,经瑞氏染色镜检观察,发现两者吞噬红细胞存在差异,M1 型巨噬细胞可见吞噬红细胞(计数1 000 个巨噬细胞可见3 个吞噬红细胞),而M2 型巨噬细胞未见吞噬红细胞(计数1 000 个巨噬细胞未见吞噬血细胞),见图4(插页)。
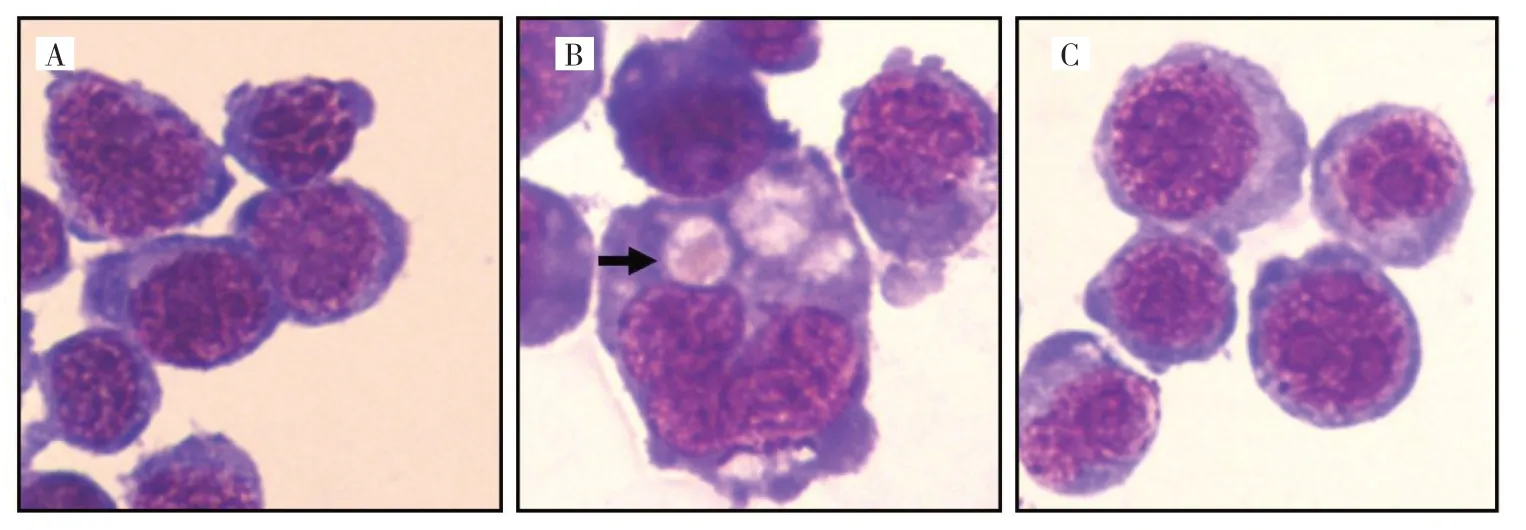
图4 LPS 及IL-4 诱导不同极化亚型巨噬细胞吞噬红细胞差异效果图[A、C:未处理的巨噬细胞及IL-4 诱导的M2 型巨噬细胞未见吞噬红细胞细胞;B:LPS 诱导的M1 型巨噬细胞可见吞噬红细胞(箭头所示)]
2.5 M1 型与M2 型巨噬细胞对铁的摄入差异 经铁染色镜检观察,未处理巨噬细胞铁染色阳性程度(±);M1 型巨噬细胞吞噬蓝色铁颗粒明显增多,铁染色阳性程度为(++)至(+++),明显高于M2 型巨噬细胞铁染色阳性程度(+),说明M1 型巨噬细胞铁摄入高于M2 型巨噬细胞,表现出固铁优势,见图5(插页)。
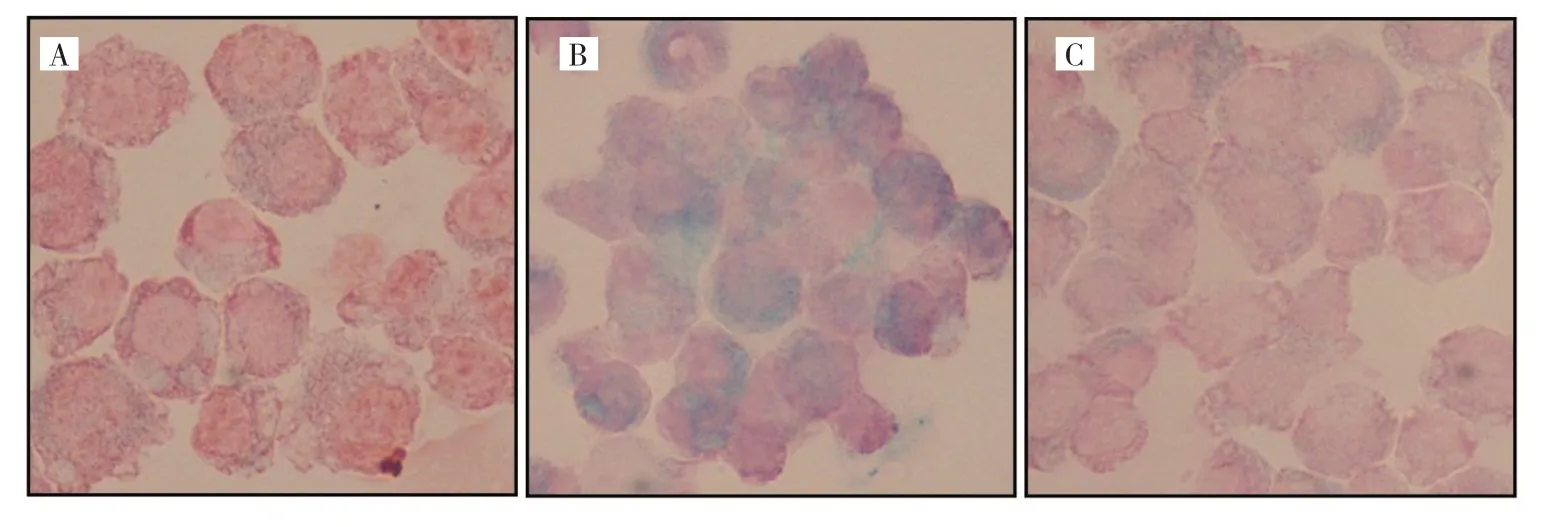
图5 LPS 及IL-4 处理后不同极化亚型巨噬细胞对铁摄入差异效果图(A:未处理巨噬细胞铁染色阳性程度;B:LPS 处理后M1 型巨噬细胞铁染色阳性程度;C:IL-4 处理后M2 型巨噬细胞铁染色阳性程度)
2.6 M1 型与M2 型巨噬细胞胞内及细胞培养液铁蛋白含量的比较 结果发现,M1 型巨噬细胞铁蛋白含量明显高于M2 型巨噬细胞,差异有统计学意义(P<0.05)。同时细胞培养液铁蛋白含量低于M2 型(P<0.05),进一步证实M1 型巨噬细胞的合成储存铁增加,表现出固铁优势,见图6。

图6 LPS 及IL-4 处理后不同极化亚型巨噬细胞细胞内及培养液中铁蛋白含量的比较
3 讨论
巨噬细胞是机体重要的免疫细胞,在不同微环境的刺激下可以形成不同极化亚型,不同极化亚型巨噬细胞在功能上存在异质性,M1 型巨噬细胞主要表现为促进炎症反应并清除病原体作用,M2 型巨噬细胞表现为抑制炎症反应并组织修复作用[5-6]。研究发现,LPS及IL-4 分别诱导小鼠巨噬细胞RAW264.7 在形态上可见明显差异,LPS 诱导的巨噬细胞胞体明显增大且不规则,细胞质突起易见,胞质量丰富可见空泡,核染色质偏粗,偶见多核;IL-4 诱导的巨噬细胞其胞体偏大,胞质量偏多,胞质可见少量突起,核染色质偏细致。LPS 较IL-4 诱导的巨噬细胞表现更突出的多形性。同时LPS 诱导的巨噬细胞表达M1 型标志物炎症因子TNF-α 及促进氧和氮自由基生成的酶iNOS 显著增高,相反,IL-4 诱导巨噬细胞Arg-1 表达增加,两组比较差异均有统计学意义,实验成功利用LPS 及IL-4 诱导巨噬细胞极化为M1 型及M2 型。
铁是机体必须营养物质,是细胞多种生理过程的重要辅助因子。而巨噬细胞在机体铁代谢的调节过程中起到非常重要的作用。一方面巨噬细胞可以通过吞噬衰老红细胞,回收红细胞内的铁影响铁的吸收,另一方面通过调控胞内铁的可用性影响铁的储存和释放[7-8]。但是不同亚型巨噬细胞在铁代谢过程中表现明显不同,实验中发现,通过红细胞和铁剂共培养观察,LPS 诱导的M1 型巨噬细胞可见吞噬红细胞并且胞内着色铁颗粒明显增多,而M2 型巨噬细胞未见吞噬红细胞且胞内铁颗粒较少,显示了LPS 诱导的M1型巨噬细胞较IL-4 诱导M2 型对铁的摄入增加。笔者还发现LPS 诱导极化的M1 型巨噬细胞胞内铁蛋白含量明显高于IL-4 诱导极化的M2 型巨噬细胞,差异有统计学意义,证实了LPS 诱导极化的M1 型巨噬细胞对铁储存增加,而M2 型并未见明显增加。说明不同极化亚型巨噬细胞在铁代谢过程中存在明显差异,即M1亚型巨噬细胞对铁摄入和储存明显增加,与M2 型巨噬细胞相比有明显固铁优势,与国内相关学者研究相符[9]。在炎症性疾病中,铁在网状内皮系统中的滞留是机体铁稳态对炎症的主要反应,被认为是宿主阻止入侵病原体的重要作用[10]。但是同时这也限制了红系祖细胞的铁供应,并可能导致炎症相关贫血的常见情况[11-13]。早期的实验中发现,大鼠肾组织炎症损伤和修复过程中,M1 型巨噬细胞可以诱导早期损伤,而M2型巨噬细胞参与损伤后的纤维修复[14],极化的M1 型巨噬细胞对铁吸收和滞留明显增加,铁的积累导致M1型巨噬细胞的进一步极化,继续诱导活性氧及一氧化氮的合成,并释放各种炎症因子,造成组织炎症损伤加重,难于修复[15]。由此可见,调控不同极化亚型巨噬细胞的铁代谢,有望成为治疗慢性炎症性疾病等重要切入点,也是后续研究的重点。
综上所述,本研究从形态改变及免疫方法等多种方式,利用LPS 及IL-4 成功的诱导巨噬细胞极化为不同亚型,且不同亚型的巨噬细胞对铁代谢表现不同,LPS 诱导的M1 型巨噬细胞较IL-4 诱导M2 型巨噬细胞有明显固铁优势。而导致极化巨噬细胞胞内和胞外铁的有效性及其微环境的差异可以直接影响相邻组织细胞增殖、分化甚至损伤等,所以明确不同极化亚型巨噬细胞对铁代谢差异性调节,可为了解其在病理生理条件下的作用提供了理论依据,为临床应用提供新的治疗策略。

