miR-155敲除小鼠乳腺癌肺转移模型的外周免疫细胞分型分析
孙晓东 谢丽霞 杜凯丽 许倩倩 桑明
(湖北医药学院附属襄阳市第一人民医院转化医学中心,襄阳 441000)
微小RNA(microRNA,miRNA)是内源性非编码单链RNA,其编码基因通常位于结构基因之间或内含子区域,成熟的miRNA长约22 nt。它们在细胞生长发育、免疫反应、肿瘤生长等生理、病理过程及疾病治疗中发挥重要作用[1-2]。人miR-155基因定位于第21号染色体,是一个古老的免疫系统调节因子,同物种中的序列保守性较强,被普遍认为参与机体造血细胞和免疫细胞的发育分化、炎症反应、免疫应答、肌肉发育及脂肪分化等生物过程[3-5]。既往研究证实,miR-155对于维持机体正常的免疫功能必不可少[6]。已有研究证实,miR-155在乳腺癌中是上调最明显的miRNA之一,普遍认为其是一种促进肿瘤生长、血管生成和侵袭转移的致癌miRNA[7-9]。大量研究提示miR-155表达水平与多种实体肿瘤的预后相关,亦可用于肿瘤诊断[8-13]。说明miR-155对免疫细胞和肿瘤细胞的调控作用不一致。那么,机体的miR-155表达水平对肿瘤免疫监视及肿瘤转移微环境的形成发挥何种作用?本研究利用miR-155基因敲除(miR155-/-)小鼠构建乳腺癌肺转移模型,从外周血免疫分型方面比较miR155-/-小鼠与野生型(wide-type,WT)小鼠存在的差异,旨在为肿瘤免疫相关研究提供基础数据。
1 材料与方法
1.1 材料
1.1.1 实验动物与细胞 雌性C57BL/6J小鼠,6周龄,体质量18~20 g,购自湖南斯莱克景达实验动物有限公司[SCXK(湘)2019-0004];B6.Cg-Mir155tm1Rsky/J(miR155-/-)小鼠(The Jackson Laboratory,Stock No.007745)由湖北医药学院李平飞博士惠赠。小鼠饲养于20~22 ℃、相对湿度50%~60%的无特定病原体(specific-pathogen free,SPF)饲养间[SCXK(鄂)2017-0093],随意喂食标准鼠粮和净化灭菌水。按实验动物使用的3R原则给予人道关怀,所有动物实验均通过湖北医药学院动物伦理委员会审批(XYYYE20210007)。小鼠乳腺癌细胞系E0771购自湖南丰汇生物科技有限公司。
1.1.2 试剂与仪器 细胞培养及研究所用的DMEM(11965-092)、胰酶(25300054)购自Gibco公司(美国);二甲基亚砜(DMSO,D2650)购自Sigma-Aldrich公司(美国);鼠尾直接PCR试剂盒(快速基因型鉴定,B40015)购自Bimake公司(上海);流式检测抗体(FITC-B220/CD4/Gr-1、PE-CD49b/CD8/CD11b、Percp·CY5.5-CD3、PE·CY7-Ly-6C/CD25、APC-Ly-6G/FOXP3、APC·CY7-CD45)均购自BD公司(BD,Franklin Lakes,USA);BD FACSAria Ⅱ流式细胞仪购自BD公司(美国)。
1.2 方法
1.2.1 公共数据库生物信息学分析 利用Cancer-MIRNome数据库(http://bioinfo.jialab-ucr.org/CancerMIRNome/#tab-1929-4)比较miR-155在乳腺癌组织、外周循环中的表达差异,进行ROS曲线、Kaplan Meier生存分析。利用miRactDB数据库(https://ccsm.uth.edu/miRactDB)对miR-155在不同病理级别乳腺癌组织中的表达进行分析。
1.2.2 快速基因型鉴定 按照鼠尾直接PCR试剂盒提取小鼠DNA。剪取小鼠尾尖0.3~0.5 cm,每个样本加入100 μl新鲜组织消化液,55 ℃消化15 min,每5 min振荡混匀1次。95 ℃孵育5 min灭活消化液中的蛋白酶。12 000 r/min离心5 min,取上清作为PCR模板。引物由金凯瑞生物科技有限公司合成(武汉),引物序列如下:miR-155-WT F-5'-AATCATTCCTGAGGGCTACC-3';miR-155-Mut F-5'-GCCTGAAGAACGAGATCAGC-3';Common:5'-GGAAACGTGGGTCTCCTTAC-3'。PCR反应体系为20 μl:2×M-PCR OPTITM Mix 10.0 μl,正反向引物各0.5 μl,模板DNA 1.0 μl,ddH2O 8.0 μl;采用降落PCR程序(表1)。PCR产物进行琼脂糖凝胶电泳,使用Bio-Rad凝胶分析系统拍照观察。

表1 降落PCR程序Tab.1 Procedure of touchdown PCR
1.2.3 动物分组及干预 取WT和miR155-/-小鼠各10只,其中各5只用于制备乳腺癌肺转移模型后进行外周免疫细胞检测,另外各5只用于直接进行外周免疫细胞检测。
1.2.4 细胞培养 E0771细胞置于添加10%胎牛血清的高糖DMEM培养液中,在37 ℃、5%CO2培养箱中培养。消化对数增长期细胞用于后续实验。
1.2.5 小鼠乳腺癌肺转移模型 取6周龄左右的WT和miR155-/-小鼠各5只,每只小鼠尾静脉注射1×105个/200 μl E0771细胞,2个月后,记录体质量,0.5%戊巴比妥钠腹腔注射麻醉(50 mg/kg),心脏采血(EDTA-K3抗凝)后,脱颈处死小鼠,取小鼠肺部称重并计算脏器指数,置于4%多聚甲醛固定、石蜡包理,5 μm连续切片。HE染色检测后进行全片扫描。
1.2.6 外周血淋巴细胞亚群检测 对EDTA抗凝小鼠外周血进行多色抗小鼠单克隆抗体试剂和匹配的同型对照进行染色,80 μl/管,第1管加入FITCB220、PE-CD49b、Percp·CY5.5-CD3、PE·CY7-Ly-6C、APC-Ly-6G、APC·CY7-CD45;第2管加入FITC-CD4、PE-CD8、Percp·CY5.5-CD3、PE·CY7-CD25、APCFOXP3、APC·CY7-CD45;第3管加入FITC-Gr-1、PECD11b、PE·CY7-Ly-6C、APC-Ly-6G、APC·CY7-CD45,于室温避光孵育30 min,裂解红细胞后用PBS洗涤,使用BD流式细胞仪检测,并应用FlowJo软件进行分析。主要检测B淋巴细胞(B220+)、T淋巴细胞(CD3e+)、辅助T(Th)细胞(CD4+)、细胞毒T(Tc)细胞(CD8a+)、自然杀伤(NK)细胞(CD49b+)、单核细胞(Ly-6C)、中性粒细胞(Ly-6G)、调节性T(Treg)细胞(CD25+/FOXP3+)、髓源性抑制细胞(MDSCs)(Gr1+/CD11b+)及MDSCs中的单核细胞亚群(M-MDSCs)(Ly-6C)和粒细胞亚群(G-MDSCs)(Ly-6G)。
1.3 统计学处理 计量资料数据用±s表示,组间差异比较采用t检验,差异显著性水平设为α=0.05,应用SPSS24.0统计软件进行数据的统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 公共数据库中miR-155的表达与乳腺癌预后的关系 对TCGA数据库中已有测序数据进行分析,发现miR-155在乳腺癌组织中相对高表达(P<0.000 1,图1A);ROC曲线下面积(AUC)为0.84(图1B);Kaplan Meier生存分析显示miR-155的预后价值差异无统计学意义(图1C),表明miR-155在乳腺癌组织中高表达,但与预后无明显相关性。通过GSE73002数据集分析在外周循环中miR-155的水平与乳腺癌是否有相关性[14],miR-155在乳腺癌及良性乳腺疾病患者外周血清中的含量与正常对照相比均有所升高,但差异无统计学意义(图1D);前瞻性研究GSE44281数据集的分析结果显示miR-155不能作为乳腺癌的预测分子(图1E)[15];对miRactDB数据库中不同病理分期乳腺癌组织中miR-155的表达水平进行分析,结果显示miR-155在所有级别的乳腺癌中均高表达(P<0.000 1,图1F)。
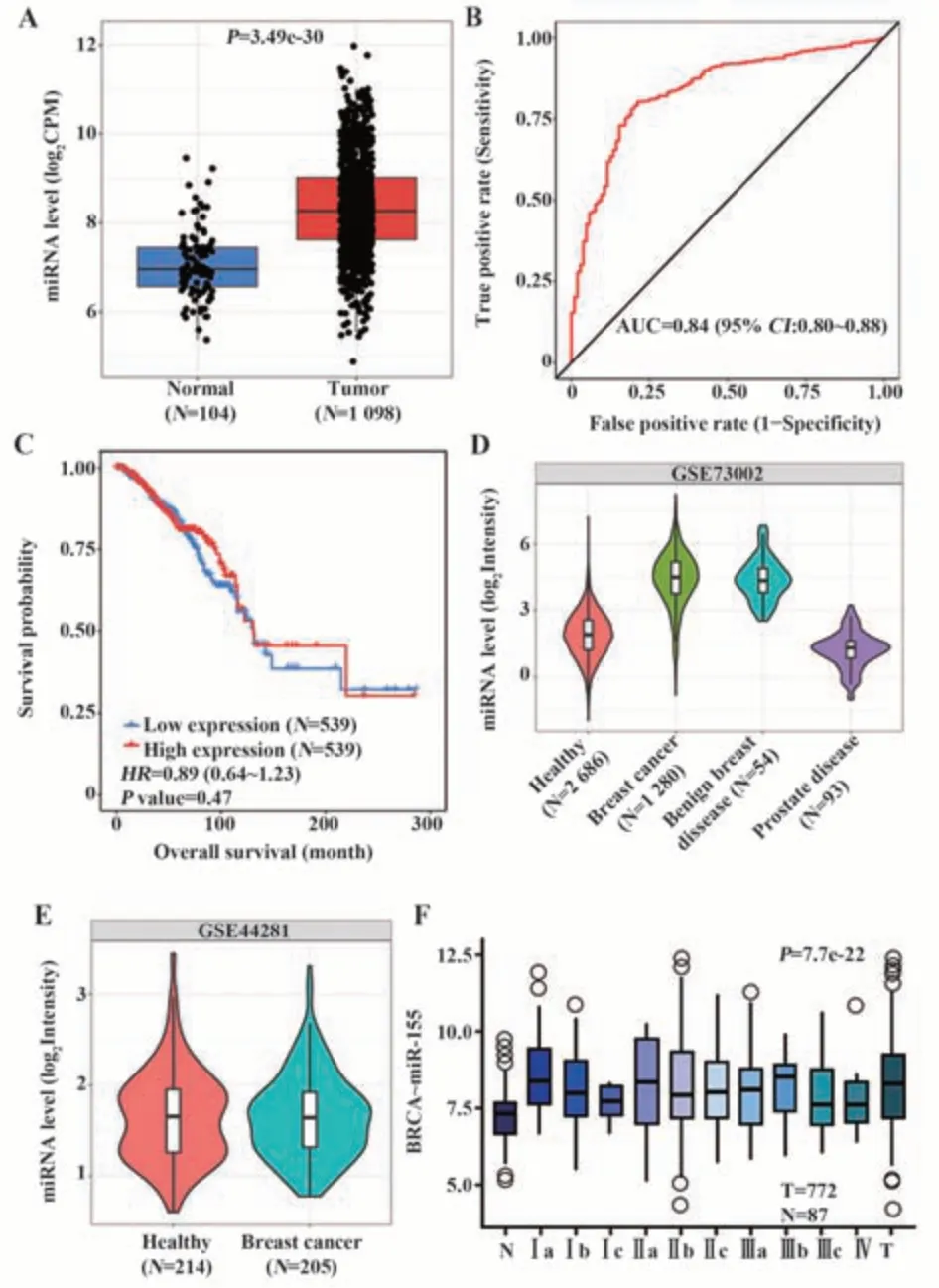
图1 hsa-miR-155在乳腺癌组织及循环中的表达水平及其与预后的关系Fig.1 Expression level of hsa-miR-155 in breast cancer tissues and its relationship with prognosis
2.2 小鼠基因型鉴定正确 B6.Cg-Mir155tm1Rsky/J小鼠是C57背景的转基因小鼠,因此本实验中以C57BL/6J为WT对照。根据WT小鼠DNA的PCR产物大小为165 bp,miR155-/-PCR产物大小为226 bp,miR155-/+PCR产物大小为165 bp和226 bp[16],结果如图2所示,除5号和9号小鼠为杂合子,其余小鼠均为纯合子,说明本实验使用的miR-155基因敲除小鼠的基因型是正确的。

图2 小鼠miR-155 PCR产物电泳图Fig.2 Electrophoresis of PCR products of miR-155 in mice
2.3 miR-155基因敲除对小鼠乳腺癌肺转移模型建立的影响 从脏器系数结果比较发现,尾静脉注射E0771细胞2个月后,WT小鼠和miR155-/-小鼠肺组织外观无明显肉眼可见的转移灶(图3A),肺重量差异无统计学意义(图3B);HE病理切片结果显示,尾静脉注射1×105个E0771细胞2个月时,WT小鼠仅有1只肺部成瘤,其余小鼠肺部有炎症浸润现象;所有miR155-/-小鼠肺部均能观察到较小的转移灶,且充血和炎症浸润情况更明显。典型对比图如图3C所示。

图3 小鼠乳腺癌肺转移模型病理结果Fig.3 Pathological results of mouse model of lung metastasis of breast cancer
2.4 miR-155基因敲除对小鼠外周血免疫分型的影响 流式图分析外周血免疫细胞分型的圈门策略如图4A、图5A、图6A所示。淋巴细胞分型结果如图4B所示,相对于WT型小鼠,miR155-/-小鼠T淋巴细胞百分比显著降低[WT:(21.76±3.17)%,miR155-/-:(11.86±2.09)%,P<0.05];B淋巴细胞、NK细胞、中性粒细胞百分比差异均无统计学意义;单核细胞百分比显著降低[WT:(21.76±3.17)%,miR155-/-:(11.86±2.09)%,P<0.05]。T细胞分型结果如图5B所示,相对于WT型小鼠,miR155-/-小鼠Th细胞占T淋巴细胞亚群的百分比明显降低[WT:(49.84±4.26)%,miR155-/-:(26.74±4.29)%,P<0.05],Tc细胞占T淋巴细胞亚群的百分比亦明显降低[WT:(17.12±3.43)%,miR155-/-:(11.78±1.98)%,P<0.05];Treg细胞占Th的百分比差异无统计学意义。MDSC细胞分型结果如图6B所示,MDSCs百分比显著升高[WT:(6.27±1.84)%,miR155-/-:(11.05±1.17)%,P<0.01];MDSCs中M-MDSCs占比显著降低[WT:(19.28±5.11)%,miR155-/-:(12.76±3.55)%,P<0.05];MDSCs中G-MDSCs占比显著升高[WT:(46.40±8.23)%,miR155-/-:(66.84±5.89)%,P<0.05]。
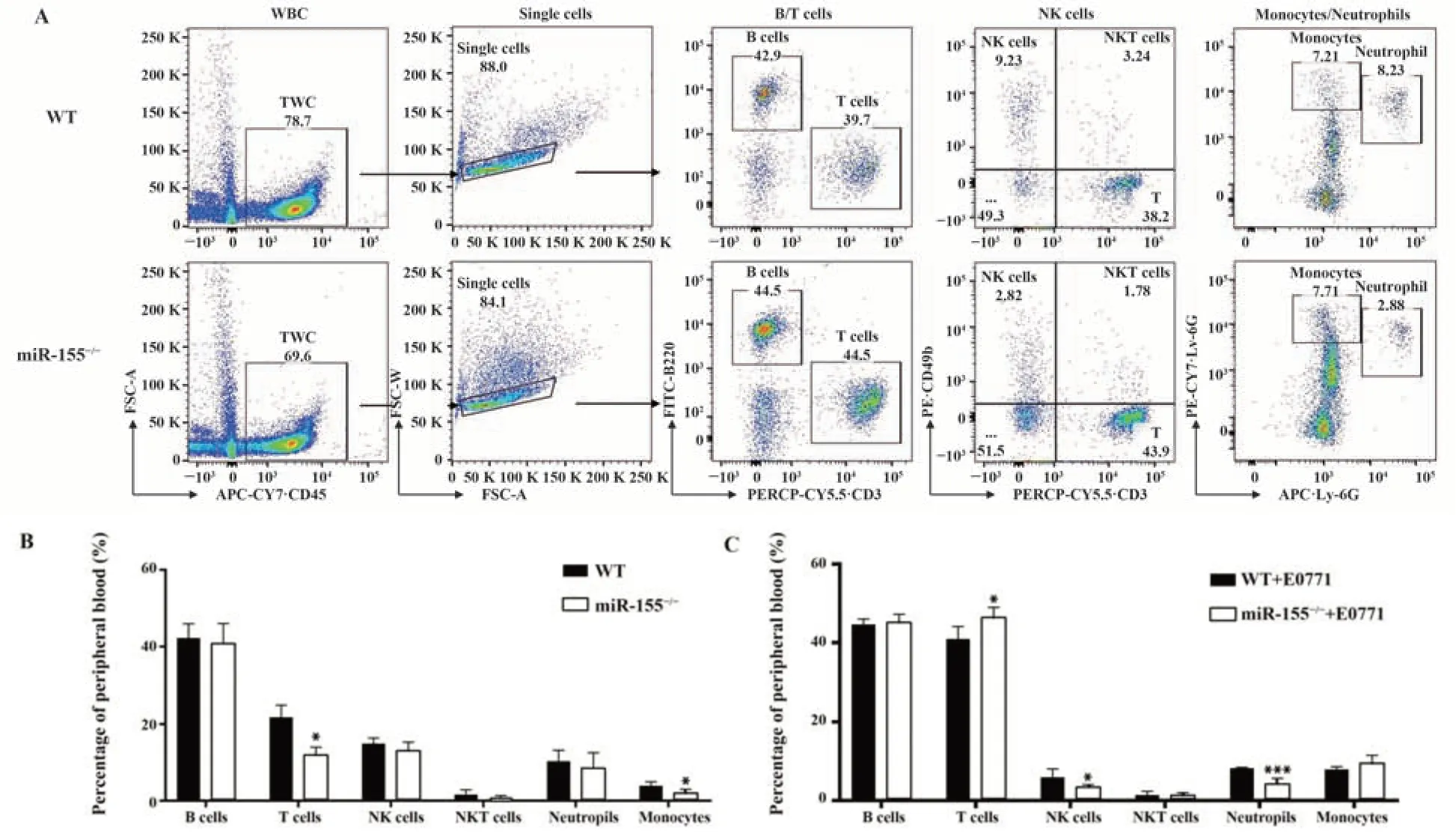
图4 野生型小鼠和miR155-/-小鼠外周免疫细胞分型分析Fig.4 Analysis of peripheral blood immune cell typing between miR155-/- and WT mice
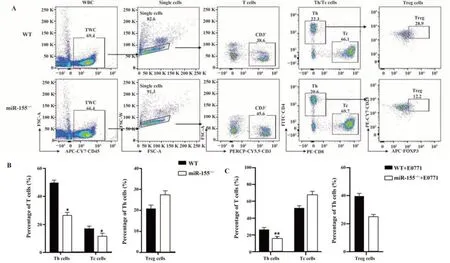
图5 野生型小鼠和miR155-/-小鼠外周T淋巴细胞分型分析Fig.5 Comparison of peripheral T lymphocytes typing between miR155-/- and WT mice

图6 野生型小鼠和miR155-/-小鼠外周MDSCs细胞分型分析Fig.6 Analysis of peripheral MDSCs typing between miR155-/- and WT mice
2.5 miR-155基因敲除对小鼠乳腺癌肺转移模型外周免疫细胞分型的影响 小鼠乳腺癌肺转移模型的淋巴细胞分型结果如图4C所示,相对于WT小鼠,miR155-/-小鼠B淋巴细胞和单核细胞的百分比均无明显差异;T淋巴细胞的百分比明显升高[WT:(40.94±3.18)%,miR155-/-:(46.36±2.59)%,P<
0.05];NK细胞百分比显著降低[WT:(5.936±2.14)%,miR155-/-:(3.956±1.57)%,P<0.05];中性粒细胞百分比显著降低[WT:(8.254±0.23)%,miR155-/-:(4.16±1.53)%,P<0.001];小鼠乳腺癌肺转移模型的T淋巴细胞分型结果如图5C所示,相对于WT小鼠,miR155-/-小鼠Th细胞占T淋巴细胞亚群的百分比明显降低[WT:(25.672±3.31)%,miR155-/-:(14.99±3.19)%,P<0.01],Tc细胞占T淋巴细胞亚群的百分比无显著差异,Treg细胞占Th的百分比无显著变化。小鼠乳腺癌肺转移模型的MDSCs分型结果如图6C所示,相较于WT小鼠,miR155-/-小鼠MDSCs百分比显著升高[WT:(6.27±1.84)%,miR155-/-:(11.05±1.17)%,P<0.01];MDSCs中M-MDSCs占比显著降低[WT:(17.16±3.11)%,miR155-/-:(7.61±3.77)%,P<0.01],而GMDSCs占比显著升高[WT:(74.04±3.08)%,miR155-/-:(87.78±7.52)%,P<0.01]。
3 讨论
近年来,大量研究表明miR-155在机体免疫调节中发挥重要作用,miR-155在激活的免疫细胞中高表达,是自身免疫病发生发展的关键分子[3,6,17]。RODRIGUEZ等[3]发现,miR155-/-小鼠的T淋巴细胞、B淋巴细胞及树突状细胞的功能都遭到破坏,说明miR-155对于维持机体正常的免疫功能必不可少。本文通过生物信息学方法分析TCGA和mi-RactDB数据库中乳腺癌miRNA芯片及测序数据,发现miR-155在乳腺癌组织及不同病理级别的乳腺癌组织中的表达均显著升高,但预后分析及血清中miR-155的水平无显著差异[15-16]。提示miR-155在实体肿瘤与免疫系统中可能发挥不同作用。T淋巴细胞是机体抵御肿瘤形成的主要成员,其中Th细胞可识别肿瘤细胞表面的抗原肽,进而激活其他具有抗肿瘤功能的免疫细胞,Th细胞和Tc细胞的不足是肿瘤免疫逃逸的重要原因[18-20]。MDSCs是未成熟骨髓细胞的异质群体,包含M-MDSC和G-MDSC两个亚群,都显示出免疫抑制效应,并通过多种机制参与肿瘤转移前微环境的形成[21-25]。实验结果显示,miR155-/-小鼠外周T淋巴细胞、单核细胞和MDSCs占外周血白细胞的比例显著低于WT小鼠;T细胞中Th细胞和Tc细胞的占比均显著低于WT小鼠,MDSCs中M-MDSC显著低于WT小鼠,G-MDSC显著高于WT小鼠。说明miR-155基因缺失使小鼠外周血中与肿瘤细胞识别和杀伤相关的免疫细胞减少,而与肿瘤免疫抑制相关的细胞增多。
包括乳腺癌在内的众多肿瘤类型中,转移是造成患者死亡的主要诱因,90%的肿瘤患者死亡是癌细胞转移所致[26]。恶性细胞转移是一个早期的过程,大多数转移的细胞在循环中被清除或在包括骨髓在内的远处器官中保持休眠,极少数细胞最终发展为转移灶[27]。在尾静脉注射少量小鼠乳腺癌细胞制造肺转移模型后,miR155-/-小鼠外周T细胞较荷瘤的WT小鼠显著升高,这可能与乳腺癌细胞进入机体后引起的免疫反应有关,但Th细胞和NK细胞的占比相对荷瘤的WT小鼠显著降低。NK细胞是一类无需预先致敏就能非特异性杀伤肿瘤细胞的淋巴细胞[28]。这一结果提示miR155-/-小鼠由于免疫系统的失调不能及时识别并清除肿瘤细胞,使循环中的肿瘤细胞容易发生转移。有文献报道,MMDSCs通过诱导上皮-间质转化和促进肿瘤干细胞表型的增强促进肿瘤细胞从原发部位扩散;而肺组织中G-MDSCs表现出促进细胞增殖的现象[21]。MMDSC占比升高与不良预后相关,是肿瘤免疫逃逸的参与者[29];循环和肿瘤G-MDSCs在不同的肿瘤类型中呈现升高状态[30]。在本实验中,与WT小鼠比较,miR155-/-小鼠外周血中G-MDSC占比显著升高(P<0.05);在乳腺癌肺转移模型中,这一差异更为显著(P<0.01)。提示miR-155可能参与调控MDSCs的分化,miR-155基因的缺失导致MDSCs增加,促进了肿瘤转移微环境形成,特别是G-MDSC亚群的显著增加可能促进了乳腺癌肺转移的发生。
综上所述,miR-155对于正常的免疫系统发育和维持至关重要,在肿瘤免疫监视过程中亦发挥重要作用,miR-155缺失会导致机体免疫功能紊乱,失去肿瘤免疫监视机制,同时G-MDSCs比例的增高为肿瘤的肺转移提供了有利条件。本研究的局限在于实验动物的生物学重复较少,实体肿瘤中miR-155的高表达与机体免疫反应及肿瘤转移之间的关系仍需深入研究。

