嗜热毛壳菌端粒酶的表达纯化及酶学特性分析
尹虎 宋泽玉 奚绪光

摘 要 为进一步探究端粒酶的酶学特性,以嗜热毛壳菌(Chaetomium thermophilum, Thermo)端粒酶为研究对象,通过生物化学、生物信息学等方法得到4种不同长度的Thermo端粒酶蛋白,分别与体外转录得到的Thermo端粒酶RNA进行组装。通过端粒酶体外延伸试验检测组装体的反转录活性,进一步分析影响其反转录活性的各种因素。结果表明,4种不同长度的Thermo端粒酶蛋白重组质粒经大肠杆菌表达系统诱导表达后均可得到相应的Thermo端粒酶蛋白,且纯度均在90%以上;体外孵育试验表明,在10 mmol/L HEPES-KOH(pH 8.0)、1 mmol/L MgCl2、100 mmol/L NaCl、3 mmol/L KCl、体积分数25% Glycerol、10 units/μL Rnasin的条件下,端粒酶蛋白与RNA的摩尔浓度比达到1∶1及以上时,两者能有效复合;端粒酶体外延伸试验发现,结构完整的Thermo端粒酶组装体具有很强的反转录活性,可使18nt-DNA引物反复延伸。TEN结构域不完整并未减弱Thermo端粒酶组装体的反转录活性,说明其在反转录过程中未发挥显著作用。 T-PK区或TWJ区缺失的组装体均不能使18nt-DNA引物发生延伸,表明RNA结构的完整性是端粒酶发挥反转录功能的必要条件。
关键词 Thermo端粒酶;蛋白表达纯化;RNA体外转录;反转录活性
真核生物染色体存在末端保护与末端复制问题[1],随着DNA复制次数的迭加,染色体末端长度会不断缩短[2]。为了保护染色体末端不受细胞内核酸酶的降解,同时避免不同的染色体末端发生相互融合,真核生物细胞内存在一种特殊的结构——端粒。端粒由端粒DNA和多种端粒结合蛋白组成[3],正常的细胞复制过程会导致端粒长度不断缩短,当其缩短至某一临界值时会引发细胞衰老,这种现象称之为复制性衰老[4],并不会对机体造成损伤。但是当端粒长度异常缩短时,则会导致多种疾病的发生,例如早衰、再生障碍性贫血[5]、先天性角化不良[6]、特发性肺纤维化[7]等,这些疾病统称为“短端粒综合征”[8]。除此之外,端粒的异常延伸也会造成严重的后果,如导致肿瘤或癌症的发生。因此,端粒的长度必须受到严格的调控。
端粒酶是真核生物细胞中负责维持端粒长度稳定的酶,它由端粒酶逆转录酶(TERT)和端粒酶RNA(TER)两部分组成,主要功能是以其自身携带的RNA为模板,通过反转录的方式延伸端粒DNA,以维持端粒长度的稳定[9]。最新研究表明,在紫外线照射、毒性重金属污染、氧化应激等不利因素的影响下,端粒酶活性会降低甚至完全丧失,进而引发多种致死性疾病[10],如癌症、动脉粥样硬化、慢性肾脏疾病、范科尼贫血等[11-14]。
由于端粒酶具有多种重要的生理功能,越来越多的科研工作者聚焦于端粒酶的研究[15],近些年也取得了丰硕的成果,成功解析了四膜虫、赤拟谷盗、假丝酵母等多种生物的端粒酶晶体结构[16-21]。但是目前关于端粒酶的探索仍处于起步阶段,端粒酶的纯化方式仍然非常繁琐、成本极高[22],大大增加了端粒酶空间结构解析的难度。除此之外,关于端粒酶的酶学特性及活性的影响因素也鲜有报道,使得探索端粒酶工作机制的研究进程十分缓慢。2011年,Amlacher等[23]公布了嗜热毛壳菌的基因组,这种真菌在60 ℃的高温条件下仍可存活,其具有的极高热稳定性可为端粒酶的表达纯化提供便利,但近些年来几乎没有任何关于嗜热毛壳菌端粒酶的报道。鉴于此,本研究以嗜热毛壳菌(Chaetomium thermophilum, Thermo)端粒酶为研究对象,通过大肠杆菌(E coli.)原核表达系统得到高纯度的Thermo端粒酶蛋白,并将其与体外转录得到的Thermo端粒酶RNA进行组装,深入研究了Thermo端粒酶的酶学特性及其活性的影响因素,为端粒酶纯化提供了新的技术路线,为端粒酶酶学特性的深入研究及后续的晶体结构解析奠定基础。
1 材料与方法
1.1 材 料
1.1.1 质粒、载体及菌种 Thermo端粒酶蛋白编码的基因序列(载体pUC-57-ThermoFL),由General Biosystems公司合成;表达载体pET-21a与pET-15b-sumo、大肠杆菌菌株C2566H均由西北农林科技大学生命科学学院奚绪光教授实验室保存。
1.1.2 试剂及仪器 限制性内切酶NdeⅠ、 SalⅠ、EcoRⅠ、XhoⅠ购自Takara公司;T4 DNA连接酶、PageRulerTM Prestained Protein Ladder均購自Thermo Scientific公司;其余试剂均为进口或国产分析纯;梯度基因扩增仪(PCR仪)购自美国ABI公司;凝胶成像分析系统购自美国UVP公司;叠放式低温摇床购自瑞士 INFORS HT公司;紫外分光光度计购自北京普析通用公司;Avanti J-26XPI落地式离心机购自BECKMAN公司;超声波破碎仪购自江南仪器厂;低温高压细胞破碎仪购自聚能生物公司;AKTA prime蛋白纯化系统购自GE Healthcare公司。
1.2 方法
1.2.1 Thermo端粒酶蛋白的生物信息学分析 使用PSI-PRED工具(http://bioinf.cs.ucl.ac.uk/psipred/)进行Thermo端粒酶的二级结构预测与序列无序性分析;使用Swiss-Model工具[SWISS-MODEL (expasy.org)]进行Thermo端粒酶结构预测,将Thermo端粒酶的氨基酸序列导入并进行同源建模,选择最适模型下载。
1.2.2 Thermo端粒酶蛋白表达载体的构建 使用限制性内切酶NdeⅠ与SalⅠ对由General Biosystems公司合成的pUC-57-ThermoFL质粒进行双酶切,将带有粘性末端的基因片段经胶回收试剂盒纯化后与表达载体pET-21a相连接,构建重组质粒pET-21a-ThermoFL。将连接产物转化至E coli.2984感受态细胞中,进行菌落PCR鉴定并提取质粒测序。
以重组质粒pET-21a-ThermoFL为模板,使用不同的上下游引物分别构建3种不同长度的Thermo端粒酶截短蛋白基因片段(Thermo45-1125,Thermo309-1125,Thermo336-1125),引物序列信息如表1所示。将3种基因片段分别与表达载体pET-21a、pET-15b-sumo连接,构建重组质 粒pET-21a-Thermo45-1125、pET-15b-sumo-Thermo309-1125、pET-15b-sumo-Thermo336-1125并进行菌落PCR鉴定,提取质粒。因为pET-21a载体酶切使用的限制酶Xho Ⅰ与目的基因酶切使用的Sal Ⅰ為同尾酶,两者连接后无法再进行双酶切检测,所以只对重组质粒pET-15b-sumo-Thermo309-1125与pET-15b-sumo-Thermo336-1125进行EcoRⅠ、XhoⅠ双酶切检测。
1.2.3 Thermo端粒酶蛋白的诱导表达与纯化 将鉴定正确的重组质粒pET-21a-ThermoFL转化到表达菌株E coli.C2566H的感受态细胞中,挑取单克隆菌落进行活化,以1∶1 000的体积比将活化后的菌株接种于1.5 L LB培养基中, 37 ℃下160 r/min扩大培养至OD600为0.6左右。加入终浓度为0.3 mmol/L的IPTG,18 ℃下140 r/min诱导14~16 h。离心收集菌体,以 1∶10(质量∶体积)的比例加入预冷的细胞裂解缓冲液[20 mmol/L HEPES(pH 7.0),500 mmol/L NaCl,体积分数10% Glycerol, 5 mmol/L Imidazole]重悬菌体。使用低温高压细胞破碎仪对菌体进行裂解,然后使用超声波破碎仪将残留的DNA打断。将超声破碎后的裂解液高速离心后取上清液,经0.45 μm滤膜过滤后加载至抗EDTA-Ni柱进行纯化。上样完成后使用Wash Buffer[20 mmol/L HEPES(pH 7.0),20 mmol/L Imidazole,体积分数10% Glycerol,500 mmol/L NaCl,1 mmol/L EDTA,1 mmol/L DTT]除去非特异性结合的蛋白。最后,使用 Elute Buffer[20 mmol/L HEPES(pH 7.0),500 mmol/L NaCl,500 mmol/L Imidazole,体积分数10% Glycerol,1 mmol/L EDTA,1 mmol/L DTT]进行蛋白洗脱并收集样品。使用预冷的无盐缓冲液将蛋白样品中的盐离子浓度降至300 mmol/L,加载至Hi Trap SP HP柱并进行NaCl浓度梯度洗脱,收集洗脱样品并使用10% SDS-PAGE电泳检测。使用50 ku浓缩管将纯化后的目的蛋白浓缩,浓缩后的蛋白样品液氮速冻后置于-80 ℃保存。使用相同方法对Thermo45-1125、Thermo309-1125与Thermo336-11253种端粒酶截短蛋白进行诱导表达与纯化。
1.2.4 Thermo端粒酶RNA的体外转录与纯化 将完整的Thermo端粒酶RNA分为Template区、PK区以及TWJ区分别进行转录与纯化,端粒酶RNA不同片段的转录与纯化流程相同。通过PCR得到用于转录的DNA模板,然后制备转录体系,转录体系中包含转录模板、T7 RNA聚合酶以及10×转录Buffer、MgCl2、NTP、DTT等成分,其中DTT浓度固定为1 mmol/L,MgCl2和NTP的用量根据RNA片段的不同进行调整,通常MgCl2用量为25~35 mmol/L,NTP用量为 4~8 mmol/L。各组分混匀后于37 ℃下转录 3 h,转录得到的RNA样品经高速离心后,将上清液加载到Mono Q柱上并进行NaCl浓度梯度洗脱,收集洗脱样品进行Native-PAGE电泳检测。若得到的样品纯度较高,则使用3 ku浓缩管进行浓缩,液氮速冻后置于-80 ℃备用;若得到的样品纯度较低,则使用S200分子筛进行二次纯化,纯化后将RNA样品浓缩、-80 ℃冻存备用。
1.2.5 Thermo端粒酶蛋白与RNA的复合活性测定 使用体外孵育的方法将Thermo端粒酶蛋白与Thermo端粒酶RNA进行复合,反应体系各组分浓度为:10 mmol/L HEPES-KOH(pH 8.0),1 mmol/L MgCl2,100 mmol/L NaCl, 3 mmol/L KCl,体积分数25% Glycerol,10 units/μL RNasin。在此体系中加入Thermo端粒酶蛋白与Thermo端粒酶RNA,为了检测Thermo端粒酶蛋白的复合活性,分别以0.5∶1/1∶1/1.5∶1的蛋白和RNA摩尔比加入上述复合体系中,将各组分混合均匀,在室温下孵育40 min。待反应结束后,进行10% Native-PAGE电泳检测,观察Thermo端粒酶蛋白与端粒酶RNA是否发生复合,进一步探索两者发生复合的最适条件。
1.2.6 Thermo端粒酶组装体的反转录活性测定 使用5′端标记有6-FAM荧光基团的18 nt DNA序列(5′-TTAGGGTTAGGGTTAGGG-3′)为引物进行Thermo端粒酶延伸试验。将Thermo端粒酶蛋白与Thermo端粒酶RNA按照摩尔比1∶1.2的比例进行混合并于室温下静置40 min,得到浓度为10~20 μmol/L的Thermo端粒酶组装体。配制端粒酶引物延伸体系:40 mmol/L Tris-HCl(pH 7.5),2 mmol/L MgCl2,1 mmol/L Spermidine,100 mmol/L NaCl,20 mmol/L KCl,1 mmol/L DTT,0.2 mmol/L dNTPmix,2 mmol/L Mg(AC)2,0.5 μmol/L Thermo端粒酶组装体,1 mmol/L DNA引物。将延伸体系混合均匀后置于37 ℃避光反应1 h,之后加入10 μL 8 mol/L Urea终止反应。随后将样品置于PCR仪中,98 ℃反应10 min,将冷却后的样品进行15% Urea-PAGE电泳检测。
以上述Thermo端粒酶延伸体系为基础,通过控制变量法依次分析RNase、端粒酶RNA结构完整性及端粒酶蛋白TEN结构域完整性对反转录活性的影响。
2 结果与分析
2.1 Thermo端粒酶蛋白的生物信息学分析
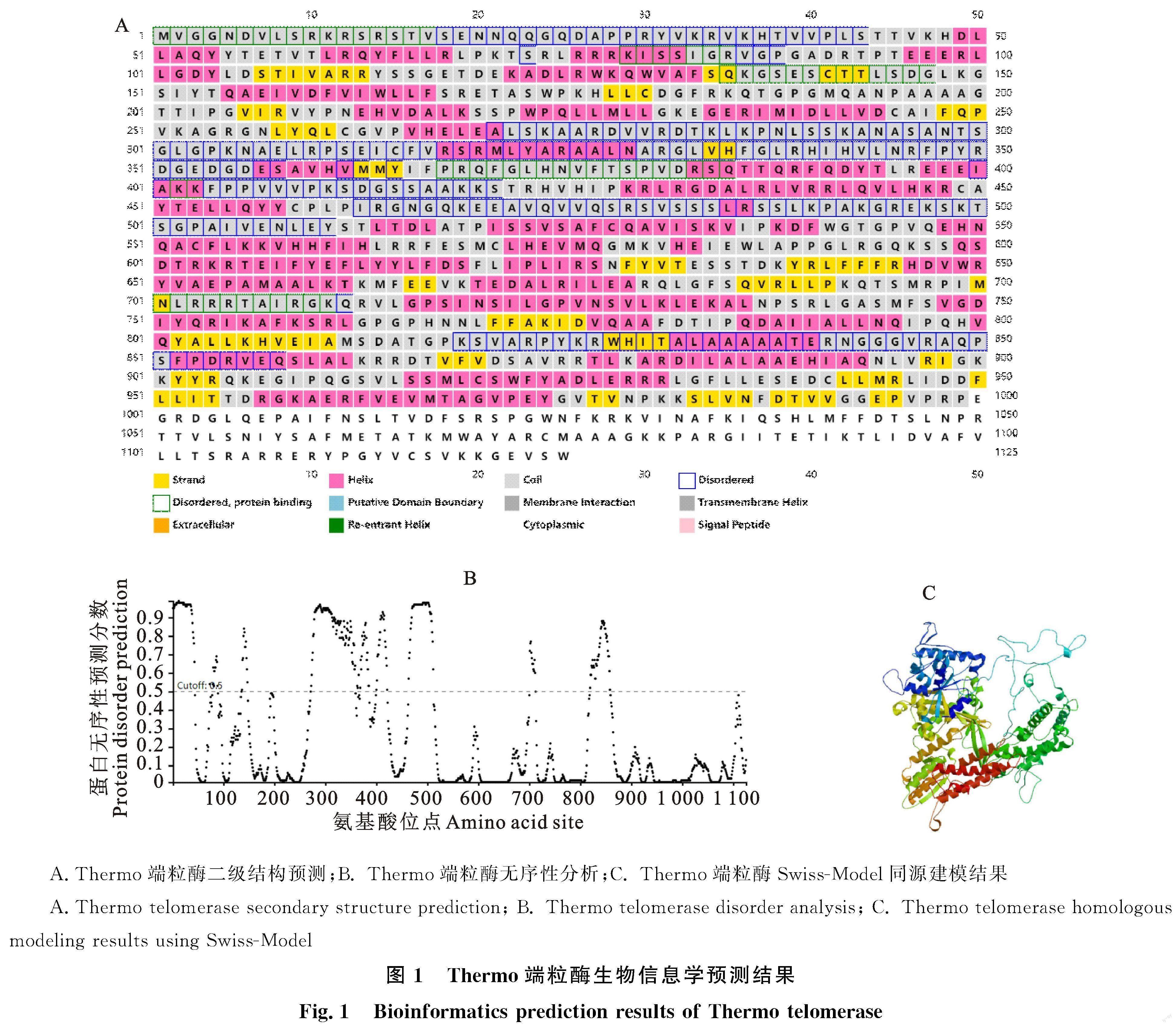
由图1-A可知,Thermo端粒酶蛋白的二级结构中存在大量的α-螺旋与无规卷曲结构,其中无规卷曲主要在前500个氨基酸中形成,大量无规卷曲结构的存在使得Thermo端粒酶蛋白在结构上排列松散,导致其在晶体形成及空间结构解析方面存在极大困难。根据图1-B所示结果,可以得知Thermo端粒酶蛋白的无序区主要集中在1~50、250~350以及800~900个氨基酸之间,無序区所占比例很大。
Thermo端粒酶蛋白的Swiss-Model同源建模结果如图1-C所示,发现Thermo端粒酶蛋白主要由4个结构域组成,其中TEN结构域中柔性区所占比重很大,使得Thermo端粒酶蛋白的TEN结构域较为松散。
2.2 Thermo端粒酶蛋白载体构建与表达纯化
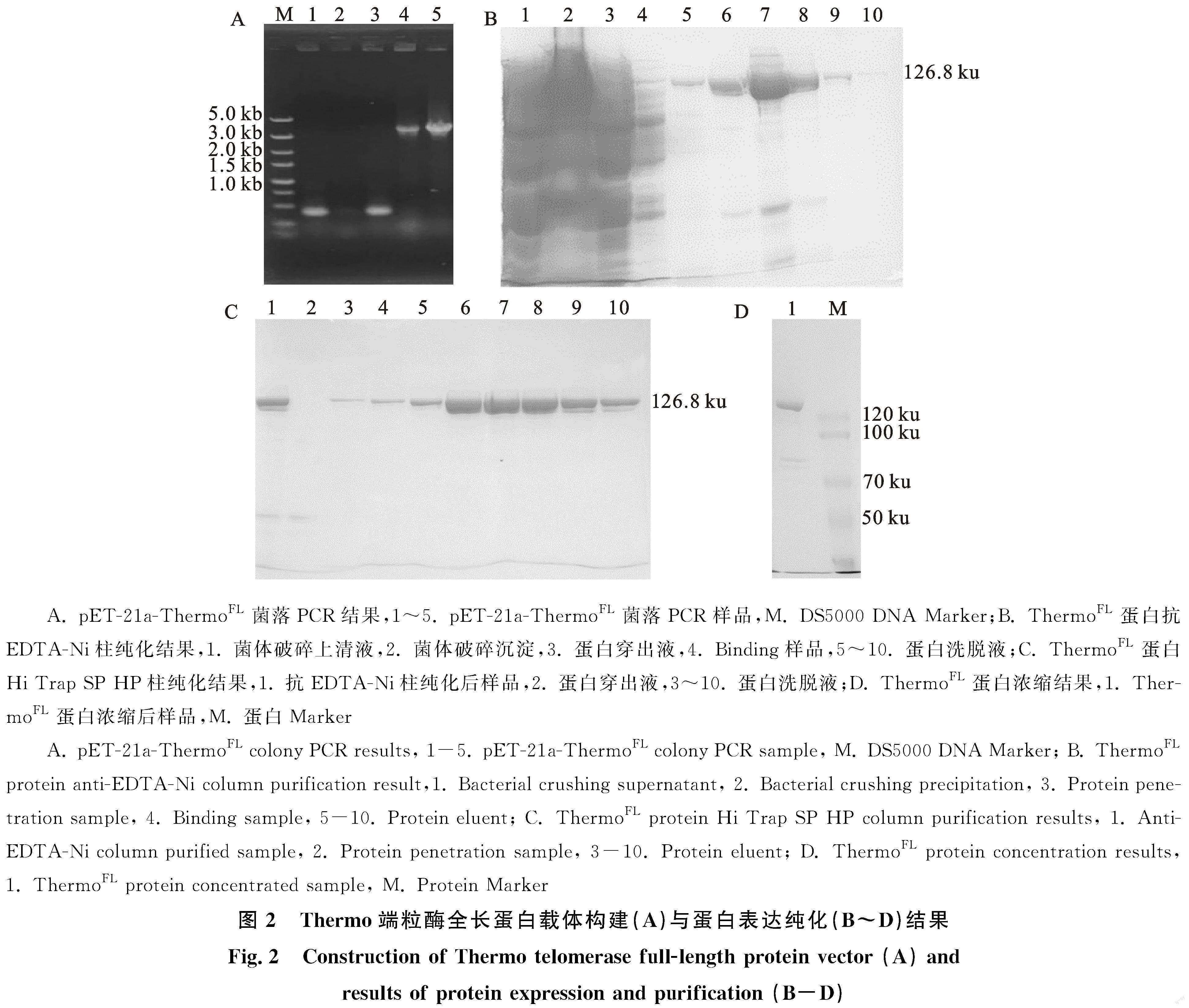
2.2.1 Thermo端粒酶全长蛋白载体构建与表达纯化 ThermoFL经菌落PCR鉴定,得到3.4 kb的片段(图2-A),与预期片段大小一致。挑选其中的阳性单菌落,提取质粒。将重组质粒pET-21a-ThermoFL转入表达菌株E coli.C2566H的感受态细胞中,经诱导表达得到Thermo端粒酶全长蛋白(126.8 ku),结果显示目的蛋白在沉淀与上清液中均有出现(图2-B),上清液样品经抗EDTA-Ni柱和Hi Trap SP HP柱纯化后,目的蛋白的纯度得到极大提升(图2-B,2-C),浓缩后得到的Thermo端粒酶全长蛋白分子质量与理论值一致且纯度在95%以上(图2-D)。
2.2.2 Thermo端粒酶截短蛋白载体构建与表达纯化 将Thermo45-1125、Thermo309-1125与Thermo336-1125分别进行菌落PCR鉴定,依次得到3.2 kb、2.5 kb、2.4 kb的片段(图3-A,3-B,3-C),与预期片段大小一致。挑选其中的阳性单菌落,提取质粒并进行双酶切鉴定。重组质粒pET-15b-sumo-Thermo309-1125与pET-15b-sumo-Thermo336-1125经EcoRⅠ、XhoⅠ双酶切后,所得片段大小与预期一致(图3-D)。3种不同长度的Thermo端粒酶截短蛋白均可以成功诱导表达,使用的纯化方法及流程同Thermo端粒酶全长蛋白。最终浓缩得到3种纯度大于90%的Thermo端粒酶截短蛋白,并且3种蛋白的分子质量与理论值一致(图3-E)。
2.3 Thermo端粒酶RNA的体外转录与纯化
Thermo端粒酶RNA由Template区、PK区及TWJ区组成,以体外转录的方式分别得到各部分RNA片段,以Template区的转录与纯化结果为例进行分析,PK区与TWJ区的纯化流程及结果同Template区。由图4-A可知,在6 mmol/L NTPs、30 mmol/L MgCl2的条件下,Template区的转录效果最为理想,以此条件进行Template区的大样转录,得到大量纯度较低的Thermo端粒酶RNA-Template区样品(图4-B泳道1),随后经Mono Q柱及S200分子筛纯化,目的片段的纯度得到明显提高(图4-B,4-C),最终浓缩得到高纯度的Thermo端粒酶RNA-Template区片段(图4-D)。
2.4 Thermo端粒酶蛋白与RNA的复合活性测定
使用Native-PAGE检测Thermo端粒酶蛋白与RNA的复合情况,若两者发生复合,复合物的分子质量变大,在凝胶中的迁移速度变慢,电泳后的条带向上偏移。根据图5所示结果,ThermoFL、Thermo45-1125、Thermo309-1125与Thermo336-11254种不同长度的端粒酶蛋白均可与端粒酶RNA有效复合,说明Thermo端粒酶蛋白结合RNA的区域分布在336个氨基酸之后;根据Thermo端粒酶蛋白与RNA复合的摩尔浓度梯度试验,发现当Thermo端粒酶蛋白与Thermo端粒酶RNA的摩尔比达到1∶1时,两者就能达到很好的复合效果;而当端粒酶蛋白与RNA的摩尔比达到1.5∶1时,几乎所有RNA均可结合到蛋白上,说明通过原核表达系统得到的Thermo端粒酶蛋白具有很强的RNA复合活性。
2.5 Thermo端粒酶组装体的反转录活性测定及影响因素分析
通过端粒酶体外延伸试验检测反转录活性,结果如图6-A所示,Thermo端粒酶组装体使DNA引物在原有长度的基础上发生了明显的延伸,说明结构完整的Thermo端粒酶逆转录酶与RNA经体外复合组装后,具有很强的反转录活性。图6-B显示,ThermoFL与Thermo45-1125端粒酶组装体均可使DNA引物反复延伸,且两者的延伸活力无明显差别,说明Thermo端粒酶逆转录酶TEN结构域的完整性对于其反转录活性可能不是必需的。由图6-C可知,当有RNase存在时,无论Thermo端粒酶组装体结构是否完整,均无反转录活性,说明Rnase会抑制端粒酶的反转录活性。图6-D与6-E显示,当TWJ区与T-PK区均缺失时,端粒酶无反转录活性,泳道中仅有DNA引物条带;当TWJ或T-PK片段有任意一部分缺失时,端粒酶反转录活性很弱;而当TWJ与T-PK结构域均完整时,端粒酶表现出极强的反转录活性,说明端粒酶RNA结构的完整性是其发挥反转录活性的必要条件。
3 讨 论
端粒酶是一种具有特殊反转录活性的酶[24],由端粒酶RNA(TER)和端粒酶逆转录酶(TERT)两部分组成,主要功能是以其自身携带的RNA为模板,以细胞中游离的dNTP为原料,按照5′→3′方向反复延伸端粒DNA,从而解决染色体末端复制问题。本研究系统地构建了Thermo端粒酶蛋白的原核表达体系,得到了纯度大于90%的Thermo端粒酶蛋白,并与Thermo端粒酶RNA在体外复合成了具有反转录活性的端粒酶组装体。端粒酶逆转录酶在进化上具有高度的保守性,研究嗜热毛壳菌端粒酶的酶学特性及空间结构对于探索人源端粒酶的工作机制具有很高的参考价值。目前获得端粒酶的方式仍以内源蛋白纯化为主,如四膜虫、赤拟谷盗的端粒酶均通过Pull-down 实验直接从细胞裂解液中获得,纯化成本高且纯度、活性低[16-19,22],本研究使用大肠杆菌表达系统成功获得了纯度与活性都较高的端粒酶蛋白,打破了之前关于原核表达系统能否表达端粒酶的争议,大大降低了端粒酶的纯化成本。同时对Thermo端粒酶蛋白进行了无序区的预测,根据预测结果成功得到了3种Thermo端粒酶截短蛋白,为后续Thermo端粒酶的晶体结构解析奠定了基础。
本研究利用體外转录的方式得到了Thermo端粒酶RNA,并与Thermo端粒酶蛋白成功组装。试验发现无论是Thermo端粒酶全长蛋白,还是3种截短蛋白,均可与Thermo端粒酶RNA较好地复合,说明TEN结构域在端粒酶蛋白与RNA的结合过程中无明显作用,端粒酶蛋白与RNA相互作用的区域可能分布在336个氨基酸之后。同时发现当端粒酶蛋白与RNA的摩尔比达到1∶1以上时,两者就能发生有效的复合,说明使用原核表达系统也能得到具有复合活性的端粒酶蛋白。
最后,本研究通过Thermo端粒酶体外延伸试验,发现当蛋白结构与RNA结构均保持完整时,Thermo端粒酶具有很强的反转录活性,而当RNA的T-PK区或TWJ区缺失时,端粒酶无反转录活性,说明RNA结构的完整是维持其反转录活性的必要条件。这一结论在脊椎动物及纤毛虫中均可得到印证[25],但在假丝酵母中,仅仅需要模板区的存在就能催化端粒 DNA 的合成,并不需要 TWJ、PK 等结构元件的协助[20-21]。说明端粒酶对TWJ和PK等结构元件的依赖性具有物种特异性,具体作用机制尚不清楚;除此以外,目前对于端粒酶蛋白的TEN结构域是否在端粒的反复延伸过程中发挥重要作用存在一定争议[26],例如在四膜虫中,TEN结构域并未直接与端粒DNA或端粒酶RNA相互作用,而是通过TRAP-motif间接地调控反转录过程。而在赤拟谷盗的端粒酶晶体结构中,甚至没有发现TEN结构域的存在[19]。因此本研究使用ThermoFL与Thermo45-1125两种TEN结构域完整度不同的蛋白分别与RNA复合,发现两者均可表现出很强的反转录活性。表明在嗜热毛壳菌中,TEN结构域的完整性对于其反转录活性并不是必需的。
综上所述,本研究为端粒酶纯化提供了新的思路与研究方向,大大降低了端粒酶纯化的成本,为端粒酶的晶体结构解析奠定了基础。同时对端粒酶活性及其影响因素进行了一定程度的探索,为TEN结构域在反转录过程中是否发挥重要作用这一争论提供了一定的参考,对于进一步解析端粒酶的工作机制具有重要意义。
参考文献 Reference:
[1] WATSON J D.Origin of concatemeric T7 DNA [J].Nature:New Biology, 1972,239(94):197-201.
[2] ZHAO Y,SHAY J W,WRIGHT W E.Telomere terminal G/C strand synthesis:measuring telomerase action and C-rich fill-in [J].Methods in Molecular Biology,2011,735:63-75.
[3] RHODES D,GIRALDO R.Telomere structure and function [J].Current Opinion in Structural Biology,1995,5(3):311-322.
[4] XU Z,DUC K D,HOLCMAN D,et al.The length of the shortest telomere as the major determinant of the onset of replicative senescence [J].Genetics,2013,194(4):847-857.
[5] YAMAGUCHI H,BAERLOCHER G M,LANSDORP P M,et al.Mutations of the human telomerase RNA gene (TERC) in aplastic anemia and myelodysplastic syndrome [J].Blood,2003,102(3):916-918.
[6] ZHONG F,SAVAGE S A,SHKRELI M,et al.Disruption of telomerase trafficking by TCAB1 mutation causes dyskeratosis congenita [J].Genes & Development,2011,25(1):11-16.
[7] ARMANIOS M Y,CHEN J J,COGAN J D,et al.Telomerase mutations in families with idiopathic pulmonary fibrosis [J].The New England Journal of Medicine,2007,356(13):1317-1326.
[8] ARMANIOS M.Syndromes of telomere shortening [J].Annual Review of Genomics and Human Genetics,2009,10(1):45-61.
[9] 张 博.酵母端粒酶延伸端粒DNA分子机制的研究[D].陕西杨凌:西北农林科技大学,2016.
ZHANG B.Molecular mechanism of yeast telomerase extending telomere DNA [D].Yangling Shaanxi:Northwest A&F University,2016.
[10] GUTERRES A N,VILLANUEVA J.Targeting telomerase for cancer therapy [J].Oncogene,2020,39(36):5811-5824.
[11] BERNARDES J B,BLASCO M A.Telomerase at the intersection of cancer and aging [J].Trends in Genetics,2013,29(9):513-520.
[12] SAFDAR A,LITTLE J P,STOKL A J,et al.Exercise increases mitochondrial PGC-1alpha content and promotes nuclear-mitochondrial cross-talk to coordinate mitochondrial biogenesis [J].The Journal of Biological Chemistry,2011,286(12):10605-10617.
[13] CALADO R T,YOUNG N S.Telomere diseases [J].The New England Journal of Medicine,2009,361(24):2353-2365.
[14] DONATI B,VALENTI L.Telomeres,NAFLD and chronic liver disease [J].International Journal of Molecular Sciences, 2016,17(3):383-395.
[15] SHAY J W.Role of telomeres and telomerase in aging and cancer [J].Cancer Discovery,2016,6(6):584-593.
[16] WITKIN K L,COLLINS K.Holoenzyme proteins required for the physiological assembly and activity of telomerase [J].Genes & Development, 2004,18(10):1107-1118.
[17] WITKIN K L,PRATHAPAM R,COLLINS K.Positive and negative regulation of Tetrahymena telomerase holoenzyme [J].Molecular and Cellular Biology,2007,27(6):2074-2083.
[18] MIN B,COLLINS K.An RPA-related sequence-specific DNA-binding subunit of telomerase holoenzyme is required for elongation processivity and telomere maintenance [J].Molecular Cell, 2009,36(4):609-619.
[19] MITCHELL M,GILLIS A,FUTAHASHI M,et al.Structural basis for telomerase catalytic subunit TERT binding to RNA template and telomeric DNA [J].Nature Structural & Molecular Biology,2010,17(4):513-518.
[20] 翟留濤.假丝酵母端粒酶逆转录酶的结构与功能研究[D].陕西杨凌:西北农林科技大学,2021.
ZHAI L T.Structure and function of telomerase reverse transcriptase from Candida [D].Yangling Shaanxi:North-west A&F University,2021.
[21] ZHAI L T,RETY S,CHEN W F,et al.Crystal structures of N-terminally truncated telomerase reverse transcriptase from fungi [J].Nucleic Acids Research. 2021,49(8):4768-4781.
[22] WANG Y,SUAC L,FEIGON J.Structural biology of telomerase [J].Cold Spring Harbor Perspectives in Biology,2019,11(12):a032383.
[23] AMLACHER S,SARGES P,FLEMMING D,et al.Insight into structure and assembly of the nuclear pore complex by utilizing the genome of a eukaryotic thermophile [J].Cell,2011,146(2):277-289.
[24] LINGNER J,HUGHES T R,SHEVCHENKO A,et al.Reverse transcriptase motifs in the catalytic subunit of telomerase [J].Science,1997,276(5312):561-567.
[25] QIAO F,CECH T R.Triple-helix structure in telomerase RNA contributes to catalysis [J].Nature Structural & Molecular Biology,2008,15(6):634-640.
[26] JIANG J,WANG Y,SUAC L,et al.Structure of telomerase with telomeric DNA [J].Cell,2018,173(5):1179-1190.
Expression and Purification of Telomerase from Chaetomium thermophilus and Analysis of Its Enzymatic Properties
Abstract To further investigate the enzymatic properties of telomerase,using Chaetomium thermophilum (Thermo) telomerase as the object,four different lengths of Thermo telomerase proteins were obtained by biochemistry and bioinformatics,and assembled with Thermo telomerase RNA obtained by in vitro transcription.The reverse transcription activity of the assemblies was detected by telomerase in vitro extension assay,and various factors affecting their reverse transcription activity were further analyzed.The results showed that the recombinant plasmids of four different lengths of Thermo telomerase proteins could obtain the corresponding Thermo telomerase proteins after induction and expression by the E.coli expression system,and the purity of all of them was above 90%.The in vitro incubation assay showed that the molar concentration ratio of telomerase protein to RNA reached 1∶1 and under the conditions of 10 mmol/L HEPES-KOH (pH 8.0),1 mmol/L MgCl2,100 mmol/L NaCl,3 mmol/L KCl,25% Glycerol by volume,10 units/μL Rnasin above,the two can complex effectively;in vitro telomerase extension assay revealed that the structurally intact Thermo telomerase assemblies had strong reverse transcription activity and could make the 18nt-DNA primers extend repeatedly.The incomplete TEN domain did not diminish the reverse transcription activity of the Thermo telomerase assemblies,indicating that they did not play a significant role in the reverse transcription process.
Key words Thermo telomerase; Protein expression and purification; RNA transcription in vitro; Reverse transcriptional activity

