锌基MOFs材料在肿瘤治疗领域的应用进展
吴晓艳 杨仕平 安璐

DOI: 10.3969/J.ISSN.1000-5137.2024.01.010
收稿日期: 2023-11-01
基金项目: 国家自然科学基金重大研究计划培育项目(91959105)
作者简介: 吴晓艳(1996—), 女, 硕士研究生, 主要从事锌基MOFs材料用于肿瘤治疗等方面的研究. E-mail: 1340718390@qq.com
* 通信作者: 杨仕平(1969—), 男, 教授, 主要从事磁共振成像造影剂的开发及其应用等方面的研究. E-mail: shipingy@shnu.edu.cn
引用格式: 吴晓艳, 杨仕平, 安璐. 锌基MOFs材料在肿瘤治疗领域的应用进展 [J]. 上海师范大学学报 (自然科学版中英文), 2024,53(1):74?80.
Citation format: WU X Y, YANG S P, AN L. Application progress of zinc based MOFs materials in the field of tumor therapy [J]. Journal of Shanghai Normal University (Natural Sciences), 2024,53(1):74?80.
摘 要: 金属-有机框架(MOFs)是由含氧或氮的有机配体与过渡金属通过自组装连接而形成的具有周期性网状结构的晶体材料。该类材料因具有尺寸结构可调、高孔隙率、比表面积大、低晶体密度等一系列优点,而受到多个学科研究人员的重视。其中,锌(Zn)基MOFs材料因其优越的生物相容性和易功能化修饰等特点,受到了广泛的关注。文章主要从药物递送和协同抗癌等方面总结了Zn基MOFs材料的生物应用.
关键词: 锌(Zn)基金属-有机框架(MOFs)材料; 声动力治疗(SDT); 药物递送; 协同抗癌
中图分类号: O 611 文献标志码: A 文章编号: 1000-5137(2024)01-0074-07
Abstract: Metal organic frameworks(MOFs) are crystalline materials with periodic network structures formed by self-assembly of organic ligands containing oxygen or nitrogen and transition metals.This type of material has attracted the attention of researchers from multiple disciplines due to its advantages such as adjustable size and structure, high porosity, large specific surface area, and low crystal density. Among them, zinc(Zn) based MOFs materials have received widespread attention from researchers due to their superior biocompatibility and easy functionalization modification. This article mainly summarizes the biological applications of zinc based MOFs materials in drug delivery, synergistic anticancer, and other aspects.
Key words: zinc(Zn) based metal organic frameworks(MOFs) materials; sonodynamic therapy(SDT); drug delivery; collaborative anticancer
0 引 言
金屬-有机框架(MOFs)材料是近年来发展迅速的一种配位聚合物,具有三维(3D)孔洞结构,一般以金属离子为连接点,有机配位体支撑构成空间3D延伸. MOFs材料不仅结构可调,而且具有高孔隙率和表面积. 近年来科学家们开发了各种新结构的MOFs材料,并广泛应用于光学[1]、传感器[2]、气体吸附与分离[3]、储气[4]、催化[5]、给药[6]、抗癌[7]和抗菌[8]等领域. 而锌(Zn)基MOFs因具有较大的表面积和可调的孔洞结构,已被成功地应用于药物递送系统(DDS)[9]. 其中Zn基MOFs材料具有良好的生物相容性和生物降解性,被广泛应用于生物医学领域. 但是单纯的Zn基MOFs功效单一,治疗效果较差. 因此,研究者们将其与其他治疗手段联合起来,起到协同治疗的效果. 一种方法是利用Zn基MOFs材料的空腔结构在超声(US)作用下会把氧气(O2)转化成单线态氧(1O2)[10],从而将声动力治疗与锌离子(Zn2+)介导的诱导癌细胞凋亡的生物治疗联合起来;另一种方法是以Zn基MOFs材料为载体,负载化疗药物和光敏剂,在治疗过程中Zn2+干扰线粒体电子传递和糖酵解,导致代谢系统能量衰竭,进而抑制耐药蛋白p-糖蛋白(P-gp)和热休克蛋白(HSP70)表达. 与此同时,光敏剂在激光照射下产生大量活性氧(ROS)杀死癌细胞[11],该策略通过操纵能量代谢从而有效克服癌症化疗-光疗耐药性,使疗效大大提升.
1 Zn基MOFs材料的合成方法
Zn基MOFs材料的常用合成方法有溶剂热法[10]和微流控法[12]. 溶剂热合成法是将Zn离子(Zn2+)和2-甲基咪唑溶于水或有机溶剂,通过加热金属离子与配体的溶液直接合成MOFs材料. 微流控技术在近年来发展迅速,将这种技术应用于化学合成中则具有传热和传质方面的优势,是制备纳米颗粒(NPs)广泛而有效的方法. 一般来说,MOFs NPs通常是在间歇条件下合成的,但是近来越来越多的研究者尝试用微流控技术来合成Zn的沸石咪唑酸盐框架(ZIF-8). 利用微流控技术控制ZIF-8的成核和结晶过程,可以合成尺寸均匀、形貌规整的ZIF-8,并可在较宽范围内调节粒径.
2 Zn基MOFs材料在肿瘤治疗领域的应用
2.1 Zn基MOFs材料用于DDS
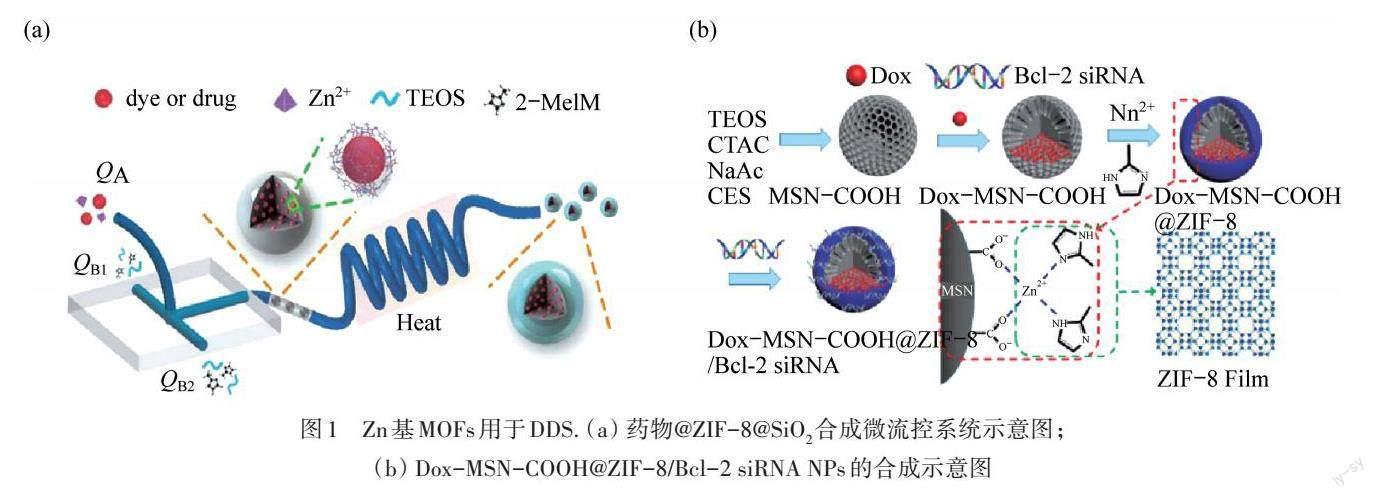
常规给药方式存在药物易溶解、利用率低、生物相容性差、副作用大等缺点,而利用MOFs材料构建DDS是理想的给药方式. 然而,传统的MOFs材料大多具有一定毒副作用,Zn基MOFs因其优良的生物相容性和生物降解性而在各类DDS中广受关注. 尽管Zn基MOFs材料已广泛应用于DDS中,但如何进一步提高这些材料的水稳定性和生物相容性,仍面对着巨大挑战. 目前,科研人员主要是利用亲水基团官能化配体和二氧化硅(SiO2)涂层进行表面改性[13]. 如图1(a)所示,HU等[12]开发了一种热辅助微流控制系统,用于连续、高效地制备尺寸均匀、稳定性高、生物相容性优异的沸石咪唑酯骨架纳米复合材料(ZIF-8@SiO2). 该微流控系统由T型结聚二甲基硅氧烷(PDMS)核心组件和聚四氟乙烯(PTFE)管附件组成,无需传统光刻技术即可制造. 所制备的微流控系统包括两个连续的部分:染料/药物@纳米颗粒的连续合成和表面功能化. 成核过程对NPs的制备是极其重要的,同时,大量成核有利于生成小尺寸的NPs. 因此,可以通过改变Zn2+和2-甲基咪唑结点的体积和几何设置来优化微混合效率,从而控制NPs的尺寸. 当结点体积大于100 mL时,可以观察到较大的粒径与较宽的尺寸分布,这可能是由于试剂混合不足,从而导致分子碰撞机会和成核时间存在明显差异. 当混合体积减小到20 mL时,得到了ZIF-8的理想尺寸分布. 小的混合体积和管通道的微尺度允许足够的试剂进行充分混合反应,并为均匀小尺寸的MOFs NPs的快速成核和生长提供了关键环境. 此外,在初始入口处将有机配体2-甲基咪唑、要负载的染料/药物、MOFs的金属盐前驱体(Zn2+)混合后一起注射. 在PDMS单片微流控反应器中同时实现了MOFs纳米载体的形成和载药. 盐酸阿霉素(DOX)、芘(Py)和玫瑰红(RB)三种具有不同亲水-疏水特性的染料或药物分子被成功负载到ZIF-8@SiO2 NPs中.
在癌症的治疗过程中,内在或获得性多药耐药(MDR)肿瘤严重阻碍了基于抗癌药物的治疗过程,导致药效大打折扣[14]. 小干扰RNA(siRNA)可以通过沉默MDR来对抗相关耐药性基因表达[15],精准控制其在肿瘤内的递送,有效提高抗肿瘤疗效. 基于此,PAN等[16]利用ZIF-8在酸性条件下固有的生物降解性,开发了一种新型pH值响应的DDS. 在羧化介孔SiO2(MSN-COOH) NPs表面原位合成了1.3 nm厚的ZIF-8薄膜,用于覆盖单分散SiO2的孔隙,并有效负载RNA以制备pH值响应的DDS. ZIF-8薄膜可以将MSN-COOH表面的电荷转化为正电荷,再通过静电相互作用有效加载siRNA,保护siRNA使其不被核酸酶降解. 这种超薄的ZIF-8 薄膜不仅可以高效率吸附siRNA,还可以将化疗药物阿霉素(DOX)包裹在MSN的孔中,从而制备出如图1(b)所示的Dox-MSN-COOH@ZIF-8/Bcl-2 siRNA NPs. 所得到的Dox-MSN-COOH@ZIF-8/Bcl-2具有高Bcl-2 siRNA负载效率和保护其免受核糖核酸酶降解的优势. 此外,MSN-COOH@ZIF-8 NPs能够快速被细胞摄取并在溶酶体中有效释放Dox和siRNA NPs,从而显著增强对MCF-7/ADR和SKOV-3/ADR细胞的化疗疗效.

图1 Zn基MOFs用于DDS. (a) 药物@ZIF-8@SiO2合成微流控系统示意图;(b) Dox-MSN-COOH@ZIF-8/Bcl-2 siRNA NPs的合成示意圖
2.2 Zn基MOFs材料用于声动力治疗(SDT)
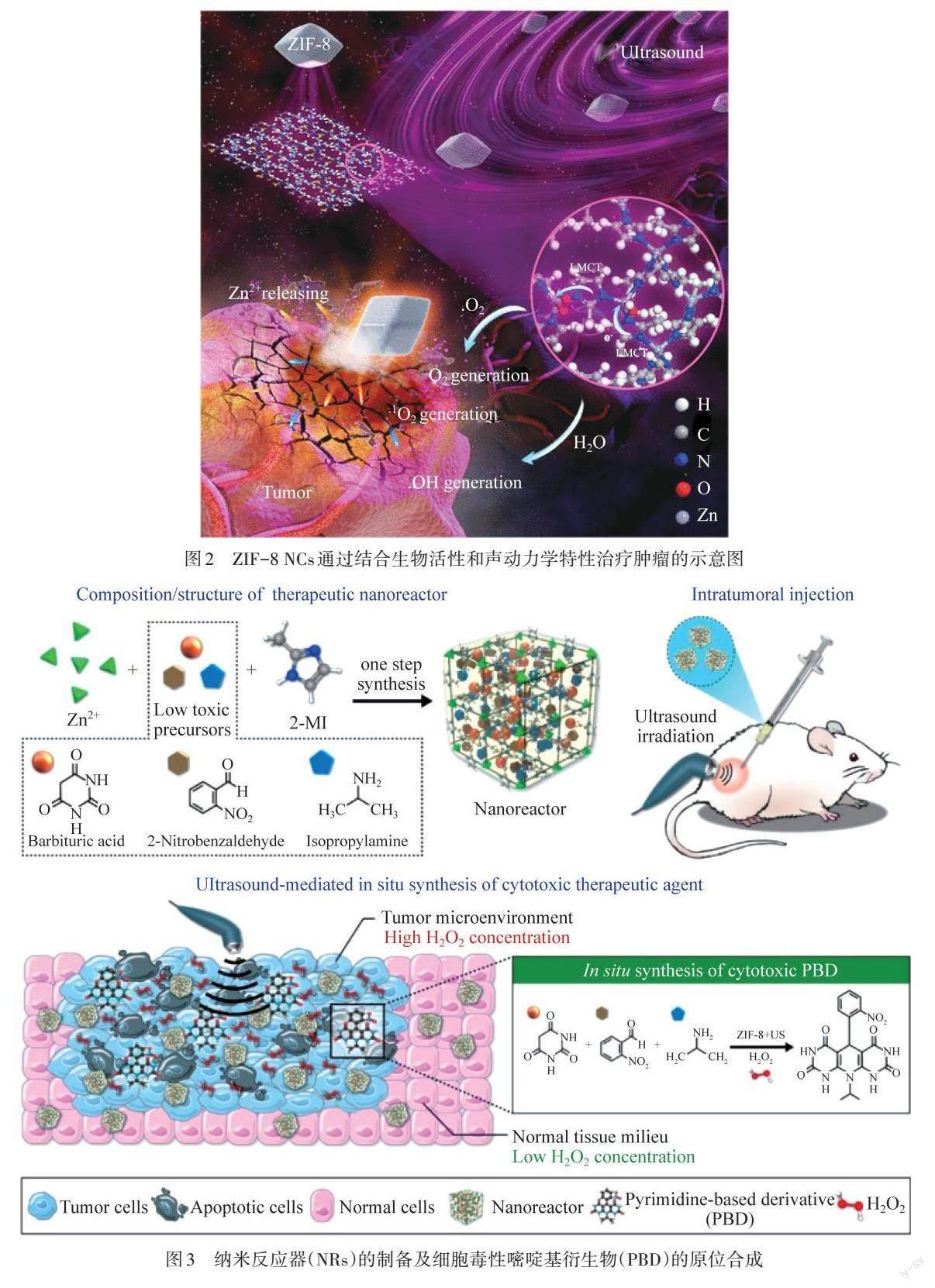
SDT是由US触发的一种典型的无创癌症治疗方式,因其高组织穿透深度而广受科研人员的关注[17]. 传统有机卟啉声敏剂中的金属-氮(M-N)基团在催化关键活性位点,和在激光照射下生成ROS的过程中起着重要作用[18]. WANG等[10]发现并证明了沸石咪唑框架-8(ZIF-8)中Zn2+具有诱导癌细胞凋亡的生物活性,并和材料声动力学有效结合,在US作用下肿瘤治疗效率大大提升. 如图2所示,ZIF-8的(110)晶体面暴露特定的配位不饱和Zn-N活性位点将吸附的O2和水分子激活为ROS,同时,在肿瘤酸性微环境(TME)的刺激下,ZIF-8会裂解,不断释放Zn2+,并通过中断Zn稳态来杀死癌细胞. 结合生物活性和声动力学性能,ZIF-8具有较高的肿瘤抑制效率,抑制效率高达84.6%.

图2 ZIF-8 NCs通过结合生物活性和声动力学特性治疗肿瘤的示意图
此外,Zn基MOFs材料孔隙性较高,同时具有丰富的催化金属位点,因此在多组分反应中表现出了非凡的有效性. 与此同时,Zn在激活药物前体和提高其化学反应速率方面具有较高的应用潜力,使其成为杂环合成中的优良催化剂,可以催化嘧啶基化疗药物在肿瘤部位的原位合成. 在超声(US)作用下,Zn基MOFs不仅可以通过空化作用产生大量ROS,杀死癌细胞,同时,US可以通过表面活化和增强金属与前驱体之间的相互作用来加速金属催化剂的化学反应,催化嘧啶基化疗药物在肿瘤部位的原位合成,起到SDT和化疗联合治疗的效果. SUNG等[19]制备了沸石咪唑框架-8(ZIF-8),如图3所示. 该框架包含了药物上可接受的前体,巴比妥酸(BA)、2-硝基苯甲醛(NBA)和异丙胺(IPA),其作为一种纳米反应器(NR)系统,可用于局部抗肿瘤药物的合成. 所制备的NR在荷肿瘤小鼠模型的肿瘤内给药,然后用超声(US)刺激以激活其化学合成. NR在US后被选择性激活,原位将低毒性前体转化为定位于TME的化疗药物,同时ZIF-8在US作用下产生大量ROS,实现了化疗-SDT联合治疗.

图3 纳米反应器(NRs)的制备及细胞毒性嘧啶基衍生物(PBD)的原位合成
2.3 Zn基MOFs应用于化疗-光疗联合治疗
由于癌症的高度复杂性和异质性,常规的单药治疗方法(即化疗、手术治疗、放疗)往往不能消除恶性肿瘤. 作为传统癌症治疗的替代策略,光动力治疗因其副作用小、侵袭性小、特异性较高而受到人们的广泛关注[20]. 光动力治疗是利用特定波长的激光激活在肿瘤组织内选择性滞留的光敏剂,与肿瘤组织内的氧发生作用,产生化学性质很活泼的1O2及一些活泼的自由基[21],这些产物与生物大分子发生作用,破坏细胞和细胞器的结构与功能,从而选择性地杀伤肿瘤细胞,达到治疗的目的. 化疗-光疗是一种新兴的肿瘤治疗策略,在许多难治病例中取得了良好的疗效[22]. 然而,治疗耐药性仍然是有效治疗癌症的主要挑战. 当化疗药物转移到癌症细胞中时,一些三磷酸腺苷(ATP)结合转运蛋白,如药物外排受体、MDR蛋白1(MDR1/P-gp)等,通过利用ATP水解产生的能量,高度表达以促进药物外排,从而导致化疗耐药性[23]. 此外,另一类功能蛋白热休克蛋白(HSPs),具有逆转或抑制细胞蛋白变性的能力,以应对光动力疗法诱导的缺氧应激或光热疗法诱导的高热,显著削弱了光疗期间的治疗效果[24]. 因此,操纵ATP的产生来抑制P-gp和HSPs的表达,是解决癌症治疗耐药性的一个有效策略. LU等[11]设计合成了硫酸软骨素(CS)功能化的沸石咪唑框架-8(ZIF-8)纳米平台,如图4所示,用ZIF-8装载碘化物光敏剂(IR780)偶联的阿托瓦酮(A780)和化疗药物阿霉素(DOX)制备出多功能纳米平台(CS/ZIF-8@A780/DOX). 其中,硫酸软骨素(CS)可以特异性靶向癌细胞,增强癌细胞对硫酸软骨素功能化的沸石咪唑框架-8(CS/NPs)的摄取. 同时,ZIF-8的pH值响应性递送行为使NPs在TME中具有令人满意的释放特性,可以大量释放碘化物光敏剂IR780偶联的阿托瓦酮(A780)、化疗药物阿霉素(DOX)以及Zn2+. 在TME中释放的A780和Zn2+可以通过干擾线粒体电子传递和糖酵解过程,导致系统的能量衰竭,进而克服P-gp介导的化疗耐药性和HSP70诱导的光疗耐受性. 基于此,CS/NPs的这些多功能特性大大提高了肿瘤治疗的效率.

图4 (a) CS/ZIF-8@A780/DOXNPs合成及(b) 逆转肿瘤化疗-光疗耐药性的机理示意图
3 结论与展望
Zn基MOFs材料已被广泛应用于癌症治疗领域,但目前还存在一些迫切需要解决的难题,比如粒径过大不能被细胞内吞,稳定性欠佳、纯材料功能单一、疗效较差等. 为了解决以上问题,科研人员可以选择对Zn基MOsF材料进行表面改性,构建复合Zn基纳米多功能材料. 同时,在TME中,Zn基MOFs材料可以裂解释放出Zn2+,Zn2+能够通过线粒体电子传递链诱导肿瘤细胞内ROS激增,从而进一步激活cGAS/STING信号通路或降解突变蛋白,有效抑制肿瘤增殖. 然而,基因表达是复杂而多样的,进一步探索Zn2+过载诱导癌细胞死亡的未知机制,可以优化Zn2+干扰治疗的治疗方案,克服剂量依赖性和耐药性等问题. 在Zn基MOFs材料的开发中,将Zn2+治疗与各种其他癌症治疗方法,如SDT或光动力治疗等联合,可以实现一个最佳的联合治疗结果.
参考文献:
[1] BAG P P, WANG X S, CAO R. Microwave-assisted large scale synthesis of lanthanide metal-organic frameworks (Ln-MOFs), having a preferred conformation and photoluminescence properties [J]. Dalton Transactions, 2015,44(26):11954-11962.
[2] SMALL L J, HENKEILS S E, RADEMACHER D X, et al. Near-zero power MOF-based sensors for NO2 detection [J]. Advanced Functional Materials, 2020,30(50):2006598-2006606.
[3] ROGACKA J, SEREMAK A, FORMALIK F, et al. High-throughput screening of metal-organic frameworks for CO2 and CH4 separation in the presence of water [J]. Chemical Engineering Journal, 2021,403(7):126392-126403.
[4] ORCAJO G, ANDRES H M, VILLAJOS J A, el al. Li-crown ether complex inclusion in MOF materials for enhanced H2 volumetric storage capacity at room temperature [J]. International Journal of Hydrogen Energy, 2018,44(35):19285-19293.
[5] SUN H, YU X L, MA X Y, et al. MnOx-CeO2 catalyst derived from metal-organic frameworks for toluene oxidation [J]. Catalysis Today, 2019,355(15):580-586.
[6] ZHONG H X, ZHANG Q, WANG J, et al. Engineering ultrathin C3N4 quantum dots on graphene as a metal-free water reduction electrocatalyst [J]. ACS Catalysis, 2018,8(5):3965-3970.
[7] JAVANBAKHT S, HEMMATI A, NAMAZI H, et al. Carboxymethylcellulose-coated 5-fluorouracil@MOF-5 nano-hybrid as a bio-nanocomposite carrier for the anticancer oral delivery [J]. International Journal of Biological Macromolecules, 2020, 155(15):876-882.
[8] WANG M X, ZHOU X, LI Y H, et al. Triple-synergistic MOF-nanozyme for efficient antibacterial treatment [J]. Bioactive Materials, 2022,17(12):289-299.
[9] AN J Y, GEIB S J, ROSI N L. Cation-triggered drug release from a porous zincadeninate metal organic framework [J]. American Chemical Society, 2009,131(24):8376-8377.
[10] WANG W W, PAN X T, YANG Y L, et al. Bioactive metal-organic frameworks with specific metal-nitrogen (M-N) active sites for efficient sonodynamic tumor therapy [J]. ACS Nano, 2021,15(12):20003-20012.
[11] LU S T, TIAN H L, LI L, et al. Nanoengineering a zeolitic imidazolate framework-8 capable of manipulating energy metabolism against cancer chemo-phototherapy resistance [J]. Small, 2022,18(48):2204926.
[12] HU G F, YANG L L, LI Y, et al. Continuous and scalable fabrication of stable and biocompatible MOF@SiO2 nanoparticles for drug loading [J]. Journal of Materials Chemistry B, 2018,6(47):7936-7942.
[13] POORESMAEIL M, HASSAM N. Surface modification of graphene oxide with stimuli-responsive polymer brush containing β-cyclodextrin as a pendant group: preparation, characterization, and evaluation as controlled drug delivery agent [J]. Biointerfaces, 2018,172(8):17-25.
[14] WANG C D, LI Z P, X P, et al. Combination of polythyleneimine regulating autophagy prodrug and Mdr1 siRNA for tumor multidrug resistance [J]. Journal of Nanobiotechnology, 2022,476(20):1-19.
[15] LIN M, GAO Y, DIEFENBACH T J, et al. Facial layer-by-layer engineering of upconversion nanoparticles for gene delivery: near-infrared-initiated fluorescence resonance energy transfer tracking and overcoming drug resistance in ovarian cancer [J]. ACS Applied Materials & Interfaces, 2017,9(9):7941-7949.
[16] PAN Q S, CHEN T T, NIE C P, et al. In situ synthesis of ultrathin ZIF-8 film-coated MSNs for codelivering BCl2 siRNA and doxorubicin to enhance chemotherapeutic efficacy in drug-resistant cancer cells [J]. ACS Applied Materials & Interfaces, 2018,10(39):3070-33077.
[17] XIAO Z X, CHEN Q H, YANG Y Q, et al. State of the art advancements in sonodynamic therapy (SDT): metal-organic frameworks for SDT [J]. Chemical Engineering Journal, 2022,449(7):137889-137905.
[18] ZHU J, CHU C C, LI D S, et al. Fe(Ⅲ)-porphyrin sonotheranostics: a green triple-regulated ROS generation nanoplatform for enhanced cancer imaging and therapy [J]. Advanced Functional Materials, 2019,29(36):1904056.
[19] SUNG H W, SIBORO P Y, MIAO Y B, et al. Ultrasound-activated, tumor-specific in situ synthesis of a chemotherapeutic agent using ZIF-8 nanoreactors for precision cancer therapy [J]. ACS Nano, 2022,16(8):12403-12414.
[20] CHOI J, SUN I, HWANG H S, et al. Light-triggered photodynamic nanomedicines for overcoming localized therapeutic efficacy in cancer treatment [J]. Advanced Drug Delivery Reviews, 2022,186(5):114344.
[21] SARBADHIKARY P, GEORGE B P, ABRAHAMSE H. Recent advances in photosensitizers as multifunctional theranostic agents for imaging-guided photodynamic therapy of cancer [J]. Theranostics, 2021,11(18):9054-9088.
[22] HE H Z, DU L H, XUE H M, et al. Programmable therapeutic nanoscale covalent organic framework for photodynamic therapy and hypoxia-activated cascade chemotherapy [J]. Acta Biomaterialia, 2022,149(9):297-306.
[23] YUAN Z T, LIANG X, ZHAN Y P, et al. Targeting CD133 reverses drug-resistance via the AKT/NF-κB/MDR1 pathway in colorectal cancer [J]. British Journal of Cancer, 2020,122(3):1342-1353.
[24] ZHANG G T, CHENG W T, DU L, et al. Synergy of hypoxia relief and heat shock protein inhibition for phototherapy enhancement [J]. Journal of Nanobiotechnology, 2021,19(9):2-13.
(責任编辑:郁慧,顾浩然)

