饮用水中的微塑料及其拉曼光谱检测技术研究进展


收稿日期:2023-09-01;修回日期:2023-10-07。
基金项目:国家自然科学基金项目(81471703, 61675044);福建省重大专项专题项目(2021YZ040012)。
作者简介:崔胜东,博士研究生。
* 通信作者:黄正,教授,主要从事生物医学光子学和光医学研究。E-mail: huangz@fjnu.edu.cn。
崔胜东 李永增 彭伟金 柯城 张先增 王敏 黄正
摘 要:塑料的发明和应用已逾百年,给日常生活带来了极大的便利。塑料制品及成分经过破碎降解后形成微塑料(MPs),环境中的MPs可进入饮用水,其污染和潜在的健康危害逐渐受到重视。MPs的定性和定量检测仍处于发展阶段,拉曼光谱(RS)是目前较常用的一种较灵敏的非破坏性的无损光学分析技术。本文重点介绍了饮用水中MPs的来源、潜在危害以及RS检测的研究进展,旨在提高对饮用水中MPs污染的认知和对研发MPs检测技术的重视。
关键词:微塑料;饮用水;危害;拉曼光谱;检测
中图分类号:O657.37 文献标志码:ADOI:10.3969/j.issn.1007-7146.2024.01.002
Microplastics in Drinking Water and Research Progress of Raman Spectroscopy Detection Technique
CUI Shengdong, LI Yongzeng, PENG Weijin, KE Cheng, ZHANG Xianzeng, WANG Min, HUANG Zheng*
(MOE Key Laboratory of Medical Optoelectronics Science and Technology, Key Laboratory of Photonics Technology of Fujian Province, School of Optoelectronics and Information Engineering, Fujian Normal University, Fuzhou 350007, China)
Abstract: Plastics were invented a century ago and utilized by human being ever since, which bring tremendous convenience to our daily life. Plastic products and constituents can break down into microplastics (MPs) while undergoing combined physical, chemical, and biological processes. MPs in the environments might enter into the drinking water. Such contamination and potential health risks gradually become concerns. The qualitative and quantitative detection of MPs is still in its developmental stage. Raman spectroscopy (RS) is one of the commonly used sensitive, non-invasive and non-destructive optical methods in MPs analysis. This article primarily focuses on the sources, potential hazards of MPs in drinking water, and research advancements in RS technology, in order to promote better understanding of MPs contamination and drawattention to the research and development of MPs detection technology.
Key words: microplastics; drinking water; hazards; Raman spectroscopy; detection
(Acta Laser Biology Sinica, 2024, 33(1): 014-023)
塑料(plastic)是常溫下可保持形状不变的高分子材料(macromolecules),主要成分是天然或合成树脂,通过添加各种助剂,在一定温度和压力条件下塑制成一定的形状。1907年,Leo Baekeland 发明酚醛树脂开启了塑料时代,至今,人类使用塑料已有百余年。塑料给人们的生活带来了极大的便利,但由于其难以分解,废弃塑料造成的“白色污染”日益严重。Thompson等[1]于2004年首次提出微塑料(micro-plastics,MPs)的概念,MPs的污染和潜在的危害逐渐受到重视。2014年,联合国环境大会将海洋塑料垃圾污染列为“十大紧迫环境问题之一”。不仅仅是海洋,研究显示,陆地上的MPs也已进入饮用水(drinking water)。一项对全球多个城市的150多个自来水(tap water)样品的检测结果显示,81%的水样含有MPs成分[2];2017年的一份饮用水检测结果显示,有83%的饮用水样含有MPs,表明陆地水源已受到MPs污染[3]。2019年,世界卫生组织(World Health Organization,WHO)在《饮用水中的微塑料》报告中指出:目前在饮用水(包括瓶装水和自来水)、空气、食品、淡水、海水、废水中都能检测到MPs[4]。
MPs污染程度尚难以有效量化,目前还没有形成MPs定性和定量检测的标准方法。取样、样品制备、检测以及鉴定技术仍处于发展阶段。文献中报道的MPs浓度和颗粒大小常有几个数量级的差异[5]。报道的分析方法包括拉曼光谱(Raman spectroscopy,RS)、傅里叶变换红外光谱(Fourier transform infrared spectrometry,FTIR)、衰减全反射傅里叶变换红外光谱(attenuated total reflection-Fourier transform infrared spectrometry,ATR-FTIR)、热解气相色谱-质谱法(pyrolysis-gas chromatography-mass spectrometry,PY-GC-MS)和热萃取-气相色谱/质谱联用技术(thermal extraction desorption-gas chromatography mass-spectrometry,TED-GC-MS)等[6-9]。RS和FTIR通过振动指纹识别MPs颗粒,且可提供聚合物的分子结构信息,而其他方法则依赖于单体、聚合物或添加剂的质谱信息。本文重点介绍饮用水中MPs的来源、潜在危害以及拉曼检测方面的研究进展。
1 MPs简介
MPs的定义尚未统一。2009年,美国国家海洋和大气管理局将其定义为直径<5 mm的所有形式的塑料颗粒[10]。目前,国内外学者通常将尺寸在0.1 ?m~5 mm的塑料颗粒、纤维或者薄膜归类为MPs[11]。可再生材料、生物降解和生物合成的生物塑料(bioplastics)也可形成MPs[12]。实际上很多MPs尺寸小至纳米级,也称为纳米塑料(nano-plastics,NPs)。
生产制造的微观尺寸的MPs被定义为一级或初级(primary)MPs,如广泛用于化妆品、防晒霜、沐浴露、牙膏和洗面奶中的配方成分,合成纺织品和服装生产过程中释放的微纤维等。二级或次级(secondary)MPs大多为大型塑料碎片在遭受紫外线辐射和机械磨损时,经过物理、化学和生物的综合过程破碎降解后的微小碎片,它们可从海岸线、河流和污水管道直接输送到人类的生活环境中[13]。
对饮用水处理厂的水样本以及用户端水样本的检测结果显示,有1/3的MPs颗粒是合成聚合物,主要有丙烯酸(acrylic)、醇酸(alkyd)、聚(乙烯:丙烯)[poly(ethylene:propylene)]、聚酰胺(polyamide,PA)、聚酯(polyester)、聚乙烯(polyethylene,PE)、聚甲基丙烯酸酯(poly-methyl acrylate)、聚丙烯(polypropylene,PP)和聚乙烯醇(polyvinyl-alcohol)[1]。我国北方某重要水源区浅层地下水中发现至少含有7种MPs,主要为PE、聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)、聚苯乙烯(polystyrene,PS)和生物降解材料,如聚乳酸(polylactic acid,PLA)[14]。
2 人体中MPs的来源及危害
2.1 饮用水中MPs的主要来源
虽然淡水体受到的MPs污染较少,地下水的MPs丰度也很低,但饮用水中已发现MPs,供水链中的MPs颗粒可能通过饮水过程摄入人体[15]。饮用水中的MPs可能来自受污染的淡水资源,也可能来自供水系统,如水处理厂储罐涂的环氧树脂、塑料管道中的聚氯乙烯(polyvinyl chloride,PVC)或PE和配件中PA的长时间磨损导致的塑料颗粒[6]。
瓶装水中MPs的主要来源是瓶体材料或瓶盖的磨损。瓶装矿泉水(bottled mineral water)一般以城市自来水或者水质较好的地表天然水作为水源,经处理包装后直接装瓶。挪威的一项研究发现,每升瓶装水(bottled water)中平均有10.4个大小为6.5 ?m~100 ?m的MPs,主要是瓶盖常用塑料成分PP[3]。玻璃瓶装水中MPs潜在来源是塑料瓶盖的磨损[16]。塑料瓶装气泡水(sparkling water)的压力高于静水,会增加塑料颗粒的释放;回收过程中塑料包装材料的磨损大大增加了MPs颗粒的产生,可回收矿泉水瓶中的MPs大约是一次性矿泉水瓶中的10倍[17]。
瓶装水中MPs的另外一个来源是瓶身上标签的色素颗粒,其主要成分是二氧化钛、蓝色颜料PB15、抗氧化添加劑颗粒和材料老化形成的颗粒。其中90%颗粒的粒径小于5 ?m, 40%颗粒的粒径小于1.5 ?m。塑料标签或者纸质标签与洗涤液直接接触可使颜料颗粒进入瓶子,一般的冲洗步骤还清除不了瓶内的颜料颗粒[18]。
2.2 MPs进入人体的其他方式
除经饮水外,MPs还可以通过食物摄取、空气吸入和皮肤接触等途径进入人体。由于海洋可以作为塑料废弃物的最终存储库,而生活在海洋中的大多数鱼类和双壳类都是人类的重要食物来源[19],摄入含MPs或NPs的海洋产品会增加其在人体中的积累。
一些食品或烹饪产品(罐头食品、食盐、啤酒、蜂蜜、糖),甚至塑料包装的食品中也发现了MPs[20],推测是源于食品制造过程中产生的MPs纤维的污染。
MPs和NPs可以通过空气吸入进入人体。MPs在室外占据的比例较小,但在室内空气颗粒物中占据不可忽略的比例[21]。暴露于空气中24 h后,人体的手和面部皮肤及头发表面即可检测到MPs颗粒[22]。皮肤与空气中的MPs长时间接触会导致MPs颗粒渗透,渗透程度取决于颗粒的大小和浓度。
2.3 MPs的潜在危害
MPs颗粒可通过多种途径进入人体,MPs的风险评估是一项不可或缺的工作。细胞和动物研究表明,摄入或吸入的MPs不能被降解,有可能造成多种生物效应,包括物理(颗粒)毒性、氧化应激、细胞因子分泌、细胞损伤、炎症、免疫反应等。
2.3.1 对胃部的影响
MPs进入胃中可能会造成消化不良、胃损伤和炎症。体外研究表明,NPs可诱导细胞氧化应激、凋亡和自噬细胞死亡[11]。将PE-MPs与幽门螺旋杆菌(Helicobocton pyloni)混合植入BALB/c小鼠(Mus musculus)体内,发现其胃器官指数、髓过氧化物酶(myeloperoxidase,MPO)、白介素-6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平最高。这表明,MPs与幽门螺旋杆菌相互作用促进了细菌在小鼠胃黏膜上皮细胞的快速生长和繁衍,提高了MPs进入组织的效率,促使小鼠产生了胃损伤和炎症,推测MPs可能为幽门螺杆菌提供了栖息地,并与其协同作用[23]。
2.3.2 对肠道的影响
饮用水和食物摄入的MPs和NPs颗粒会通过肠道吸收进入血液和淋巴系统。暴露于MPs颗粒环境中的肠上皮细胞会发生变形和紊乱,破坏肠道屏障的完整性和损害黏液屏障。有报告显示,粒径>150 μm的MPs不太可能被人体吸收,但纳米级(粒径<0.1 μm)的NPs可以通过饮用水被肠胃吸收,且在高浓度时引发炎症等症状[4]。
2.3.3 对肝脏的影响
经肠道吸收的MPs可通过血液和淋巴系统进入肝脏,导致肝脏脂质代谢紊乱,如甘油三脂(triglyceride,TG)和总胆固醇(total cholesterol,T-CHO)显著降低[24]。MPs的积累会导致能量和脂质代谢中断,诱导氧化应激和神经毒性反应。小鼠食用MPs后,身体重量较对照组明显减少,且细胞器存在明显受损的现象。将小鼠暴露于MPs环境5周可导致肝脏和脂质重量降低,肝脏中的TG和T-CHO均有所降低[25]。脂肪酸处理的肝脏器官模型研究证明了MPs是诱导肝脏毒性和脂肪毒性的潜在机制,并观察到MPs可增加肝细胞核因子4和细胞色素P450 2E1的表达。MPs除了可导致肝脏脂肪变性,对肝纤维化和肝癌也有潜在风险[26]。
2.3.4 对肺部的影响
肺泡具有<5 μm的气-血屏障和较大的表面积,是MPs颗粒的最佳吸附位置,因此,吸入的MPs或NPs颗粒主要集中在肺部。吸入肺部的颗粒不能被生物降解,一旦吸入,MPs颗粒会长期积聚在肺组织中[27]。长期接触MPs颗粒会导致肺部疾病,包括哮喘和尘肺病等[28]。流行病学研究显示,相关环境颗粒暴露研究中观察到的结果与暴露于大量塑料环境中的纺织行业工人的肺部损伤相似,包括炎症、纤维化和过敏等[16]。
2.3.5 对生殖系统、心血管系统、神经系统的影响
MPs会导致代谢紊乱和内分泌系统失衡,从而影响生殖系统。小鼠食用MPs后,平均每只母鼠产幼崽的数量、幼崽的性别比和幼崽的体质量均可发生显著变化[25]。聚碳酸酯和环氧树脂NPs会释放有害化学物质双酚A(bisphenol A,BPA),进入身体后会引起全身性炎症,同时会影响内分泌系统,导致激素失调。
MPs和NPs颗粒可能会伤害心血管系统。在斑马鱼(Danio rerio)的研究中发现,NPs颗粒主要积聚在心包囊,且在浓度较高的情况下观察到斑马鱼的心率下降了5%~10%[29]。
MPs可能从环境中吸附有机磷阻燃剂(organophosphate flame retardants,OPFRs),当它们被生物体摄入时,会引起综合毒性,诱导产生更大的氧化应激和神经毒性,从而影响神经系统功能[30]。
2.3.6 细胞毒性
MPs和NPs理化毒性的体外试验研究多采用人源细胞,如血细胞、成纤维细胞和癌细胞等细胞模型[31]。
Goodman等[27]將培养的人类肺泡A549细胞暴露于直径为1 μm和10 μm的MPs中,发现两种不同尺寸的MPs都会影响细胞增殖,但细胞毒性较小,在72 h后细胞吸收多个1 μm的MPs,细胞形态发生改变。Choi等[32]在研究中发现,人外周血单核细胞和成纤维细胞的物理毒性受颗粒浓度和粗糙度的影响,化学毒性由MPs中的化学物质引起,MPs释放的化学物质使免疫细胞的急性炎症反应增加了20倍,并促进了活性氧(reactive oxygen species,ROS)的产生和细胞死亡,而癌细胞的耐受性较正常细胞要强。Florance等[33]对小鼠巨噬细胞的研究发现,50 μg/mL的NPs可导致巨噬细胞分化为泡沫细胞,100 μg/mL和200 μg/mL的NPs会导致ROS增多、损害巨噬细胞中的溶酶体和诱导脂质积累。Forte等[34]对胃腺癌细胞的研究发现,44 nm的NPs在胃腺癌细胞的细胞质中的积累比100 nm的NPs更快,NPs积累会影响细胞活力和细胞形态,44 nm的NPs可诱导胃病中的细胞因子IL-6和IL-8上调。
3 饮用水中MPs的RS检测与分析
3.1 RS基本原理
1928年,印度科学家拉曼(C. V. Raman)发现,当入射光照射在液体表面时大部分光会发生弹性散射,极少一部分发生非弹性散射。弹性散射光与激发光波长相同,称为瑞利散射(Rayleigh scattering);非弹性散射光的波长会发生改变,其波长的改变由测试样品的化学结构所决定,这部分散射光称为拉曼散射(Raman scattering)。拉曼因这一重要发现获得了1930年的诺贝尔物理学奖。
如图1所示,当处于振动基态E0的分子受到能量为hυ0入射光的激发,跃迁至受激虚能级E0+ hυ0,由于虚能级不稳定,分子立即回到基态E0,产生能量为hυ0的散射光。同样地,处于振动激发态E1的分子受到入射光激发后,立即跃迁至受激虚能级E1+hυ0,又立刻回到振动激发态E1,也发出能量为hυ0的散射光。这种瑞利散射光没有发生能量改变。如果处于振动基态E0的分子在被入射光激发跃迁至受激虚能级后,没有跃迁回原本的振动基态E0,而是跃迁至振动激发态E1,此时,产生能量为Er1(hυ0-hΔυ)的散射光,称为斯托克斯拉曼散射(Stokes-Raman scattering)。同理,原本处于振动激发态E1的分子,在被能量为hυ0的光子激发跃迁至受激虚能级E1+hυ0后,跃迁到振动基态E0,这时,则会产生能量为Er2(hυ0+hΔυ)的散射光,称为反斯托克斯拉曼散射(anti-Stokes Raman scattering)。
一定频率的激发光与物质相互作用时,其非弹性散射光的波长变化仅由物质的种类和化学结构等决定,利用这种“拉曼指纹”特性可以获得样品化学结构、相和形态、结晶度以及分子相互作用的丰富信息。RS检测技术具有样本预处理简单、灵敏度高、无损和快速等优点。由于水的RS非常微弱,因此,RS特别适合应用于水样中的MPs成分的检测。
拉曼散射截面小的样品信号容易被背景荧光淹没,如果样品吸附在粗糙银基底表面上,其拉曼散射信号会得到显著增强,这种增强效应称为表面增强拉曼散射(surface-enhanced Raman scattering,SERS)[36]。SERS技术增大了拉曼散射截面,通过在金属(多为金、银等贵金属)或半导体表面制备纳米结构,可大幅提高样品的拉曼信号强度,很大程度上避免了荧光背景的干扰,从而实现对微量物质的高灵敏度检测,也是MPs检测中常用的技术[37]。
RS与颗粒分析仪、高分辨显微镜和共焦显微技术联合使用则可获得水样中MPs颗粒的数量、形状、大小和分子化学结构等更多信息。
颗粒分析仪无需对颗粒标记,并能够自动对识别的颗粒进行分析,如单粒子探测器(single particle explorer,SPE)。SPE结合RS可获得水中MPs颗粒的数量、形状、大小以及单个MPs颗粒的“光谱指纹”等信息。使用SPE每次最多可分析5 000个颗粒,可识别的最小尺寸为1 ?m[17]。
由于水中的MPs颗粒尺寸小,通常需要通过高分辨显微镜观察和成像。RS结合图像分析技术,可用于水样MPs的鉴别。拉曼光谱成像是一种结合RS和光学成像的混合模式,通过MPs的折射和反射等特性,经过光学成像获得MPs的形态和尺度信息,并通过采集空间中每个像素处的RS信息,将分子信息在空间上展现,并定性、定量与定位地分析MPs[38]。
共聚焦显微拉曼光谱是一种集成了共聚焦显微镜和拉曼光谱仪的高分辨率光学成像技术。其特点主要在于共聚焦孔被放置在共轭焦平面上,只有来自样品焦平面的RS信号才能被光谱仪检测到,因此,系统具有极高的轴向和横向空间分辨率[39]。同时,若结合使用高精度的xyz三维平台,可实现逐点扫描,获得MPs的高分辨率图像。RS与共焦显微技术结合,不仅可以实现对样品的光谱检测,还可以实现MPs样品形态的三维成像[40]。
3.2 RS检测
3.2.1 样本处理
在取样、制备和分析过程中减少样品污染风险和避免外来因素的干扰非常重要,通常要使用过滤器对样品进行过滤、干燥并储存在密封容器中以防污染。如测量自来水中的MPs时,可先溶解碳酸钙、碳酸镁和铁沉淀物,然后用0.2 μm的氧化铝过滤器过滤,将过滤器干燥并存储在玻璃器皿中[41]。水样中的有机物可使用过氧化氢去除,采用玻璃真空过滤装置,通过孔径为5 μm和0.2 μm的聚四氟乙烯(polytetrafluoroethylene,PTFE)膜进行过滤,并将滤膜放入30℃的烤箱中干燥后放置在载玻片上进行RS分析[42]。试验人员应穿戴纯棉实验服和丁腈手套,所有材料在使用前都要用无MPs去离子水彻底清洗。试验溶液和玻璃器皿用铝箔覆盖,储存和运输过程中要避免空气污染。使用样本溶液反复清洗容器,以去除其他MPs污染,并避免使用塑料器皿[43]。
3.2.2 RS检测方法和结果
由于分子振动模式不同,通常有多个峰被激发,如在固体样品中会出现一些低频振动和高频振动,这些振动模式会在RS中表现为不同的峰。MPs的不同峰值代表不同的化学键和官能团,如PE的RS通常会在1 050 cm-1~1 150 cm-1有两个峰值,对应的是C-C拉伸振动,在1 296 cm-1、1 370 cm-1、1 448 cm-1、2 845 cm-1和2 886 cm-1处都有谱峰,分别代表CH2的扭曲、摆动、对称变形、对称拉伸和反对称拉伸[44]。
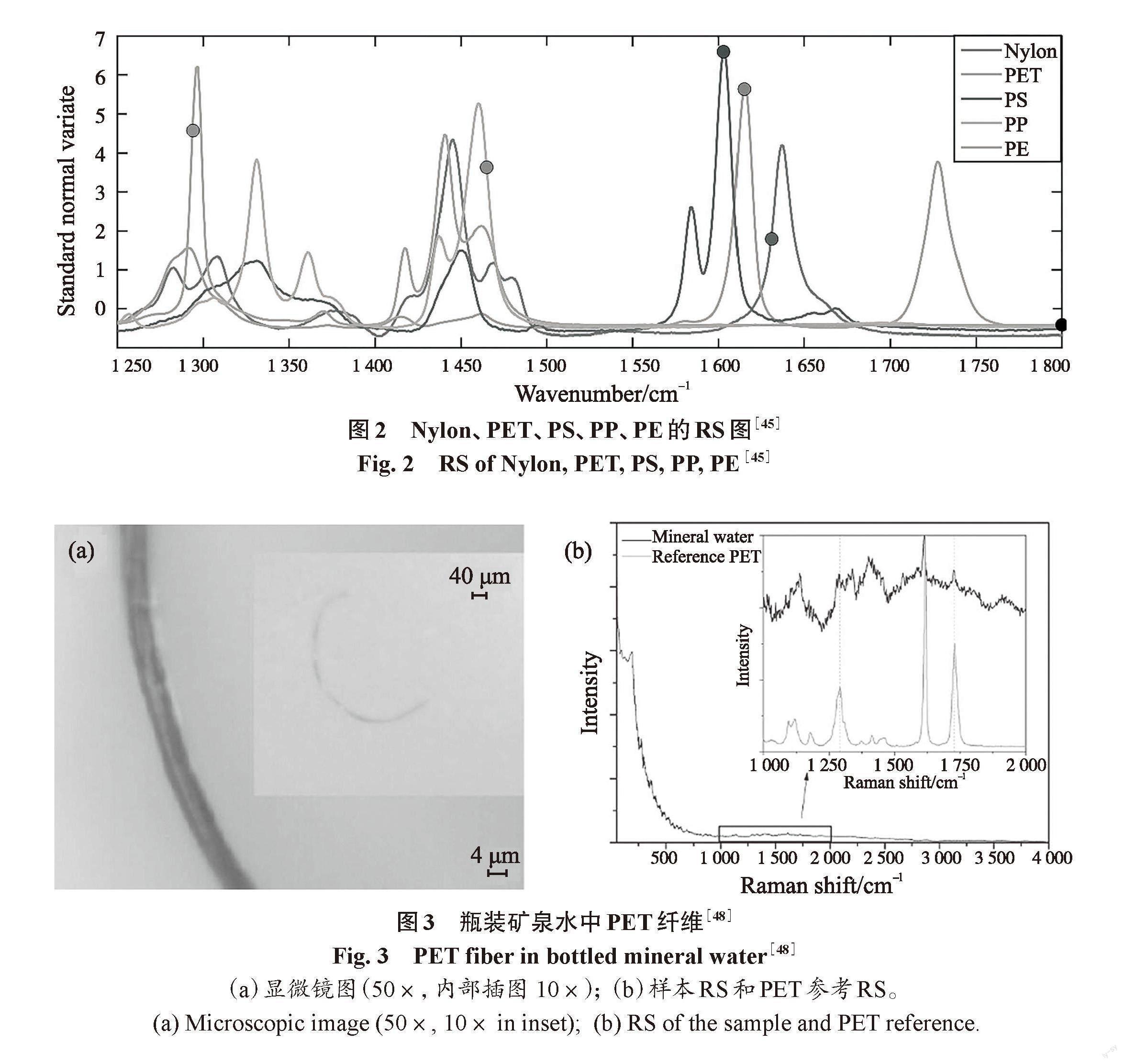
饮用水中MPs的主要聚合类型有PS、PP、PE和PET,其光谱数据如图2所示。这些聚合物的指纹区覆盖范围为200 cm-1~1 800 cm-1。从图中可以看出,由于聚合物的化学结构不同,每种聚合物的光谱指纹区所对应的峰值各有不同,其中Nylon、PET、PS、PP和PE的最大峰值分别为1 631 cm-1、1 615 cm-1、1 603 cm-1、1 465 cm-1和1 294 cm-1[45]。
需要注意的是,不同的激发波长、功率和放大倍数会影响识别MPs颗粒的尺寸大小以及所能识别的聚合物类型。Schymanski 等[17]使用波长为532 nm和785 nm,功率小于50 mW的RS和SPE对不同包装的矿泉水分析,检测出矿泉水中80%的MPs颗粒小于20 ?m,其主要聚合物为PET和PP。
Weber等[43]采用波长为785 nm,功率为20 mW,10倍物镜的共聚焦显微拉曼光谱仪检测出饮用水中最小尺寸为1 μm的PE、PP、PET、PA和PVC。Siegel等[46]使用波长为532 nm,功率为5 mW或10 mW,20倍物镜的共聚焦显微拉曼光谱仪检测出饮用水中最小尺寸为100 μm的PE、PP、PET、PA和PVC。Pittroff等 [47]使用波长为532 nm,功率为7.0 mW~15.5 mW,10倍或20倍的共聚焦显微拉曼光谱仪检测出最小尺寸为5 μm的PE、PP、PET和PA。
瓶装水和各种各样的气泡水、矿泉水已成为人类饮水的重要种类。瓶装水以城市自来水或者水质较好的地表天然水作为水源,经处理后直接装瓶,在装瓶或运输过程中,瓶体材料或瓶盖磨损可能会释放MPs。Wiesheu等[48]使用波长为532 nm、50倍放大物镜的共聚焦显微拉曼光谱系统检测瓶装矿泉水中MPs的種类及大小。如图3所示,瓶装矿泉水中MPs的拉曼光谱在1 296 cm-1、1 608 cm-1、1 717 cm-1等处有谱峰,这与参考PET的RS谱峰重合,表明瓶装矿泉水中存在PET纤维MPs,其他MPs主要还有PE、PS等,大小为1 ?m~5 000 μm。
Kankanige等[49]使用波长为672 nm的共聚焦显微拉曼光谱系统在瓶装水中检测出1 μm~50 μm的PET、PE、PP和PA。Schymanski等[17]分别使用10×、20×和 50×物镜,波长为532 nm和785 nm的功率可调显微拉曼光谱系统观察到装有气泡水的瓶子中的MPs颗粒较多,显示由于气泡水瓶中的较高压力会导致更多MPs颗粒释放。他们还在不同包装的矿泉水中检测到MPs颗粒的最小尺寸为5 μm,主要成分不仅包含常见聚合物,还发现了光谱类似 “蓝色丁腈手套”“氦原蓝”和“聚丙烯蓝瓶盖”的颗粒[17]。
饮用水中的MPs还可能来自受污染的淡水资源、饮用水处理厂的塑料管道、配件磨损。Pivokonsky等[42]使用波长为532 nm的共聚焦显微RS对从饮用水处理厂获得的原水和经过处理的水样本进行分析,在所有的样本中都发现了MPs,且95%的MPs粒径小于10 μm,主要为PE、PP、PET。值得注意的是,Tong等[41]使用波长为785 nm、50×物镜的共聚焦显微RS检测了从中国不同城市采集的38份自来水样本,结果显示,MPs粒径范围为3 ?m~4 453 μm,多数MPs粒径小于50 μm,主要成份是PE和PP。因此,自来水中MPs的存在不容忽视,应高度重视MPs的来源,尤其是小尺寸的MPs。
以上研究显示,使用共聚焦显微拉曼光谱能够检测饮用水中尺寸较小的MPs。表1列出了RS联合显微成像和图像分析技术检测出的各种水样的MPs粒子聚合物类型、尺寸大小和测量设备。可以看出,不同的研究组利用不同的系统和技术所检测出来的MPs化学物质有一定差异,表明在不同地域采集的样本所含有的MPs不一样,颗粒尺寸范围也较大。
国内外研究还显示,在水样MPs和NPs的检测和类别识别中,SERS有一定的优势,可大幅提高样品的RS信号强度,实现低浓度和小尺寸的MPs和NPs等微量物质的高灵敏度检测[51]。Zhang等[54]使用了一種具有三角形腔阵列的高效SERS有源基底,检测出瓶装水中最小尺寸为50.0 nm、平均尺寸为88.2 nm的PET-NPs,含量约为每毫升108个。Mikac等[51]制备了4种不同尺寸的金纳米颗粒(Au NPs)作为基底,利用SERS技术检测PE和PS颗粒制成的纯水样本。结果显示,PS颗粒具有稳定高效的SERS信号,且最低检测质量浓度为6.5 μg/mL,但很难获取PE颗粒的SERS信号 。对于PS的SERS检测,银更适合作为增强基底,金作为增强基底具有一定的挑战性,但与银相比,金在抗氧化性、生物相容性等方面具有一定的优势。
3.3 RS判别与分类
MPs的种类繁多,体积小且复杂,RS分析数据量非常大,同时背景复杂,光谱间差异较小,从复杂的光谱信号中提取微弱的有用信息,并建立满足需要的校正模型是定性和定量分析的关键。多元统计方法结合RS技术,利用处理后的光谱和待测属性值之间建立的多元校正模型,可对样本进行快速可靠地分类和识别,为复杂体系的无损、快速定量分析提供了一种新的手段。常用的多元统计处理方法一般包括特征提取、建立模型、分类和判别等步骤。常用的特征提取方法包括主成分分析(principal component analysis,PCA)和线性判别分析(linear discriminant analysis,LDA)。提取关键信息后,对光谱数据进行训练,并建立分类模型或识别模型,用于对新的光谱数据进行分类或识别。常见的分类和识别方法包括支持向量机(support vector machine,SVM)和卷积神经网络(convolutional neural networks,CNN)[55]。
Jin等[56]利用RS结合多元统计分析方法研究了7种不同MPs的RS,使用PCA、偏最小二乘法以及SVM对光谱进行判别分类。SVM对PP、PET、PVC、PC和PA的分类准确率超过 98%,对高密度聚乙烯和低密度聚乙烯的分类准确率超过70%。同时,他们测量了真实环境下矿泉水瓶和果汁瓶中的MPs样本,其判别灵敏度、特异性和准确度分别为98.1%,99.4%和99.1% 。Ren等[55]利用CNN判别了10种MPs的RS,最终结果表明,CNN的平均分类准确率可以达到96.43%和95.60%。因此,使用CNN能够建立高效的自动分析方法,准确地识别MPs。这些研究结果证明,RS与多元分析相结合是鉴别MPs类型的理想工具,在MPs自动检测方面具有巨大的潜力[57]。
3.4 RS检测的局限性
MPs颗粒和NPs颗粒的成分、大小、形状、密度和表面特性极其复杂多样,使用RS技术分析水样本中的MPs有一定的局限性。
3.4.1 光谱信号弱,荧光干扰强
常规RS技术的信号本身很弱,强度很低,比荧光信号的效率低6到10个数量级[58]。荧光干扰是RS分析中信号质量差的主要原因之一,因此,对样本进行光漂白和荧光淬灭是有必要的。如Liu 等[59]使用芬顿试剂的4种催化剂(Fe2+、Fe3+、Fe3O4和K2Fe4O7)处理MPs可以消除MPs中的荧光信号。
3.4.2 检测粒子大小受到限制
RS可以检测到>10 μm的MPs,而显微RS可以检测到<1 μm的MPs[60]。RS的局限性阻碍了对纳米级(<100 nm)塑料颗粒的化学鉴定,从而导致所分析样品的信息不完整。使用SERS可以检测到小于100 nm的NPs,如Zhang等[54]使用SERS技术检测出瓶装水中最小尺寸为50 nm的NPs。因此,继续开发和改进能够有效分析NPs颗粒以及其他塑料污染物的先进技术是有必要的。
3.4.3 基底的制备没有统一的方法
虽然SERS能够放大RS信号的强度,提供一种低浓度分析物检测的替代方法,但SERS也有局限性。首先,不同的基底产生增强因子的变化取决于等离子体金属纳米结构,当分析物处于复杂的基底中时缺乏选择性。其次,SERS测量中的一个主要问题是“热点”的不均匀空间分布和样品在基底中的不均匀分布而导致检测的不可靠[61]。所报道的 SERS 基底的制备都是为特定类型的样品而设计的,这表明利用 SERS 检测MPs和NPs的方法缺乏标准化。将各种 SERS 基底进行比较具有一定的挑战性,对它们进行严格表征是非常复杂的过程[62]。尚需进一步研究具有可重复性、可靠的SERS活性基底,将其用于复杂样品的研究,并对复杂基质中的MPs和NPs进行超灵敏检测。
3.4.4 缺乏准确、智能的数据处理方法
从复杂MPs的RS信号中提取微弱有用信息,并建立满足需要的判别和智能分类模型是目前该技术进行定性和定量分析的关键,直接决定该项技术的可用性。已有较多的文献报道了多元统计分析方法和机器学习用于MPs的RS数据分类与识别,但多数是针对特定样本进行处理,缺乏通用性和智能化。
4 总结与展望
MPs是塑料经过物理、化学和生物作用破碎降解形成的。国内外研究均显示,饮用水中可检测到MPs颗粒。除了经饮水途径,MPs还可以通过食物摄取、空气吸入和皮肤接触等途径进入人体,因此,MPs对健康的危害要综合考量。MPs的合成聚合物成分不能被降解,有可能造成多种生物效应,如物理毒性、氧化应激、细胞因子分泌、细胞损伤、炎症和免疫反应、DNA损伤,以及神经毒性和代谢效应等。需要指出的是,观察到的效应通常是在高浓度的MPs暴露下触发的,而这些试验使用的是原始颗粒类型,与环境中实际遇到的颗粒类型不一致。此外,这些测试颗粒可能存在化学污染。
环境中的MPs可能进入食物链和饮用水,其污染和潜在健康危害逐渐受到学术界、监管部门和大众的重视。2014年,联合国环境大会将MPs污染列为与全球气候变化、臭氧耗竭等并列的重大全球环境问题。但值得一提的是,2019年WHO发表的《饮用水中MPs》报告指出:基于现有的研究结果,饮用水中的MPs对人类健康尚影响不大;强调塑料表面易形成生物膜,相关的微生物病原体的危害则需要重视;并认为目前还没有必要对饮用水中的MPs进行常规监测[4]。同年,欧洲科学院政策科学顾问委员会(Science Advice for Policy by European Academies,SAPEA)在其《关于自然与社会中微塑料的一种科学视角》报告中也指出,目前对MPs的健康危害所知甚少,同时也强调应更加关注如何减少塑料污染和使用危害少的材料[63]。
無论如何,更合理地制定塑料战略,更好地管理塑料废弃物,以避免其污染陆地和海洋生态系统已成为全球共识,对MPs进行识别、量化以及去除是非常有必要的。MPs污染程度以及风险评估尚难以有效量化,文献中报道的MPs浓度和颗粒大小常有几个数量级的差异。国内外目前还没有形成标准的MPs的定性和定量检测方法,取样、样品制备、检测以及鉴定技术仍处于发展阶段。
RS技术以其信息丰富、制样简单、水的干扰小等独特优点,在MPs的检测中具有很多独特的优势。RS技术和SERS技术已成为MPs检测和多尺度识别的重要工具,已有较多国内外研究人员报道其用于检测和识别水生环境中的MPs和NPs。尤其是SERS技术,能在较短时间内获取低质量浓度(ng/mL)MPs的拉曼光谱,灵敏度极高,在水样的MPs的检测中具有非破坏性和无损性等优势。但目前所报道的 SERS 基底大部分都是为特定类型的样品而设计。新型SERS基底材料和结构的选择与制备显得尤其重要,开发具有重现性好、性能稳定的新型SERS基底,已成为SERS用于MPs光学检测的重要研究内容和发展方向。扩大SERS应用范围,提高SERS检测灵敏度,以提高MPs检测类型、浓度和尺寸的极限,有助于更深入地了解MPs的来源、去向以及对人类健康的影响。
MPs的种类繁多、体积小且成分复杂,RS数据量非常大,背景复杂,光谱间差异较小,难以直接提取到有用数据。利用多元统计处理方法结合机器学习对光谱数据进行特征提取,可减少数据维度,提高从复杂的数据中提取关键信息的效率,实现对MPs颗粒的快速判别与定性分析。为了实现对饮用水中的MPs的常规检测,构建低成本、高灵敏度的RS检测系统和智能分析系统一体化的自动综合分析平台显得十分必要。
参考文献(References):
[1] THOMPSON R C, OLEN Y, MITCHELL R P, et al. Lost at sea: where is all the plastic?[J]. Science, 2004, 304(5672): 838.
[2] EERKES-MEDRANO D, LESLIE H A, QUINN B. Microplastics in drinking water: a review and assessment[J]. Current Opinion in Environmental Science & Health, 2019, 7: 69-75.
[3] Norwegian Water Report. Mapping microplastic in Norwegian drinking water[R/OL]. (2018-10-21)[2022-12-20]. https://www. researchgate. net/publication/328412920_Mapping_
microplastic_in_Norwegian_drinking_water_Norsk_Vann_Report_2412018.
[4] World Health Organization. Microplastics in drinking water[R/OL]. (2019-08-28)[2022-06-15]. https://www.who.int/publications/i/item/9789241516198.
[5] IVLEVA N P, WIESHEU A C, NIESSNER R. Microplastic in aquatic ecosystems[J]. Angewandte Chemie International Edition, 2017, 56(7): 1720-1739.
[6] MINTENIG S M, L?DER M G J, PRIMPKE S, et al. Low numbers of microplastics detected in drinking water from ground water sources[J]. Science of the Total Environment, 2019, 648: 631-635.
[7] MASON S A, WELCH V G, NERATKO J. Synthetic polymer contamination in bottled water[J]. Frontiers in Chemistry, 2018, 6: 407.
[8] FISCHER M, SCHOLZ-B?TTCHER B M. Simultaneous trace identification and quantification of common types of microplastics in environmental samples by pyrolysis-gas chromatography: mass spectrometry[J]. Environmental Science & Technology, 2017, 51(9): 5052-5060.
[9] D?MICHEN E, EISENTRAUT P, BANNICK C G, et al. Fast identification of microplastics in complex environmental samples by a thermal degradation method[J]. Chemosphere, 2017, 174: 572-584.
[10] THOMPSON R C, MOORE C J, VOM SAAL F S, et al. Plastics, the environment and human health: current consensus and future trends[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 2009, 364(1526): 2153-2166.
[11] YEE M S L, HII L W, LOOI C K, et al. Impact of microplastics and nanoplastics on human health[J]. Nanomaterials, 2021, 11(2): 496.
[12] ROSENBOOM J G, LANGER R, TRAVERSO G. Bioplastics for a circular economy[J]. Nature Reviews Materials, 2022, 7(2): 117-137.
[13] WANG J, ZHENG L, LI J. A critical review on the sources and instruments of marine microplastics and prospects on the relevant management in China[J]. Waste Management & Research, 2018, 36(10): 898-911.
[14] WU B, LI L W, ZU Y X, et al. Microplastics contamination in groundwater of a drinking-water source area, northern China[J]. Environmental Research, 2022, 214(Pt 3): 114048.
[15] ZHANG Q, XU E G, LI J, et al. A review of microplastics in table salt, drinking water, and air: direct human exposure[J]. Environmental Science & Technology, 2020, 54(7): 3740-3751.
[16] VETHAAK A D, LEGLER J. Microplastics and human health[J]. Science, 2021, 371(6530): 672-674.
[17] SCHYMANSKI D, GOLDBECK C, HUMPF H U, et al. Analysis of microplastics in water by micro-Raman spectroscopy: release of plastic particles from different packaging into mineral water[J]. Water Research, 2018, 129(4062): 154-162.
[18] OBMANN B E, SARAU G, HOLTMANNSP?TTER H, et al. Small-sized microplastics and pigmented particles in bottled mineral water[J]. Water Research, 2018, 141: 307-316.
[19] JIANG B, KAUFFMAN A E, LI L, et al. Health impacts of environmental contamination of micro-and nanoplastics: a review[J]. Environmental Health and Preventive Medicine, 2020, 25(1): 1-15.
[20] WARING R H, HARRIS R M, MITCHELL S C. Plastic contamination of the food chain: a threat to human health?[J]. Maturitas, 2018, 115: 64-68.
[21] VIANELLO A, JENSEN R L, LIU L, et al. Simulating human exposure to indoor airborne microplastics using a breathing thermal manikin[J]. Scientific Reports, 2019, 9(1): 1-11.
[22] ABBASI S, TURNER A. Human exposure to microplastics: a study in Iran[J]. Journal of Hazardous Materials, 2021, 403: 123799.
[23] TONG X, LI B, LI J, et al. Polyethylene microplastics cooperate with Helicobacter pylori to promote gastric injury and inflammation in mice[J]. Chemosphere, 2022, 288(1): 132579.
[24] DENG Y, ZHANG Y, LEMOS B, et al. Tissue accumulation of microplastics in mice and biomarker responses suggest widespread health risks of exposure[J]. Scientific Reports, 2017, 7(1): 46687.
[25] LUO T, ZHANG Y, WANG C, et al. Maternal exposure to different sizes of polystyrene microplastics during gestation causes metabolic disorders in their offspring[J]. Environmental Pollution, 2019, 255(Pt 1): 113122.
[26] CHENG W, LI X, ZHOU Y, et al. Polystyrene microplastics induce hepatotoxicity and disrupt lipid metabolism in the liver organoids[J]. Science of the Total Environment, 2022, 806(2): 150328.
[27] GOODMAN K E, HARE J T, KHAMIS Z I, et al. Exposure of human lung cells to polystyrene microplastics significantly retards cell proliferation and triggers morphological changes[J]. Chemical Research in Toxicology, 2021, 34(4): 1069-1081.
[28] RAHMAN A, SARKAR A, YADAV O P, et al. Potential human health risks due to environmental exposure to nano-and microplastics and knowledge gaps: a scoping review[J]. Science of the Total Environment, 2021, 757(9): 143872.
[29] DUAN Z, DUAN X, ZHAO S, et al. Barrier function of zebrafish embryonic chorions against microplastics and nanoplastics and its impact on embryo development[J]. Journal of Hazardous Materials, 2020, 395(4): 122621.
[30] DENG Y, ZHANG Y, QIAO R, et al. Evidence that microplastics aggravate the toxicity of organophosphorus flame retardants in mice (Mus musculus)[J]. Journal of Hazardous Materials, 2018, 357: 348-354.
[31] LY N H, KIM M K, LEE H, et al. Advanced microplastic monitoring using Raman spectroscopy with a combination of nanostructure-based substrates[J]. Journal of Nanostructure in Chemistry, 2022, 12(5): 865-888.
[32] CHOI D, BANG J, KIM T, et al. In vitro chemical and physical toxicities of polystyrene microfragments in human-derived cells[J]. Journal of Hazardous Materials, 2020, 400: 123308.
[33] FLORANCE I, RAMASUBBU S, MUKHERJEE A, et al. Polystyrene nanoplastics dysregulate lipid metabolism in murine macrophages in vitro[J]. Toxicology, 2021, 458: 152850.
[34] FORTE M, IACHETTA G, TUSSELLINO M, et al. Polystyrene nanoparticles internalization in human gastric adenocarcinoma cells[J]. Toxicology in Vitro, 2016, 31(2): 126-136.
[35] VASKOVA H. A powerful tool for material identification: Raman spectroscopy[J]. International Journal of Mathematical Models and Methods in Applied Science, 2011, 5(7): 1205-1212.
[36] FLEISCHMANN M, HENDRA P J, MCQUILLAN A J. Raman spectra of pyridine adsorbed at a silver electrode[J]. Chemical Physics Letters, 1974, 26(2): 163-166.
[37] V?LEZ-ESCAMILLA L Y, CONTRERAS-TORRES F F. Latest advances and developments to detection of micro- and nanoplastics using surface-enhanced Raman spectroscopy[J]. Particle Systems Characterization, 2022, 39(3): 2100217.
[38] FANG C, SOBHANI Z, ZHANG X, et al. Identification and visualisation of microplastics/nanoplastics by Raman imaging (iii): algorithm to cross-check multi-images[J]. Water Research, 2021, 194(1): 116913.
[39] TOPORSKI J, DIEING T, HOLLRICHER O. Confocal Raman microscopy[M]. Springer Serious in Surface Sciences, 2018, 66: 25-45.
[40] 尹亞宁, 王爽, 龚宇泽, 等. 皮肤组织显微共聚焦拉曼光谱成像研究[J]. 激光生物学报, 2016, 25(5): 391-397.
YIN Yaning, WANG Shuang, GONG Yuze, et al. A study on biochemical constitution of human skin tissue by confocal Raman microspectroscopy imaging[J]. Acta Laser Biology Sinica, 2016, 25(5): 391-397.
[41] TONG H, JIANG Q, HU X, et al. Occurrence and identification of microplastics in tap water from China[J]. Chemosphere, 2020, 252: 126493.
[42] PIVOKONSKY M, CERMAKOVA L, NOVOTNA K, et al. Occurrence of microplastics in raw and treated drinking water[J]. Science of the Total Environment, 2018, 643(1): 1644-1651.
[43] WEBER F, KERPEN J, WOLFF S, et al. Investigation of microplastics contamination in drinking water of a German city[J]. Science of the Total Environment, 2021, 755(Pt 2): 143421.
[44] PRATA J C, PA?O A, REIS V, et al. Identification of microplastics in white wines capped with polyethylene stoppers using micro-Raman spectroscopy[J]. Food Chemistry, 2020, 331(1): 127323.
[45] ARAUJO C F, NOLASCO M M, RIRBEIRO A M P, et al. Identification of microplastics using Raman spectroscopy: latest development and future prospects[J]. Water Research, 2018, 142(6): 426-440.
[46] SIEGEL H, FISCHER F, LENZ R, et al. Identification and quantification of microplastic particles in drinking water treatment sludge as an integrative approach to determine microplastic abundance in a freshwater river[J]. Environmental Pollution, 2021, 286(9): 117524.
[47] PITTROFF M, M?LLER Y K, WITZIG C S, et al. Microplastic analysis in drinking water based on fractionated filtration sampling and Raman microspectroscopy[J]. Environmental Science and Pollution Research, 2021, 28(42): 59439-59451.
[48] WIESHEU A C, ANGER P M, BAUMANN T, et al. Raman microspectroscopic analysis of fibers in beverages[J]. Analytical Methods, 2016, 8(28): 5722-5725.
[49] KANKANIGE D, BABEL S. Smaller-sized micro-plastics (MPs) contamination in single-use PET-bottled water in Thailand[J]. Science of the Total Environment, 2020, 717(1/2): 137232.
[50] SHRUTI V C, P?REZ-GUEVARA F, KUTRALAM-MUNIASAMY G. Metro station free drinking water fountain: a potential “microplastics hotspot” for human consumption[J]. Environmental Pollution, 2020, 261(12): 114227.
[51] MIKAC L, RIG? I, HIMICS L, et al. Surface-enhanced Raman spectroscopy for the detection of microplastics[J]. Applied Surface Science, 2023, 608(1526): 155239.
[52] BECUCCI M, MANCINI M, CAMPO R, et al. Microplastics in the florence wastewater treatment plant studied by a continuous sampling method and Raman spectroscopy: a preliminary investigation[J]. Science of the Total Environment, 2022, 808: 152025.
[53] WOLFF S, KERPEN J, PREDIGER J, et al. Determination of the microplastics emission in the effluent of a municipal waste water treatment plant using Raman microspectroscopy[J]. Water Research X, 2019, 2: 100014.
[54] ZHANG J, PENG M, LIAN E, et al. Identification of poly (ethylene terephthalate) nanoplastics in commercially bottled drinking water using surface-enhanced Raman spectroscopy[J]. Environment Science Technology, 2023, 57(22): 8365-8372.
[55] REN L H, LIU S, HUANG S, et al. Identification of microplastics using a convolutional neural network based on micro-Raman spectroscopy[J]. Talanta, 2023, 260(9): 124611.
[56] JIN N F, SONG Y Z, MA R, et al. Characterization and identification of microplastics using Raman spectroscopy coupled with multivariate analysis[J]. Analytica Chimica Acta, 2022, 1197: 339519.
[57] FENG Z K, ZHENG L, LIU J. Classification of household microplastics using a multi-model approach based on Raman spectroscopy[J]. Chemosphere, 2023, 325(5): 138312.
[58] FAKAYODE S, BAKER G, BWAMBOK D, et al. Molecular (Raman, NIR, and FTIR) spectroscopy and multivariate analysis in consumable products analysis[J]. Applied Spectroscopy Reviews, 2020, 55(8): 647-723.
[59] LIU Y, HU J, LIN L, et al. Overcoming the fluorescent interference during Raman spectroscopy detection of microplastics[J]. Total Environment, 2023, 897(17): 165333.
[60] SOBHANI Z, ZHANG X, GIBSON C, et al. Identification and visualisation of microplastics/nanoplastics by Raman imaging (i): down to 100 nm[J]. Water Resources, 2020, 174(4): 115658.
[61] LEE H K, LEE Y H, KOH C S L, et al. Designing surface-enhanced Raman scattering (SERS) platforms beyond hotspot engineering: emerging opportunities in analyte manipulations and hybrid materials[J]. Chemical Society Reviews, 2018, 48(3): 731-756.
[62] SHARMA B, CARDINAL M F, KLEINMAN S L, et al. High-performance SERS substrates: advances and challenges[J]. MRS Bulletin, 2013, 38(8): 615-624.
[63] Science Advice for Policy by European Academies. A scientific perspective on microplastics in nature and society[R/OL]. (2019-01-10)[2022-10-25]. https://www.researchgate.net/publication/332112857_A_scientific_perspective_on_microplastics_in_nature_and_society.

