体外生命支持技术在气管外科中的应用
——单中心经验
王怡凤,孙 林,周小宇,常 昕,徐凌峰,郭 震
接受危重气管手术患者,尽管围术期管理、麻醉和手术技术的进步极大地改善了手术成功率,但并发症和死亡率仍居高不下[1]。此类患者因气道梗阻、插管困难和侵犯粘连等在麻醉诱导和术中存在通气困难、视野不佳和出血等风险[2-3]。以体外循环(extracorporeal circulation, ECC)和体外膜氧合(extracorporeal membrane oxygenation,ECMO)为代表的体外生命支持(extracorporeal life support, ECLS)技术可提供充足的呼吸和循环支持,以维持手术期间气体交换和血流动力学稳定,保证手术安全[2,4]。ECC 作为一种传统的心肺支持方法,很早便用于危重气管手术的辅助,因顾虑其并发症和ECMO 技术的进展,近年来逐步转向ECMO 辅助[4-5]。ECMO 是ECC 技术的衍生,广泛应用于心肺衰竭的危重患者,在气管手术中可显著降低凝血功能紊乱、炎症反应、血液破坏等并发症。尽管越来越多的报道介绍了ECC 或ECMO 在危重气管外科中的应用,但多以个案和系列病例报道为主,缺乏有力的询证学依据以指导ECLS 技术的应用[6-7]。本研究回顾了2000 年至2020 年ECC、改良ECC 和ECMO 在危重气管外科手术中应用的适应证、并发症、细节管理和结果,以评价不同辅助模式的安全性和优势。
1 资料和方法
本回顾性研究的数据依托于年手术量超过20 000 例普胸手术,并具备20 年ECMO 临床管理经验的医院,并得到上海交通大学附属胸科医院伦理委员会的批准(KSY28713)。从2000 年1 月1 日至2020 年12 月31 日,所有接受ECMO或ECC 支持的气管外科手术患者均纳入本研究。通过对病历回顾,收集术前评估、术中ECLS 辅助模式和管理、动脉血气、抗凝策略、术中和术后并发症以及其他围手术期数据。
1.1术前评估所有患者术前均接受了包括胸外科、心外科、麻醉科、重症医学科和ECC 在内的多学科风险评估,以判断麻醉诱导和手术的安全性、ECLS 的必要性和管理策略。所有患者均接受了X 线和CT 检查,以评估气道压迫或狭窄的程度,气道狭窄部位的直径和长度,肿瘤的粘连和侵犯范围等。大多数患者接受了纤维支气管镜检查(fiberoptic bronchoscopy, FOB),以评估气管肿瘤侵犯程度和组织质地,考虑到FOB 评估期间气管损伤或肿瘤破裂的风险,在一些压迫或梗阻严重的患者中,避免支气管镜通过瘤体。
1.2麻醉与ECLS 进入手术室后建立生命体征监测并在麻醉诱导前完成中心静脉和桡动脉置管。使用面罩供氧并维持自主呼吸。考虑到麻醉诱导期间气道完全梗阻的风险,诱导前对高危气道梗阻患者在局麻和镇静下建立ECLS,对于可以安全插管的患者,全麻后建立ECLS,在气管镜引导下行气管插管。
1.2.1ECLS 的建立 随着技术的改进和病情需求,在不同阶段选用了不同的ECLS 模式(见图1)。患者仰卧位由心脏外科医生进行腹股沟或颈部血管插管,ECLS 辅助后转换为手术需要的体位。静脉-静脉(veno-venous, V-V)ECMO 在超声引导下采用Seldinger 技术通过股静脉引流和颈内静脉回流建立;静脉-动脉(veno-arterial, V-A)ECMO 和ECC 采用直视切开方式通过股静脉引流和股动脉回流建立。当术中出现循环衰竭或大出血时,可通过中心插管建立V-A ECMO 或ECC用于抢救性支持。ECMO 选择Quadrox 氧合器和Rotaflow 系统(Getinge,Rastatt,Germany)。ECC 或改良ECC 参见本团队之前的文章描述[8],驱动装置分别选择滚轴泵(Stockert S5,Livanova,Mirandola,Italia) 和离心泵(Bio-medicus 550 Bio-console,Medtronic,Minneapolis,MN,USA;Rotaflow,Getinge,Rastatt,Germany)。三种ECLS 模式如图1 所示。

图1 不同体外生命支持模式示意图
1.2.2ECLS 的管理 V-A ECMO 或ECC 设置:血流速度50 ~70 ml/kg;气血比0.5 ~1 ∶1;吸入氧浓度50%~70%。V-V ECMO 调整血流量和通气量以维持动脉氧分压(PaO2)60 ~80 mmHg,动脉二氧化碳分压(PaCO2)35 ~45 mmHg,常规通过右桡动脉监测外周血气和脉搏血氧饱和度来防止南北综合征。
1.2.3ECLS 的撤离 当无菌气管插管插入病灶远端或双腔气管插管插入支气管建立安全气道并获得满意的机械通气时,仅需要呼吸支持的仰卧位患者即可选择性撤离ECLS 支持。V-V ECMO 通过提供充分的呼吸支持可完全替代肺功能,避免台上气管内插管、间歇或高频振荡通气等操作,保证良好的视野和吻合。ECLS 或ECC 亦可在手术结束撤离辅助。对于高危出血或循环不稳定的患者,辅助至手术结束或必要时带回ICU 继续辅助。
1.3抗凝治疗ECC 模式使用普通肝素全量肝素化抗凝,维持活化凝血时间(activated clotting time, ACT) > 480 s,术毕按照1 ∶1 比例鱼精蛋白拮抗肝素。ECMO 与改良ECC 模式只在插管前弹丸式给予小剂量肝素(50 IU/kg 或总量 < 2 500 IU)进行插管,如辅助期间不给予额外的肝素,称为无肝素策略,如在辅助期间给予肝素以维持ACT 180 ~220 s 称为低肝素策略。
1.4统计分析正态分布的连续变量表示为平均值±标准差(x±SD)表示,通过t 检验比较。非正态分布的连续变量用中位数和四分位数[Q(Q1,Q3)或数值范围表示,通过Wilcoxon 秩和检验比较。分类变量以频数百分比[n(%)]表示。统计分析选用SPSS 统计软件(version 21.0,IBM Corp,Armonk,NY),P< 0.05 具有统计学意义。
2 结果
共107 例患者接受了术中ECLS 辅助,2013年后V-V ECMO 成为首选模式,但16 例患者因基础心脏疾病或血流动力学不稳定选择V-A ECMO,2008 年以后共5 例患者因再次手术或粘连选择了ECC(图2)。男性67 例(62.6%),中位年龄为48.9 岁(14~76 岁),手术涉及气管肿瘤67 例、气管狭窄23 例、气管压迫9 例和气管瘘8 例。术前诊断、合并症、症状、临床表现和狭窄程度等流行病学数据见表1。

表1 气管手术行体外循环或体外膜氧合患者的基本资料

图2 不同阶段ECLS 模式和病例分布
在23 例(21.5%)患者中观察到术后并发症,常见并发症依次为支气管胸膜瘘(n= 11,10.3%)、肺不张(n= 8,7.5%)和呼吸道感染(n= 7,6.5%)、吻合口狭窄(n= 6,5.6%)。ECC 组气管吻合口并发症明显较高。72 例(67.3%)在手术室拔除气管插管,V-V ECMO 组(86.4%)比例较高。术后机械通气时间中位数为14(4,38)h,V-V ECMO 组最短,3(1,11)h。13 例患者因肺炎或支气管胸膜瘘需要延长机械通气时间。ECC 组的手术出血量、胸膜引流量和接受输液的患者百分比较高,但浓缩红细胞输注无差异。术后死亡6 例(5.6%)。两名患者在V-V ECMO 支持32 d 和44 d 后出现支气管胸膜瘘并死于脓胸。1 例死于肺栓塞后右心衰竭,3 例死于感染和急性呼吸窘迫综合征导致多器官功能障碍,其余101例患者存活出院。见表2。
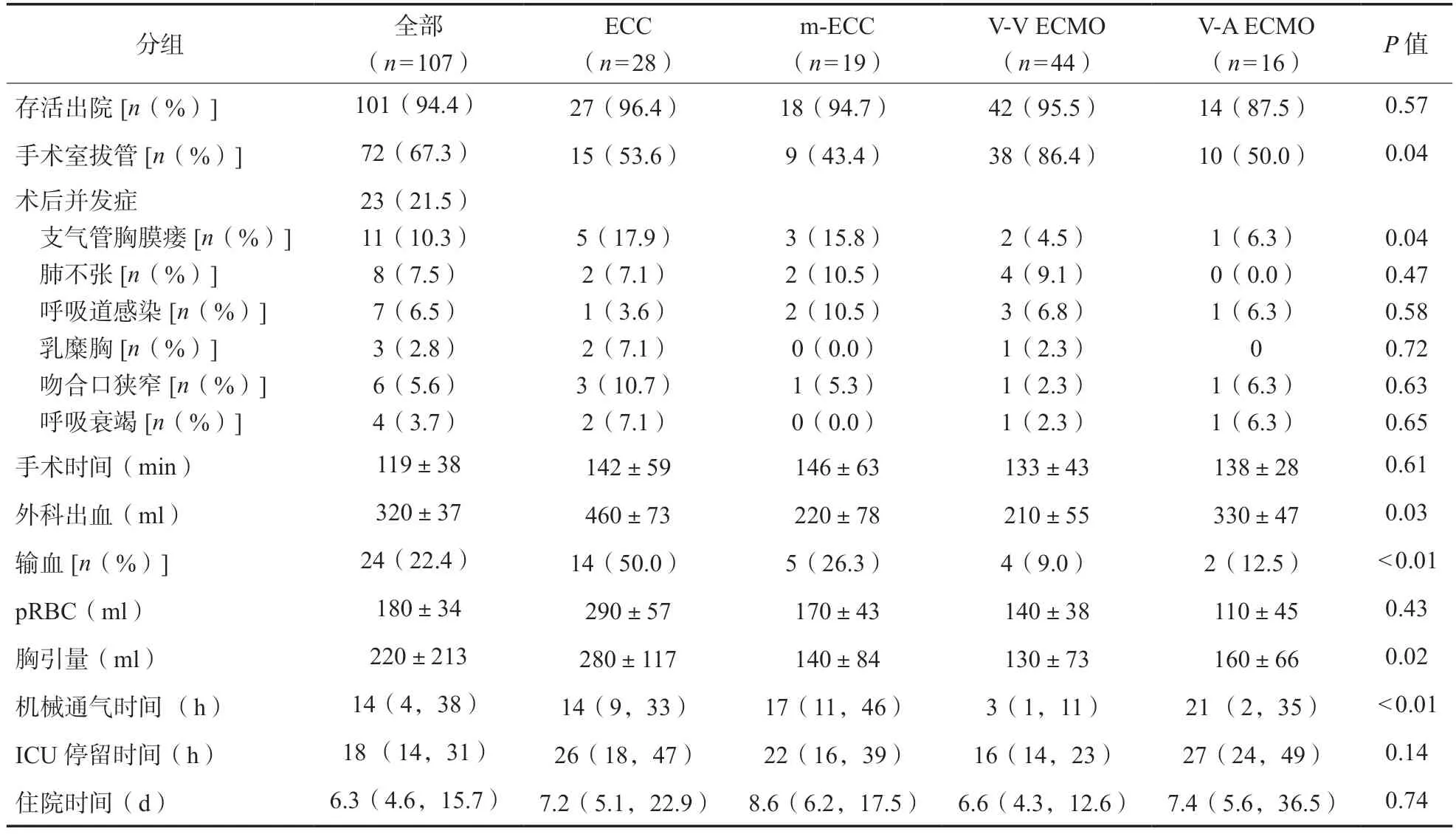
表2 气管手术患者行体外生命支持围术期并发症和转归
紧急使用ECLS 占18.7%,4 例急性呼吸窘迫综合征患者和3 例血流动力学不稳定患者持续辅助到术后。89.7%的患者采用外周插管,10.3%的患者采用中心插管, ECMO 患者均采用外周插管。V-V ECMO 组的辅助时间最长,辅助流量最高。ECMO 和改良ECC 大部分患者采用了无肝素或低剂量肝素策略。ECC 组的肝素总剂量和活化凝血时间最高。其他ECLS 数据没有显著差异。见表3。

表3 气管手术患者术中体外生命支持管理
3 讨论
涉及气管或主支气管的气道手术对有效的气道管理和术中通气提出了特殊的要求[9]。常规的气道管理策略包括呼吸暂停、高频震荡通气和术野插入气管插管等,这些方法在危重或复杂气道手术、肥胖或慢性阻塞性肺病患者中可能导致通气不足造成的缺氧和高碳酸血症,干扰手术视野和外科操作。气管术中利用ECLS 技术可以避免上述不足并提供安全有效的心肺支持,保证呼吸和循环的稳定[4],同时提供清晰的术野暴露和充足的气管吻合时间,为精确的游离和气管重建提供安全的条件,减少吻合口瘘等并发症[10]。此外,术中通过外周ECLS 支持也有助于胸腔镜技术完成手术,减少手术创伤,本研究中9 例患者在ECLS 辅助下通过胸腔镜完成了气管手术。
3.1患者风险评估、急诊或预防性支持对于重度气道梗阻患者,体位改变、麻醉诱导、肌松、肿瘤切除或隆突重建过程中均有可能发生窒息或通气障碍[11]。此类患者术前常表现为进行性的运动耐力下降、气道刺激症、气喘或哮鸣、渐进性呼吸困难,甚至窒息或猝死[12-13]。本研究中最常见的症状依次是咳嗽(50.5%)、气短(50.5%)、进行性呼吸困难(45.8%)。详细的术前评估对于ESLS 的选择非常重要,评估包括详细的病史、物理检查、心肺功能、影像学检查和气管镜[14]。CT和气管镜可以准确的评估气管肿瘤的梗阻情况、病变范围、狭窄程度、瘘口大小等。本组患者术前全部进行了CT 和至少一次气管镜检查,其中88.1%的患者气管狭窄率超过90%。严重的气道狭窄在改为平卧位或肌松时存在高危窒息风险[15],因此,狭窄超过90%成为本中心预防性ECLS 辅助的条件之一。如果保留自主呼吸,通过柔性气管镜引导气管插管通过瘤体则可以避免ECLS 辅助,但存在瘤体破裂风险,且对操作者要求较高。尽管保留自主呼吸,但仍存在低氧和高碳酸血症,以及插管困难和高危的患者,建议清醒局麻下预防性实施ECLS 辅助,否则呼吸肌麻痹、胸壁和气道塌陷或心肺交互等原因均可能造成呼吸衰竭[16]。即便是预充的“湿备”管路,紧急建立ECLS 也至少需要超过10 min 的时间,这会显著增加通气障碍导致的术后神经系统并发症[17]。本中心87 例患者(81.3%)采用了预防性使用策略,其中ECMO预防性使用将近90%,而早期的ECC 紧急使用占到42.9%。对于高危因素不明确的气道梗阻患者,通常颈内静脉和股静脉留置单腔深静脉导管,以备在需要时紧急建立ECLS。根据本研究结果和之前的报道[9,18],建议在如下情况预防性建立ECLS:诱导前或改变体位后动脉氧饱和度 < 80%或出现心动过速、1 秒用力呼气量百分比 < 30%、气道狭窄率 > 90% 或者残腔 < 5 mm、明确的气管支气管软化。病变粘连或术野通气困难以及有气管肿瘤破裂风险的可以预防性留置深静脉导管以备紧急建立ECLS。
3.2围术期并发症 尽管经验技术不断积累和进步,复杂或高危气管手术的并发症仍然较高,吻合口瘘和麻醉风险是最值得关注的围术期并发症。Bibas 等报道气管手术总体并发症、吻合口并发症和非吻合口并发症的发生率分别为44.6%、21%和23.2%[19]。尽管对并发症的定义不同,但气管术后包括肉芽组织增生、再狭窄和吻合口瘘等吻口并发症并不罕见[14]。而本研究中,虽然ECLS支持的气管手术均为高危或复杂患者,但总并发症(21.5%)和吻合口瘘(10.3%)均控制在较低水平。这与ECLS 辅助下视野清晰、无需间歇或高频震荡通气、无需台上插管、呼吸循环稳定,保证充足的时间游离和吻合等因素密切相关。
3.3ECMO 替代传统的ECC 常规ECC 早年常用于复杂胸外科手术的术中心肺支持,并可以收集术野出血和快速补液。但血-气接触促进了凝血和炎症的激活,显著血液稀释,回收血液存在肿瘤播散等风险限制了ECC 的使用[20]。考虑到大出血的可能性,在压迫或侵犯心脏大血管或气管支气管的巨大纵隔肿瘤术中,本团队仍然倾向于ECC 辅助。本中心2013 年后仍有3 例患者因再次手术或粘连或选择了ECC 模式。与ECC相比,改良ECC 模式采用了闭合环路,炎症反应降低、血液稀释减少、抗凝需求降低、红细胞输注需求减少,这些优势体现在术后机械通气、ICU 和住院时间上[21]。 2008 ~2012 年本团队在气管手术中采用改良ECC 技术取得了满意的临床结果[8]。
ECMO 是公认的难治性心肺衰竭的辅助手段之一,V-A ECMO 可提供完全的呼吸和循环支持,而V-V ECMO 仅能提供完全的呼吸支持。ECMO采用了更小的环路和预充量,显著减少了气血等异物表面的接触,更低的抗凝需求和炎症反应,允许更长的辅助时间和更轻的血液破坏。这些优势对于通气障碍或循环不稳定的气道手术患者可以以较低的风险提供全面的支持和心肺功能替代,但它并非没有潜在风险[22]。
V-A ECMO 的并发症包括穿刺部位的血管损伤和出血、血栓栓塞、急性肢体缺血和继发于术中通气暂停的南北综合征[23]。南北综合征是气道术中V-A ECMO 辅助无法避免的问题,无通气肺回流的低氧血通过左心室进入冠状动脉、主动脉弓甚至降主动脉,导致心肌或脑缺氧。因此,V-A ECMO 辅助术中无法实现长时间通气暂停,该模式也仅仅用于疑似循环不稳定的患者,并不是气道手术的首选模式[24]。目前尚不确定南北综合征是否是气道术后神经系统并发症的独立危险因素。必要时,可以选择V-A-V 或者中心ECMO以避免致命的心脑缺血[25]。在本中心,术中常规进行间歇或高频通气、右侧桡动脉脉搏氧饱和度和近红外光谱监测,以识别上半身缺氧。这对V-A ECMO 或外周ECC 非常重要。
近年来,V-V ECMO 成为本中心首选的辅助模式,并呈逐年增长的趋势,它可以提供完全的肺功能替代,避免间歇或高频通气,提供更清晰的术野和更长的无通气时间。本中心V-V ECMO最长运行时间为198 min,最长无机械通气时间为124 min,可安全的作为气管插管的替代策略。V-V ECMO 并发症包括再循环、氧供不足、静脉血栓和上腔静脉综合征。再循环取决于ECMO 泵流量、有效血容量、插管位置和口径等因素,而氧供不足取决于再循环比例和泵流量与心排量的比例等[26]。
3.4抗凝全量肝素化增加出血风险是围术期主要并发症。相对于ECC,ECMO 或改良ECC 均为闭式环路,低抗凝、低炎症反应和低血液稀释,显著降低了出血风险。尽管一些中心选择了较低的抗凝水平(插管前给予50 ~100 IU/kg 肝素,随后维持ACT 在160 ~180 s),但仍有一定比例的再次手术[27]。一些中心则选择了更保守的抗凝策略:在插管前给予3 000 ~5 000 IU 的肝素而术中采用无肝素辅助,这显著减少出血风险,防止了术中出血和因气管腔内血栓引起的气道阻塞,且无明显血栓事件[28]。在本中心,几乎所有ECMO 辅助均采用了无肝素策略,改良ECC 则采用低肝素策略,全部患者无严重血栓和出血事件。
本研究为回顾性单中心研究,没有选择非ECLS 患者作为对照。本研究仅收集了围术期数据,缺乏长期随访结果。尽管本研究可能是国内最大宗病例报道,但仍受实验设计和样本量的限制,询证学价值较低。总之,ECC 和不同模式ECMO有各自的优势,在谨慎的个体化选择的患者中,可以作为高危气道手术的一种安全有效的辅助方法,避免传统气道手术中的呼吸循环意外。

