miR-26a通过HGF/c-Met通路调控乳腺癌血管生成及分子机制
杨晓玲,曾宪威,陈 尘,陈嘉俊,许业栋,唐丽艳
(深圳市宝安区松岗人民医院检验科,广东 深圳 518105)
乳腺癌属于妇科较为常见的恶性肿瘤之一,其作为一种血管依赖性疾病,血管生成在乳腺癌发生、发展、侵袭以及转移等过程中发挥着至关重要的作用[1]。尽管目前临床上已有不少抗细胞增殖药物可以促使肿瘤细胞凋亡,然而因受周围血管支持,残留的肿瘤细胞仍可获得充足的血供,进一步持续生长、繁殖[2]。此外,异常肿瘤血管会导致药物朝肿瘤组织内部的递送明显减少,进而导致抗细胞增殖的效果大打折扣。因此,寻求一种全新的肿瘤药物治疗方案显得尤为重要,且目标不应单独针对肿瘤细胞,而是要重视肿瘤微环境,特别是要注意肿瘤血管生成的作用[3]。随着近年来有关研究的日益深入,不少学者发现微小RNA(miRNAs)可通过调控相关靶基因表达,从而在多种细胞行为中发挥着关键性作用[4]。miR-26a属于miRNAs家族重要成员之一,其在多种恶性肿瘤中均存在异常表达,介导肿瘤发生、发展过程[5]。然而,miR-26a抑制乳腺癌血管生成的具体分子机制不清楚。本研究率先提出“miR-26a通过负调HGF/c-Met信号通路,抑制VEGF,从而抑制乳腺癌血管生成”的假说和原创性理论,相关研究未见文献报道。本文通过研究miR-26a通过肝细胞生长因子(HGF)/细胞间质上皮转化(c-Met)通路调控乳腺癌血管生成及分子机制,以期为临床乳腺癌的治疗提供新的靶点与方向。
1 资料与方法
1.1一般资料:选取2021年1月~2022年3月深圳市宝安区松岗人民医院收治的40例乳腺癌患者。年龄33~79岁,平均(57.72±4.67)岁;体重指数(BMI)18~32 kg/m2,平均(23.55±1.78)kg/m2;临床分期:Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期22例;分化程度:低分化15例,中分化17例,高分化8例;淋巴结转移18例。入组标准:①所有入选对象均经手术病理检查确诊为乳腺癌;②入组前尚未接受任何抗肿瘤治疗;③均为成年女性;④临床资料完整。排除标准:①合并其他恶性肿瘤;②神志异常;③正处于其他研究过程中。入组人员均已签署知情同意书,经医院伦理委员会批准。
1.2研究方法:①人乳腺癌细胞株MDA-MB-231购自美国典型培养物保藏中心。将细胞株接种到含有10%胎牛血清以及100 U/ml青霉素-链霉素双抗 RPMI 1640培养基内。随后将其放置在37℃、5%二氧化碳浓度的细胞培养箱中培养。以0.25%胰蛋白酶溶液消化传代处理,2~3 d传代1次。②采集所有受试者的乳腺癌组织以及癌旁正常组织,将前者作为观察组,后者作为对照组。③细胞转染:通过LipofectamineTM2000脂质体法将miR-26a模拟物以及抑制物分别转染至乳腺癌细胞中,记作miR-26a转染组、miR-26a抑制组,并将未进行任何处理的乳腺癌细胞作为阴性对照组。④实时荧光定量PCR:以Trizol法提取细胞总RNA,以凝胶电泳法检测RNA相对分子质量,借助分光光度计完成RNA浓度的检测。借助mirpremier miRNA分离试剂盒完成miRNA的分离,并遵循Super Script逆转录试剂盒说明书进行cDNA的合成。之后按照PCR试剂盒说明书完成荧光定量PCR检测。之后按照美国国立生物技术信息中心(NCBI)数据库有关资料完成PCR引物的设计。严格遵循荧光定量PCR仪说明书进行基线的调整,设定阈值处于荧光值对数图线性部分,并从软件中进行Ct值读取。以β-actin为内参,根据2-ΔΔCt法完成目标基因mRNA的相对表达量计算。检测涵盖下述几项:①miR-26a;②血管内皮生长因子A(VEGFA);③HGF;④p-c-Met/c-MET;⑤下游靶基因磷脂酰肌醇激酶3(PI3K);⑥蛋白酶B(AKT);⑦雷帕霉素靶蛋白(mTOR)。
1.3观察指标:比较不同乳腺组织miR-26a、VEGFA以及微血管密度(MVD)表达,各组乳腺癌细胞中HGF/c-Met通路相关蛋白表达以及PI3K/AKT/mTOR表达水平。
1.4统计学方法:以SPSS21.0软件进行χ2及t检验。
2 结果
2.1不同乳腺组织miR-26a、VEGFA以及MVD表达比较:乳腺癌组织中miR-26a相对表达量为0.47±0.08,相较于癌旁正常组织的1.02±0.17更低,而VEGFA相对表达量与MVD分别为1.04±0.25、14.68±2.91,相较于癌旁正常组织的0.68±0.11、7.85±1.05更高,差异均有统计学意义(t=18.514、8.336、14.009,P<0.05)。
2.2各组乳腺癌细胞中HGF/c-Met通路相关蛋白表达比较:miR-26a抑制组HGF、p-c-Met/c-MET表达水平分别0.92±0.12、0.67±0.06,相较于阴性对照组的0.62±0.08、0.37±0.04以及miR-26a转染组的0.30±0.04、0.18±0.02均更高,而miR-26a转染组HGF、p-c-Met/c-MET表达水平相较于阴性对照组更低,差异有统计学意义(F=10.478、15.691,P<0.05)。
2.3各组乳腺癌细胞中PI3K、AKT、mTOR mRNA表达比较:miR-26a抑制组PI3K、AKT、mTOR mRNA相对表达量相较于阴性对照组及miR-26a转染组更高,而miR-26a转染组PI3K、AKT、mTOR mRNA相对表达量相较于阴性对照组更低,差异有统计学意义(P<0.05)。见表1。
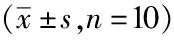
表1 各组乳腺癌细胞中PI3K、AKT、mTOR mRNA表达比较
3 讨论
迄今为止,关于乳腺癌的具体发病机制尚存在一定的争议,目前普遍认为可能与遗传、生活方式等密切相关[6]。由于该病发病早期具有极强的隐匿性,从而导致绝大部分患者首次确诊便丧失了手术根治的最佳时机,从而导致预后不良[7-8]。因此,寻找一种可早期诊断以及靶向基因治疗新靶点具有极其重要的意义。研究者通过前期研究发现:miR-26a在乳腺癌组织中表达降低,且VEGF与肿瘤血管生成关系密切,而miR-26a可能参与乳腺癌血管生长的调控。此外,miR-26a可能通过负调HGF/c-Met信号通路,抑制VEGF,从而抑制乳腺癌血管生成[9-10]。
本研究提示了miR-26a在乳腺癌中存在异常高表达,而VEGFA异常低表达,且MVD较低。分析原因,miR-26a可能通过靶向多种癌基因介导调控细胞周期、增殖、凋亡以及侵袭等多种细胞功能,进一步抑制肿瘤的发生、发展过程。VEGFA参与了血管生成以及内皮细胞生长等过程,促进了内皮细胞的增殖,诱导肿瘤血管形成,为乳腺癌的发生、发展提供了重要基础。肿瘤细胞的生长依靠从周围细胞间质中汲取的营养物质,在病灶直径超过一定界限后,其中心部分细胞生长以及增殖所需的营养物质则由血管提供,否则会出现缺氧以及坏死,因此,肿瘤组织中往往存在较高的MVD[11-12]。本研究反映了miR-26a对乳腺癌细胞中HGF/c-Met通路具有一定的负向调控作用。其中HGF主要是由间质细胞分泌而来的一种多功能生长因子,其主要成分包括两个亚基,其本质为含有728个氨基酸的肝素结合糖蛋白。c-Met主要是由原癌基因Mte所编码的一种蛋白,而HGF为其唯一天然配体,属于受体酪氨酸激酶家族重要成员之一[13-14]。两者特异性结合会促进酪氨酸激酶活性的增强,进而发挥诱导上皮-间充质转化以及血管生成的作用,在肿瘤细胞的增殖、迁移以及侵袭等过程中扮演着至关重要的作用。由此推测,miR-26a作为乳腺癌的抑癌基因,其发挥抑癌的作用机制可能与调控HGF/c-Met通路有关。另外,miR-26a抑制组PI3K、AKT、mTOR mRNA相对表达量相较于阴性对照组以及miR-26a转染组更高,而miR-26a转染组PI3K、AKT、mTOR mRNA相对表达量相较于阴性对照组更低。证实了miR-26a可能对乳腺癌细胞PI3K/AKT/mTOR信号通路亦有负向调控作用。PI3K/AKT/mTOR信号通路在抑制细胞增殖以及促进细胞凋亡中发挥着至关重要的作用,当该信号通路异常激活,会引起相关下游信号分子出现异常活化,进而刺激肿瘤细胞的增殖、分化、侵袭以及转移。目前,国内外已有不少研究报道证实,PI3K/AKT/mTOR信号通路在乳腺癌的发生、发展过程中扮演着重要角色[15-16]。由此可见,miR-26a的抑癌机制可能通过调控PI3K/AKT/mTOR信号通路实现,但关于其具体作用机制尚未阐明,有待进一步研究证实,为今后的研究提供了方向。
综上,miR-26a可能通过调控HGF/c-Met通路以及PI3K/AKT/mTOR信号通路,进一步发挥抑癌基因的作用。

