神经内镜下清除脑内血肿术后再出血风险列线图模型的构建与验证
刘展飞 安代富 陈冰清 裴林 陈成 刘永

【摘要】目的構建神经内镜下清除脑内血肿术后再出血风险列线图模型并进行验证。方法回顾性分析2019年1月—2023年7月在宿迁市分金亭医院治疗的162例原发性脑出血患者的临床资料。所有患者均采用神经内镜下清除脑内血肿,根据术后是否再出血分为术后再出血组(n=32)和术后未再出血组(n=130)。结果术后再出血组年龄大于术后未再出血组,高血压史例数少于术后未再出血组,发病至手术时间大于术后未再出血组,入院时格拉斯哥昏迷指数评分(GCS)、入院时血肿量、岛征阳性例数、术后颅内压均高于术后未再出血组,血肿清除率、仔细处理血肿周围的出血血管例数低于术后未再出血组,差异具有显著性(P<0.05);Logistic回归分析结果显示,高血压史、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性、仔细处理血肿周围的出血血管、术后颅内压、血肿清除率是神经内镜下清除脑内血肿术后再出血的影响因素(P<0.05);列线图模型显示,发病至手术时间每增加3 h,相应得分增加10分;入院时GCS评分每增加5分,相应得分增加10分;入院时血肿量每增加10 mL,相应得分增加5分;血肿清除率每减少10%,相应得分增加8分,术后颅内压每增加4 mmHg,相应得分增加8分,仔细处理血肿周围的出血血管否(0)相应得分为0,是(1)相应得分为10分;岛征阳性否(0)相应得分为0,是(1)相应得分为8分;受试者工作特征(ROC)曲线分析结果显示,该列线图模型预测神经内镜下清除脑内血肿术后再出血的曲线下面积(AUC)为0.992(95%置信区间:0.983~1.000)。HosmerLemeshow拟合优度检验结果显示,该列线图模型预测神经内镜下清除脑内血肿术后再出血与实际发生率比较,无统计学差异(χ2=8.147,P=0.879)。结论高血压史、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性、仔细处理血肿周围的出血血管、术后颅内压是神经内镜下清除脑内血肿术后再出血的危险因素,基于上述危险因素构建的风险预测列线图模型,对神经内镜下清除脑内血肿术后再出血具有一定预测价值,可为临床制定有效预防措施提供依据。
【关键词】神经内镜;脑内血肿;围手术期;术后再出血风险;列线图模型;构建;验证
【中图分类号】R651【文献标志码】B【文章编号】16727770(2024)02020205
Construction and validation of nomogram model of perioperative rebleeding risk for neuroendoscopic removal of cerebral hematoma LIU Zhanfei, AN Daifu, CHEN Bingqing, et al. Department of Neurosurgery, Fenjinting Hospital of Suqian, Suqian 223999, China
Corresponding author: LIU Yong
Abstract: ObjectiveTo construct a risk line chart model for postoperative rebleeding after endoscopic removal of intracerebral hematoma and validate it. MethodThe clinical data of 162 patients with primary cerebral hemorrhage admitted to Fenjinting Hospital of Suqian from January 2019 to July 2023 were analyzed retrospectively. All patients underwent endoscopic removal of intracerebral hematoma and were divided into postoperative rebleeding group(n=32) and postoperative non rebleeding group(n=130) based on whether postoperative rebleeding occurred. ResultsThe age of the postoperative re bleeding group was higher than that of the postoperative non rebleeding group, the number of hypertensive cases was lower than that of the postoperative non rebleeding group, and the time from onset to surgery was longer than that of the postoperative non rebleeding group. The Glasgow coma scale(GCS) at admission, the amount of hematoma at admission, the number of positive island sign cases, and postoperative intracranial pressure were all higher than those of the postoperative non rebleeding group. The hematoma clearance rate and the number of bleeding vessels around the hematoma were significantly lower than those of the postoperative non rebleeding group(P<0.05). The results of logistic regression analysis showed that a history of hypertension,
time from onset to surgery, GCS score at admission, hematoma volume at admission, positive island sign, careful handling of bleeding vessels around the hematoma, postoperative intracranial pressure, and hematoma clearance rate were the influencing factors of postoperative rebleeding after neuroendoscopic removal of intracerebral hematoma(P<0.05). The column chart model showed that for every 3 hours increased in the time from onset to surgery, the corresponding score increased by 10 points. For every 5 points increased in GCS score upon admission, the corresponding score increased by 10 points. For every 10 mL increased in hematoma volume upon admission, the corresponding score increased by 5 points. For every 10% decreased in hematoma clearance rate, the corresponding score increased by 8 points. For every 4 mmHg increased in postoperative intracranial pressure, the corresponding score increased by 8 points. Careful handling of bleeding vessels around the hematoma results in a corresponding score of 0(no), and 10 points(yes). Island sign negative(0) corresponded to a score of 0, positive (1)corresponded to a score of 8. The receiver operating characteristic(ROC) curve analysis results showed that the area under curve(AUC) of the column chart model predicting postoperative rebleeding after endoscopic removal of intracerebral hematoma was 0.992(95% confidence interval: 0.9831.00). The results of the Hosmer Lemeshow goodness of fit test showed that there was no statistically significant difference between the prediction of postoperative rebleeding under neuroendoscopic clearance of intracerebral hematoma using the column chart model and the actual incidence rate(χ2=8.147,P=0.879). ConclusionsA history of hypertension, time from onset to surgery, GCS score upon admission, hematoma volume upon admission, positive island sign, careful management of bleeding vessels around the hematoma, and postoperative intracranial pressure are risk factors for postoperative rebleeding after neuroendoscopic removal of intracerebral hematoma. A risk prediction column chart model constructed based on these risk factors has certain predictive value for postoperative rebleeding after neuroendoscopic removal of intracerebral hematoma, this can provide a basis for the development of effective preventive measures in clinical practice.
Key words: neuroendoscopy; cerebral hematoma; perioperative; postoperative rebleeding risk; nomogram model; construction; validation
原发性脑出血因脑血管破裂引起神经系统破坏,是脑卒中的一种亚型,其发生率较高,发病急骤、初期病情起伏较大[1]。血肿腔压力高于颅内压,继而压迫脑组织,引起脑损伤,因此应及时清除血肿,防止疾病持续进展,针对大血肿,手术治疗是唯一途径[2]。临床手术清除血肿经过很长时间的发展,已由传统开颅演变为了微创穿刺引流术。虽然穿刺引流损伤脑组织的程度较轻,但因无法精准达穿刺位置,未能及时止血,易导致再次出血,同时因需计算机断层扫描(computer tomography,CT)确认清除情况,长时间插管存在感染风险[3]。现如今,内镜技术已经十分先进,随之出现神经内镜微创术。此手术是依赖于神经内镜,拓宽手术视野,可以清除大小血肿块,继而彻底清除血肿,但仍无法完全避免术后再出血的风险[4]。基于此,本研究纳入2019年1月—2023年7月在宿迁市分金亭医院治疗的162例原发性脑出血患者,构建了神经内镜下清除脑内血肿术后再出血风险列线图模型并进行了验证,找到了影响术后再出血的高危因素,为临床规避术后再出血风险提供一定的指导。
1资料与方法
1.1一般资料共纳入162例采用神经内镜下清除脑内血肿的原发性脑出血患者,其中男86例,女76例;年龄40~69岁,平均年龄(50.16±10.02)岁。根据术后是否术后再出血分为术后再出血组(n=32)和术后未再出血组(n=130)。纳入标准:(1)有明确高血压病史,经头颅CT检查确诊;(2)<75岁;(3)从发病到手术时间<48 h;(4)入院当日格拉斯哥昏迷指数评分(Glasgow coma score,GCS)8~12分。排除标准:(1)心肺功能障碍;(2)伴凝血异常;(3)伴资料不全。本研究经宿迁市分金亭医院医学伦理委员会批准(批准文号:2018H78),所有患者均知情同意。
1.2方法
1.2.1资料收集收集所有患者的临床资料,包括一般资料(性别、年龄、吸烟史、抗凝和抗血小板药物使用史、糖尿病、高血压、冠心病、脑梗死史)、实验室指标[白细胞计数(White blood cell,WBC)、血小板计数、血红蛋白、三酰甘油(triacylglycerol,TG)、低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDLC)、空腹血糖、血肌酐]、发病至手术时间、入院时GCS评分、入院时血肿量、穿刺部位、首次抽吸量等。入院后手术前采集患者空腹静脉血10 mL,3 000 r/min离心10 min(离心半径20 cm),取上清液,分装至1.5 mL EP管中,置于80 ℃冰箱中待测。采用全自动血细胞计数仪检测WBC、血小板计数,采用氰化高铁法检测血红蛋白,采用免疫比浊法检测血肌酐,采用全自动生化分析仪检测TG、LDLC、空腹血糖。
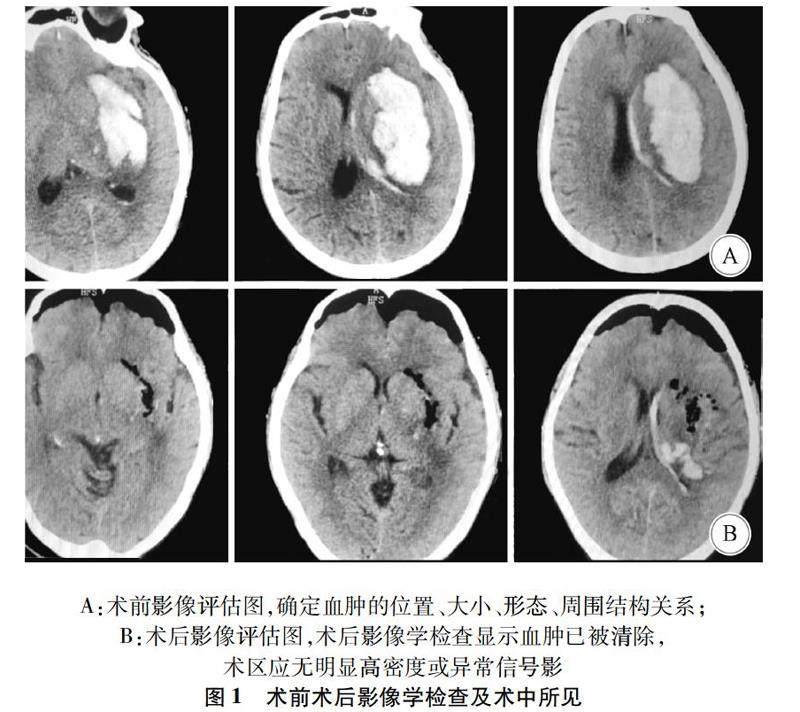
1.2.2治疗方法采用神经内镜微创术,首先经CT观察血肿情况,确定位置、体积后标记中心点。头皮切口采用直切口或弧形小切口,长约5 cm左右,用电钻钻约8 mm的颅骨孔一个,铣刀开颅,形成直径约2.5 cm锁孔骨窗。切开硬脑膜后皮层造口约5 mm,脑穿针穿刺血肿腔,抽出5~10 mL血凝块,再置入组织扩张器,建立手术通道。置入神经内镜,直视下清除血肿,清除结束后妥善止血,撤手术通道,修补硬膜,骨瓣复位固定,缝合头皮。术前术后影像及术中情况见图1。
1.3统计学分析采用SPSS 22.0统计学软件处理数据。计量资料均符合正态分布,以均数±标准差(x±s)表示,组间比较采用独立样本t检验;计数资料以率表示,组间比较采用χ2检验;采用多因素Logistic回归分析探讨神经内镜下清除脑内血肿术后再出血的影响因素;基于多因素Logistic回归分析结果构建神经内镜下清除脑内血肿术后再出血风险预测列线图模型;绘制受试者工作特征(receiver operating characteristic,ROC)曲線以评估该列线图模型对神经内镜下清除脑内血肿术后再出血的区分度;采用HosmerLemeshow拟合优度检验评估该列线图模型预测神经内镜下清除脑内血肿术后再出血的一致性,并绘制校准曲线。以P<0.05认为差异有统计学意义。
2结果
2.1两组临床资料比较两组性别、吸烟史、抗凝药物和抗血小板药物使用史、糖尿病、冠心病、脑梗史占比及脑出血部位、WBC、血小板计数、血红蛋白、TG、LDLC、空腹血糖、血肌酐比较无统计学差异(P>0.05);术后再出血组年龄大于术后未再出血组,高血压史占比、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性例数、术后颅内压均高于术后未再出血组,血肿清除率、仔细处理血肿周围的出血血管例数低于术后未再出血组,差异显著(P<0.05),见表1。
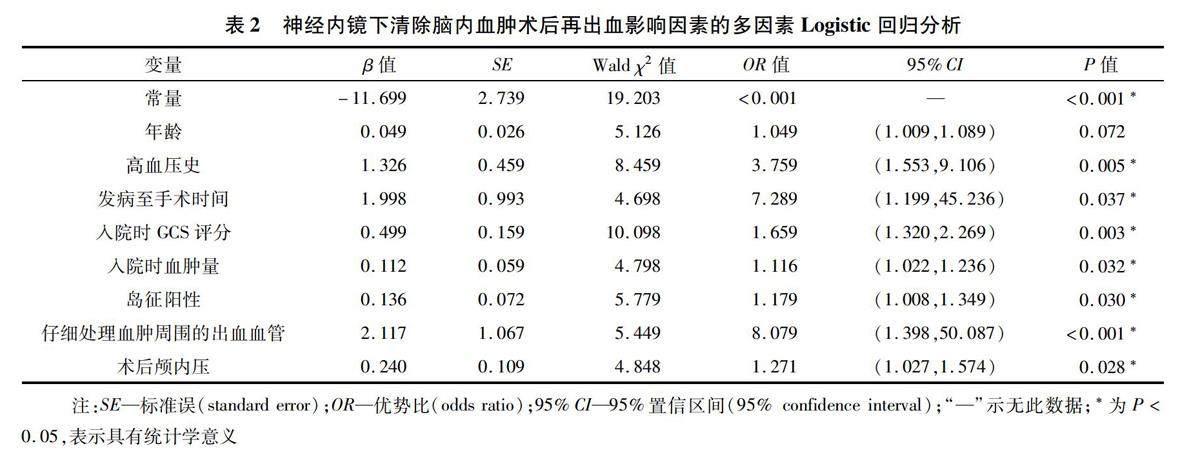
2.2多因素Logistic回归分析以神经内镜下清除脑内血肿术后再出血是否发生为因变量(赋值:否=0,是=1),以年龄(实测值)、高血压史(赋值:无=0,有=1)、发病至手术时间(实测值)、入院时GCS评分(实测值)、入院时血肿量(实测值)、首次抽吸量(实测值)、达血肿中心穿刺(赋值:否=0,是=1)为自变量,进行Logistic回归分析,结果显示,高血压史、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性、仔细处理血肿周围的出血血管、术后颅内压、血肿清除率是神经内镜下清除脑内血肿术后再出血的影响因素(P<0.05),见表2。
2.3风险列线图模型的构建基于Logistic回归分析结果,将高血压史、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性、仔细处理血肿周围的出血血管、术后颅内压、血肿清除率引入科研客栈网站作图工具,建立神经内镜下清除脑内血肿术后再出血风险预测列线图模型:发病至手术时间每增加3 h,相应得分增加10分;入院时GCS评分每增加5分,相应得分增加10分;入院时血肿量每增加10 mL,相应得分增加5分;血肿清除率每减少10%,相应得分增加8分,术后颅内压每增加4 mmHg,相应得分增加8分,仔细处理血肿周围的出血血管否(0)相应得分为0,是(1)相应得分为10分;岛征阳性否(0)相应得分为0,是(1)相应得分为8分,见图2。
2.4风险预测列线图模型的验证ROC曲线分析结果显示,该列线图模型预测神经内镜下清除脑内血肿术后再出血的曲线下面积(area under curve,AUC)为0.992(95%CI=0.983~1.000),见图3。HosmerLemeshow拟合优度检验结果显示,该列线图模型预测神经内镜下清除脑内血肿术后再出血与实际发生率比较,无统计学差异(χ2=8.147,P=0.879),见图4。
3讨论
目前,经手术治疗可以及时清除血肿,微创和影像技术的进步,使微创穿刺引流术成为临床治疗的常用方式,并且更适合于老年患者[5]。尽管研究证实神经内镜微创术治疗时间短,术中出血量少,血肿清除率更高且术后再出血风险小,有助于稳定体征、更快康复,对于原发性脑出血的治疗效果显著[6]。但神经内镜治疗成本高,同时对医务工作者的技术水平要求较高,而脑出血通常出现于中老年人群,其代谢和抗感染能力下降,对手术和术后康复时间的要求更严格,长时间的穿刺引流不是最佳治疗方式[7]。为了改善原发性脑出血患者的生存质量,降低术后再出血风险,应发现影响其术后再出血的高危因素。
经Logistic回归分析发现,高血压史、发病至手术时间、入院时血肿量、穿刺部位、首次抽吸量均是影响神经内镜下清除脑内血肿术后再出血的主要危险因素,分析原因为有高血压史提示患者血压水平可能较高,颅内压显著升高,导致血肿增大,出血量增加,术后再出血的风险较高,影响预后,血肿增大与入院后收缩压升高存在紧密的关系[8]。发病至手术治疗时间越长,提示治疗延迟,使脑出血病情加重,损伤脑神经。脑出血的手术治疗时间与病情的严重程度、恢复情况以及所采取的手术方式有关。一般来说,发病至手术治疗时间越长,可能会导致治疗延迟,从而使脑出血病情加重,损伤脑神经。对于脑出血的治疗,应尽早进行手术治疗以挽救患者的生命。具体治疗方案应根据患者的具体病情和医生的建议进行选择[9]。入院时血肿较大,提示颅内压升高更快,及时清除血肿,会致颅内血压急骤下降,患者的机体无法耐受,继而增加了术后再出血的风险[10]。岛征阳性是指术中在清除血肿时,观察到脑组织表面有明显的出血点或者血管暴露,这可能是术后再出血的一个危险因素[11]。在手术过程中,对血肿周围出血血管的处理是否得当,对预防术后再出血至关重要。在手术过程中,如果对血肿周围的出血血管处理不彻底,可能导致术后再出血的风险增加[12]。颅内压是脑部血液循环和脑脊液循环的关键因素。颅内压升高可能导致脑血管扩张,从而增加出血的风险。高颅内压可能导致脑组织移位,影响血肿清除的效果,从而增加术后再出血的风险[13]。血肿清除率是指手术过程中清除血肿的效率,即清除的血肿体积与术前血肿总体积之比。较高的血肿清除率可以降低术后再出血的风险,高血肿清除率意味着术中清除的血肿更完全,残留的血肿体积更小,从而降低了术后再出血的风险。高血肿清除率有助于减轻术后颅内压,降低脑血管损伤和出血的风险。可以提高手术效果,加速患者的康复,降低术后并发症的风险[14]。
本研究基于多因素Logistic回归分析,将高血压史、发病至手术时间、入院时GCS评分、入院时血肿量、岛征阳性、仔细处理血肿周围的出血血管、术后颅内压、血肿清除率引入科研客栈作图分析软件中,建立了神经内镜下清除脑内血肿术后再出血风险预测列线图模型,有助于医务工作者更客观地分析危险因素对神经内镜下清除脑内血肿术后再出血风险的影响权重,提示医务工作者更谨慎地排查危险因素,从而进行有效预防,必要时还可调整方案,降低术后再出血风险。ROC曲线分析结果显示,该列线图模型预测神经内镜下清除脑内血肿术后再出血的AUC为0.992(95%CI=0.983~1.000);HosmerLemeshow拟合优度检验结果显示,该列线图模型预测风险与实际风险比较差异不显著,提示该列线图模型对神经内镜下清除脑内血肿术后再出血有一定预测价值,且准确性较高,有一定的推广和应用价值[15]。
综上所述,高血压史、发病至手术时间、入院时血肿量、穿刺部位、首次抽吸量是神经内镜下清除脑内血肿术后再出血的危险因素,基于上述危险因素构建的风险预测列线图模型,对神经内镜下清除脑内血肿术后再出血具有一定预测价值,可为临床制定有效预防措施提供依据。但本研究样本量小,且纳入的因素少,导致研究结果可能存在偏倚,有待增加样本量和因素进行更加深入的研究。
利益冲突:所有作者均声明不存在利益冲突。
[参 考 文 献]
[1]Kumar S.Recombinant activated factor VII for acute intracerebral hemorrhage[J].Indian J Crit Care Med,2005,9(1):1113.
[2]Li JL,Ren HC,Wang YB,et al.Mechanism of Stat1 in the neuronal Ca2+ overload after intracerebral hemorrhage via the H3K27ac/Trpm7 axis[J].J Neurophysiol,2022,128(1):253262.
[3]王一芳,纪安妮,高继荣,等.早期高压氧治疗对未行血肿清除手术的基底节区脑出血患者预后的影响[J].中华航海医学与高气压医学杂志,2021,28(4):442444,483.
[4]苏俊,陈艾,吴海,等.神经内镜血肿清除术与微创血肿穿刺引流术治疗高血压脑出血临床效果比较[J].检验医学与临床,2021,18(20):30243027.
[5]秦虎,马木提江·木尔提扎,王昀,等.影像后处理结合3D打印手术导板辅助微创穿刺术治疗自发性脑出血的临床研究[J].中华神经医学杂志,2022,21(12):12501254.
[6]Yan C,Mao J,Yao C,et al.Application of endoportassisted neuroendoscopic techniques in lateral ventricular tumor surgery[J].Front Oncol,2023,13:1191399.
[7]陈红,柳慧林,石霞,等.脑出血术后静息代谢能量消耗实测值与HB公式预计值对比研究[J].重庆医学,2021,50(16):27392743.
[8]薛延华,李晶,李定安,等.微创穿刺治疗术对高血压性脑出血患者的疗效及颅内压升高与MMP9的相关性[J].湖南师范大学学报(医学版),2021,18(5):223226.
[9]郑立冲,李民,尹春风,等.小骨窗显微术治疗高血压脑出血效果观察[J].山东医药,2023,63(14):7375.
[10]宋安军,伍国锋,任思颖,等.脑立体定向微创三针穿刺术清除颅内血肿及控制颅内高压的临床研究[J].中国临床神经科学,2021,29(2):179186,203.
[11]秦霜,吴恒,王根强,等. CT“李琦岛征”联合血清TGFβ1、ICAM1、NLR对脑出血患者预后的预测价值[J]. 实用放射学杂志,2023,39(11):17471750,1759.
[12]陈施玲,唐颖馨,王文志,等.脑出血微创血肿清除手术穿刺及抽吸器械的研究进展[J].神经损伤与功能重建,2023,18(10):608610.
[13]王冕,沈李奎,周强,等.颅内压监测探头植入及侧脑室引流患者颅内感染的危险因素[J].中华医院感染学杂志,2022,32(17):26242627.
[14]张冰,田昵军.高血压脑出血手术前血肿形态对微创置管引流术血肿清除率的影响[J].贵州医药,2022,46(1):7172.
[15]曾湖,徐立新,陈华,等.動脉瘤性蛛网膜下腔出血患者围手术期内并发医院感染风险列线图模型的构建与验证[J].中国脑血管病杂志,2021,7(10):679688,723.