不同含水量培养料栽培银耳期间料理化性状分析及对银耳质量影响初探
朱传进
(古田县食用菌研发中心,福建宁德352200)
银耳(Tremella fuciformis)又称白木耳。早期栽培银耳用段木,通江段木栽培的银耳质量好、口感佳、售价高,但是产量低[1]。1979年,福建古田县的戴维浩首创木屑、棉籽壳塑料袋式栽培法栽培银耳[2],目前袋栽银耳已成为主流。培养料营养构成、酸碱度、含水量与外界环境因素决定了银耳的产量和质量[3]。目前,在银耳菌种分离[4]、培养料优化、新型培养料的选择、环境因素方面的研究已有相关的报道[5-6]。
笔者研究了不同含水量培养料栽培银耳期间料降解、理化性状变化及对银耳产量、质量影响,以期为银耳培养料水分控制提供理论依据。
1 材料与方法
1.1 供试菌株与培养料
银耳菌株(TR85)由古田珍稀食用菌研究所提供。供试料包(25 cm×13 cm)由福建农林大学(古田)菌业研究院基地提供。培养料配方:棉籽壳84%,麸皮15%,石膏粉1.5%。培养料含水量分别为50%、56%、63%。每袋装料700 g(湿料)。人工打孔贴封胶布(单孔),高压灭菌锅内灭菌(121℃,4 h)。
1.2 试验方法
1.2.1 培养方法
无菌条件下,接入银耳菌种的料袋放入24℃恒温生化培养箱避光培养。每隔5 d测定菌圈直径及观察记录菌袋的外观变化。
1.2.2 样品前处理
从接种日算,每相隔5 d,取3袋,分别切取中间接种穴为中心的6 cm培养料放入不锈钢盆中充分混匀后,准确称取20 g的培养料用于制备粗酶液,另取10 g的培养料置于60℃烘干箱烘干至恒重,用于测定总糖含量。
1.2.3 粗酶液的制备
将称取好的20 g培养料,在三角瓶中按照料水比1∶5加入dd H2O,于25℃,150 r/min恒温振荡摇床充分浸提90 min,双层纱布过滤,滤液置于50 mL离心管,9000 r/min离心15 min,上清液即为粗酶液用于测定pH及酶活性。
1.2.4 测定方法
总糖的测定参照国家标准肉品总糖含量的测定[7];还原糖含量测定参照杨松杰等人(2015)的方法[8];可溶性蛋白含量测定参照牛建峰等人(2006)的方法[9];羧甲基纤维素酶活测定参照赵玉萍等人(2006)的方法[10];淀粉酶活性的测定参照孙静等人(2009)的方法[11];中性蛋白酶活性测定参考蛋白酶活性测定的国家标准[12];漆酶活性测定参考郭艳艳等(2014)[13]方法采用ABTS法测定;木聚糖酶活力的测定参照杨云龙等(2015)的方法[14]测定。
1.2.5 银耳农艺性状与经济效益分析
出耳结束后,对比不同含水量间银耳外观形态差异。采摘后银耳用清水泡发1 h,取泡发后的银耳测定底部直径与银耳隆起高度。银耳去掉蒂头后放入烘干箱55℃恒温烘干至恒重,统计银耳产量。并根据银耳与原材料市场售价计算经济效益。
1.2.6 数据处理
试验数据用SPSS软件LSD多重比较法进行单因素方差分析,用Excel软件作图。

图1 银耳培养料可溶性蛋白含量

图2 银耳培养料还原糖含量

图3 银耳培养料总糖含量

图4 银耳培养料羧甲基纤维素酶活力
2 结果与分析
2.1 培养料理化性状
2.1.1 可溶性蛋白含量
由图1可见,培养料可溶性蛋白含量在接种10 d后迅速上升,20 d后(进入出耳阶段)上升放缓。培养料含水量为63%时,料可溶性蛋白含量高于料含水量56%、50%,并在接种25 d达到最高(318µg/g)。可见培养料含水量63%时,菌丝生长发育旺盛,分泌的胞外酶增多,对基质的分解利用快。
2.1.2 还原糖含量
由图2可见,接种培养0~15 d培养料还原糖含量不断上升,15~20 d(扩口增氧)菌丝对还原糖吸收利用加快,还原糖含量迅速降低。20 d后还原糖下降幅度缓慢,不同含水量培养料还原糖变化趋势基本一致。培养料含水量为63%时,有利于银耳菌丝分解转化培养料,料还原糖含量最高,其次是料含水量56%,最后是料含水量50%。
2.1.3 总糖含量
由图3可见,总糖含量随着培养时间延长而逐渐降低。从银耳接种到采收,培养料含水量为63%时,料总糖下降幅度最大,说明此培养料含水量有利于总糖的分解。
2.2 酶活活力测定
2.2.1 羧甲基纤维素酶活力
由图4可以看出,随着银耳菌丝的生长,不同含水量培养料中羧甲基纤维素酶的酶活力均逐渐提高,进入出耳阶段后(培养20 d)酶活力基本稳定。不同含水量培养料羧甲基纤维素酶活力变化趋势一致,但酶活力差异显著,以培养料含水量63%时,培养料中羧甲基纤维素酶活力最高,说明此含水量有利于银耳菌丝纤维素的降解。
2.2.2 淀粉酶活力
由图5可知,接种后10 d淀粉酶酶活力迅速上升,10~15 d下降,15~20 d(扩口增氧)淀粉酶活力又有所上升,进入出耳阶段(20 d)后,培养料含水量56%、63%的料淀粉酶活力逐渐下降,而培养料含水量50%的料酶活力变幅较小。培养料含水量63%,在整个银耳栽培期料淀粉酶活力最高(3529 U/mL),50%最低只有2783 U/mL。
2.2.3 中性蛋白酶活力
中性蛋白酶活力变化见图6。在银耳菌丝培养阶段(0~15 d)蛋白酶活力明显增强,15 d后蛋白酶活力变化较小。培养料含水量越高,越有利于菌丝对原料蛋白类氮源的降解。
2.2.4 漆酶活力变化
由图7可以看出,菌丝培养前10 d漆酶活力迅速升高,培养料含水量63%的漆酶活力最高,达到142 U/mL,10 d后漆酶活力开始减弱。菌丝培养过程中,菌丝代谢由弱变强,菌丝的抗病能力增强,随后可能是由于袋料中漆酶代谢产物的不断积累,抑制漆酶的活力,所以漆酶活力一直下降。

图5 银耳培养料淀粉酶活力

图6 银耳培养料蛋白酶活力

图7 银耳培养料漆酶活力
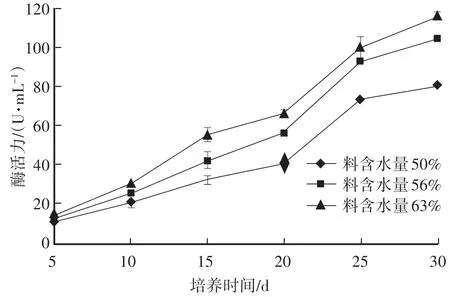
图8 银耳培养料木聚糖酶活力
2.2.5 木聚糖酶活力
从图8可以看出,随着培养时间延长,酶活力也随之逐步升高,上升趋势明显,且不同含水量的培养料变化趋势基本一致。培养料含水量63%的木聚糖酶活力最强,培养料中木聚糖消耗最快。
2.3 不同含水量培养料中银耳菌丝生长情况
从表1可以看出,在接种第6天时,培养料含水量63%的银耳菌圈直径大于含水量50%和含水量56%。培养至12 d时,培养料含水量63%的黑色素比含水量50%和含水量56%的稍淡。

表1 银耳菌丝生长情况
2.4 银耳农艺性状分析
从图9、表2可以看出,不同含水量培养料栽培银耳子实体农艺性状差别不大,前期均朵型圆正,耳片松展且较大,叶片密,较厚实,有弹性,乳白色,鲜艳美观。
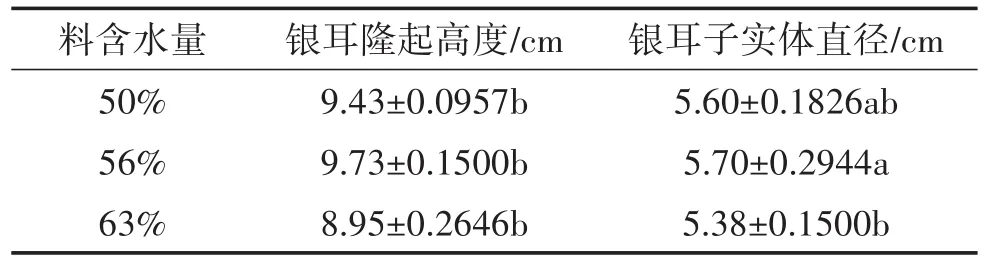
表2 不同含水量培养料栽培银耳子实体农艺性状
耳片成熟后朵型圆正,高大,有弹性,耳片略有收缩,色白,基黄。培养料含水量50%的耳片分叉松散且较大,收缩的不紧密有蓬松感;含水量56%的整朵银耳直径最大,耳片收缩紧密,实心厚实;含水量63%耳片小,整体朵型比含水量56%稍小,紧密度较好,有蓬松感,呈米黄色。
从银耳直径与隆起度来比较含水量56%最好,含水量63%最差。
2.5 银耳产量与效益分析
由表3可以看出不同含水量料栽培银耳干重有差异,培养料含水量56%平均单袋银耳产量(干重)最高。按照市场价,干银耳50元/kg,折算出单袋的投入产出比,料含水量56%单袋产值最高达到1.88元,投入产出比为1.33元,高于料含水量63%与料含水量50%。

图9 不同含水量培养料栽培银耳子实体

表3 银耳成本效益
3 小 结
含水量63%培养料栽培银耳,培养料总糖降解量最高,且还原糖、可溶性蛋白积累量明显高于含水量56%培养料、含水量50%培养料。原因是培养料含水量的提高,菌丝呼吸作用增强,生长速度明显加快[15-17],菌丝满足自身生长和代谢的需要,分泌更多的胞外酶消耗培养料中的多糖[18],导致培养料中总糖下降加快,转化成更多的还原糖提供给菌丝,这与韩嘉钰等对灵芝研究的部分结果相同[19],但由于银耳生长特性与灵芝的不同,存在一定的差异。
培养料中酶的活力变化能反映菌丝对培养料的利用情况。含水量63%培养料胞外羧甲基纤维素酶、中性蛋白酶、淀粉酶、木聚糖酶和漆酶活力最高,说明菌丝代谢最强,相应的菌丝分泌胞外蛋白最多,体现出高基质降解酶活性[20]。
从产量统计结果看,培养料含水量56%银耳产量最高。而培养料含水量50%因含水量过低,影响菌丝对培养料的降解吸收;培养料含水量63%,虽菌丝生长速度快,营养降解更充分,但是干料重明显低于含水量56%菌袋,出耳后期营养供应不足。
经济效益分析结果表明,培养料含水量56%,单袋产值和投入产出比最佳。
总之,培养料含水量63%有利于银耳菌丝对原料分解、吸收利用,培养料含水量56%栽培银耳收益最好。

