新生儿重症监护病房极早产儿生后72小时内停用抗菌药物质量改进研究
俞微寅 蒋思远 张 澜 张 蓉 胡黎园 周建国 朱 琳 张迅捷 蓝江儿 曹 云
早发败血症(EOS)是导致新生儿尤其是早产儿死亡和不良临床预后的重要因素,早产儿尤其是极早产儿是发生EOS的高危人群[1],近80%的早产儿接受生后早期经验性抗菌药物治疗[2,3]。但是,中国NICU中EOS经验性抗菌药物使用存在明显不合理现象[4]:一是不合理使用率高,高达85%无感染证据的早产儿接受早期抗菌药物治疗;二是使用疗程长,排除败血症的早产儿生后早期使用抗菌药物中位疗程长达8 d,远超过推荐的48 h;三是尚无抗菌药物使用的统一规范,不同医疗机构间生后早期抗菌药物使用差异大。
越来越多的证据表明,过长时间的生后早期抗菌药物暴露增加死亡和严重并发症发生风险,也与远期免疫性疾病、肥胖发生风险增加相关[5-9]。抗菌药物管理项目(ASP)是优化抗菌药物使用的一类专门项目,旨在改善患者预后、提高抗生素疗效,同时减少抗菌药物使用的不良后果[10]。近10年来,ASP在新生儿人群中逐渐开展,相关研究证实规范EOS抗菌药物疗程可以有效减少早产儿生后早期不合理抗菌药物使用[11-13]。此外,多中心研究提示生后早期抗菌药物使用增加早产儿晚期抗菌药物使用,因此限制EOS抗菌药物疗程可能同时减少住院期间总体抗菌药物使用[5,14]。
本研究通过在复旦大学附属儿科医院(我院)NICU实施以缩短EOS经验性抗菌药物疗程为靶点的多学科协作性ASP,评估ASP实施前后NICU极早产儿抗菌药物使用情况,探讨ASP减少极早产儿生后早期及总体抗菌药物使用的有效性和安全性。
1 方法
1.1 研究设计 质量改进研究。以NICU极早产儿(胎龄<32周)为研究对象,以2022年10月31日建立多学科专业人员协作参与的ASP团队为界限,之前为常规抗菌药物管理,之后为ASP干预方案,观察质量改进前后住院期间抗菌药物使用情况。
1.2 定义
1.2.1 败血症 (1)确诊败血症[15]:血培养或脑脊液培养阳性。(2)临床诊断败血症[16]:满足以下所有条件,①存在感染临床表现,不能用非感染、非细菌感染(如病毒感染)等病因解释;②存在至少1项感染相关指标异常,如WBC<5×109·L-1或>30×109·L-1,PLT<100×109·L-1,CRP≥8 mg·L-1等;③血/脑脊液培养和宏基因均阴性。(3)排除感染标准:①临床情况稳定,或临床表现能用非感染、非细菌性感染(如病毒感染)等病因解释;②连续2次(间隔12~24 h)感染相关指标正常(CRP<8 mg·L-1);③血培养48 h未回报阳性。(4)生后72 h内发生的败血症为早发败血症(EOS),生后72 h后发生的败血症为晚发败血症(LOS)。
1.2.2 早期抗菌药物使用 出生后72 h内开始的抗菌药物治疗。
1.2.3 住院期间抗菌药物治疗天数(LOT) 至少使用1种抗菌药物天数的总和,例如,患儿连续2 d接受氨苄西林和头孢他啶治疗,每天为1 LOT,共2 LOT。
1.3 纳入和排除标准 纳入2020年11月1日至2023年7月31日出生后24 h内入住我院NICU且胎龄<32周的连续早产儿病例。排除:①严重的先天畸形;②7 d内死亡或出院;③出生后3 d内存在明确的抗菌药物使用指征:如消化道穿孔、手术、气胸、培养阴性的化脓性脑膜炎等。
1.4 分组 以2022年10月31日为界,之前为对照组,之后为干预组,干预组和对照组分别根据本文败血症定义分为排除感染亚组、确诊败血症亚组和临床败血症亚组。
1.5 常规抗菌药物管理 中国尚无明确的早产儿EOS抗菌药物使用指南。中国抗菌药物临床应用指南不建议儿童使用氨基糖苷类药物,所以NICU临床实践采用青霉素类抗生素联合第三代头孢菌素作为EOS的一线经验性抗菌药物。有EOS风险的极早产儿是否应用抗菌药物、抗菌药物疗程、剂量由临床医师根据临床情况做出决策。
1.6 ASP干预方案 借鉴美国感染性疾病学会和美国卫生保健流行病学会(IDSA)[17]以及美国疾病预防控制中心(CDC)[18]颁布的ASP实施指南,制定了NICU EOS筛查、诊断和治疗规范,ASP核心要素包括以下3项。(1)ASP团队:包括2名新生儿科医师,3名药师,由1名新生儿科医师作为团队负责人。(2)经验性使用抗菌药物:依据参考文献[19,20],根据我院新生儿病房实际情况制定<34周早产儿早发感染识别流程(图1),结合EOS危险因素(低危、中危、高危)和疾病危重状态,评估和判断是否经验性使用抗菌药物。(3)抗菌药物治疗48~72 h后再次评估,排除感染则停止抗菌药物的使用,当存在临床败血症和确诊败血症,抗菌药物疗程由ASP团队和临床医生讨论决定。(4)审查:ASP每周一下午对NICU每例极早产儿依据抗菌药物使用核查表(附件1,http://www.cjebp.net/CN/10.3969/j.issn.1673-5501.2023.05.006)进行1次审查,审查的主要内容:胎龄、日龄、感染相关临床表现、感染相关非特异性炎症指标、血培养结果、抗菌药物种类和已用疗程(精确到h),判断抗菌药物使用原因、种类、疗程的合理性,并为后续抗菌药物使用方案提供建议。(5)反馈:ASP审查次日上午,在NICU主任医师主持下,ASP团队向病房主治医师、副主任医师、专科医师通报ASP审查结果。(6)针对疑难病例随时进行科室讨论。

图1 胎龄<34周早产儿早发感染识别流程
1.7 结局指标 (1)主要结局指标:早期抗菌药物停用率=生后72 h内停用抗菌药物的患儿数/总患儿数。(2)次要结局指标: ①早期抗菌药物使用率=生后72 h内使用抗菌药物的患儿数/总患儿数;②LOT以每1 000患者日为单位进行标化,即LOT/住院天数×1 000;③死亡:住NICU期间的死亡; ④LOS;⑤NEC(改良Bell分期[21]≥Ⅱ期)。
1.8 样本量计算 在极早产儿中,对照组早期抗菌药物停用率为36%,假设ASP干预后升高20%。为达到80%检验效能,采用双侧Z检验,检验的显著性水平为0.05,样本量要求每组94例。在排除感染的极早产儿中,对照组早期抗菌药物停用率为61%,假设ASP干预后升高25%,为达到80%检验效能,采用双侧Z检验,检验的显著性水平为0.05,样本量要求每组45例。
1.9 临床资料采集 (1)母亲因素:妊娠年龄、产次、分娩方式、妊娠期并发症(包括妊娠期高血压、糖尿病)、产前激素使用、绒毛膜羊膜炎、胎膜早破时间是否>18 h、产前静脉抗菌药物治疗;(2)患儿因素:性别、胎龄、出生体重、小于胎龄儿、单胎、Apgar评分(1和5 min)、EOS;(3)NICU治疗因素:抗菌药物使用(种类名称、开始用药时间、停药时间)、有创机械通气、血管活性药物;(4)EOS类型:依据确诊败血症、临床诊断败血症和排除感染标准,回溯病历做出确诊败血症、临床败血症和排除感染判断。
1.10 统计学方法 采用Stata/SE 16.0 (StataCorp)软件进行统计分析。计数资料用n(%)表示,组间比较采用Pearsonχ2检验。正态分布的计量资料用xˉ±s表示,组间比较采用非独立样本t检验;非正态分布的计量资料用M(IQR)表示,组间比较采用Wilcoxon秩和检验。双侧P<0.05为差异有统计学意义。创建统计过程控制图(SPC)来描述ASP干预前后主要结局随时间变化的情况。满足以下任一情况认为出现特殊原因偏差[22]:①1个数据点超过上控制线(UCL)或下控制线(LCL);②位于中心线(CL)同侧的3个数据点中有2个超过2 SD;③位于CL同侧的5个数据点中有4个超过1 SD;④连续8个数据点位于CL的同侧;⑤连续6个持续上升或下降的数据点。出现特殊原因偏差提示干预措施引起的数据显著变化。
2 结果
2.1 一般资料 2021年11月1日至2023年7月31日共收治出生胎龄<32周早产儿575例,符合本研究纳入排除标准的极早产儿共321例,图2显示,对照组186例,排除感染亚组、临床败血症亚组和确诊败血症亚组分别为102、80和4例;干预组135例,各亚组相应为58、70和7例。

图2 研究对象纳入和排除流程
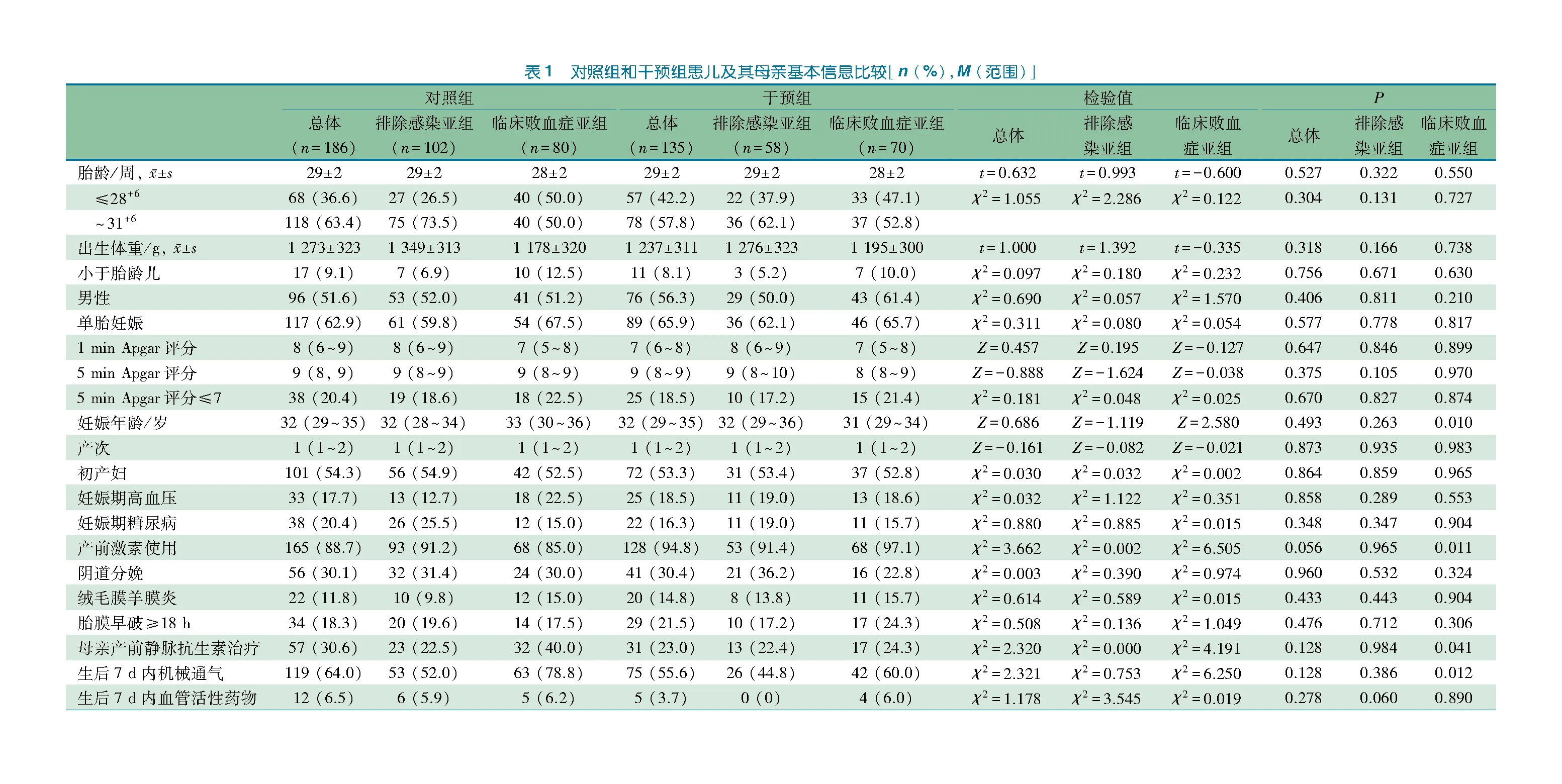
表1显示,干预组和对照组的总体和排除感染亚组分别比较,患儿因素、母亲因素和NICU治疗因素差异均无统计学意义;干预组和对照组的临床败血症亚组比较,患儿因素差异均无统计学意义,母亲因素中妊娠年龄、产前激素使用和产前静脉抗生素治疗差异有统计学意义,治疗因素中生后7 d内机械通气差异有统计学意义。
2.2 主要结局指标 鉴于对照组和干预组的确诊败血症亚组分别为4和7例,故不行统计学分析。表2显示,干预组和对照组的总体比较以及临床败血症亚组比较,早期抗菌药物停用率差异均无统计学意义;排除感染亚组的早期抗菌药物停用率干预组是对照组的2.8倍(OR=2.76,95%CI:1.28~5.94),差异有统计学意义。根据控制图的相关定义,图3显示,2021年11月至2022年11月经验性抗菌药物停用率平均值60.8%,2022年10~11月的经验性抗菌药物停用率CL出现明显上升,2022年11月起连续8个数据点在CL上方,说明ASP干预提高了经验性抗菌药物停用率。2022年11月至2023年7月经验性抗菌药物停用率CL平均值81.0%,符合连续8个数据点在CL上方提示ASP后经验性抗菌药物停用率显著上升了20.1%。
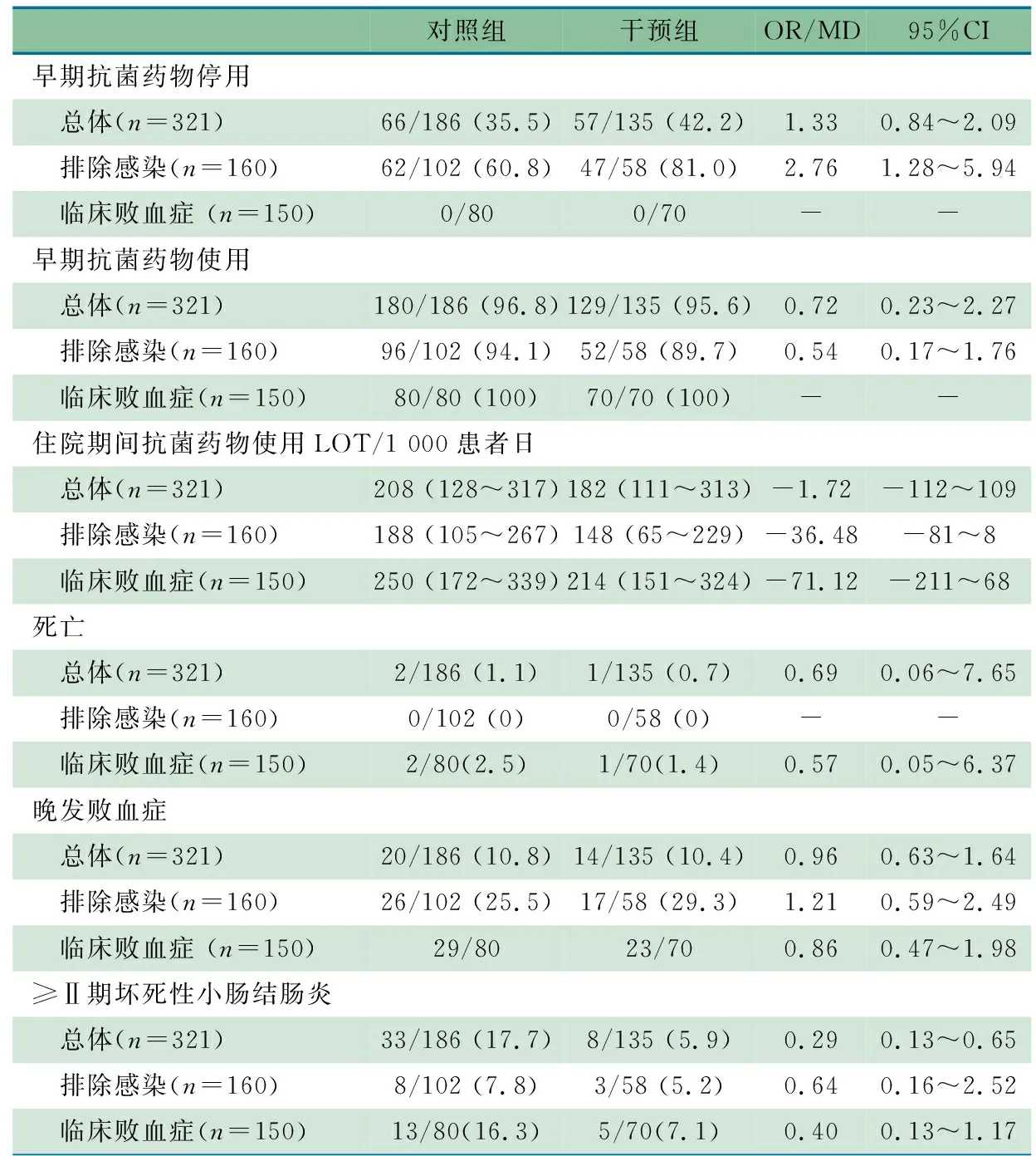
表2 对照组、干预组及其排除感染亚组、临床败血症亚组结局指标比较[n/N (%), M (范围)]

图3 排除感染患儿72 h内抗菌药物停用率统计过程控制图(SPC)
2.3 次要结局指标 表2显示,①干预组与对照组的总体、排除感染亚组、临床败血症亚组分别比较,住院期间抗菌药物LOT差异均无统计学意义。②干预组与对照组的总体、排除感染亚组、临床败血症亚组分别比较,早期抗菌药物使用率、死亡和晚发败血症差异均无统计学意义。③干预组与对照组总体NEC发生率差异有统计学意义,干预组发生NEC的风险低于对照组(OR=0.29,95%CI:0.13~0.65)。干预组和对照组的临床败血症亚组、排除感染亚组分别比较,NEC发生率差异无统计学意义。
3 讨论
本文以EOS经验性抗感染治疗为靶点,通过建立多学科ASP团队,结合EOS危险因素(低危、中危、高危)和疾病危重状态,评估和判断是否经验性使用抗菌药物,ASP每周对NICU每例极早产儿抗菌药物进行审查、提供建议方案、并在NICU主任医师主持下进行反馈,针对疑难病例随时进行科室讨论等一系列措施的实施,无早发感染极早产儿ASP后早期抗菌药物停用率是常规抗生素管理的2.8倍(OR=2.76,95%CI:1.28~5.94),但没有对住院期间抗菌药物使用LOT/1 000患者日,早期抗菌药物使用率,死亡、晚发败血症发生率和NEC发生率产生干预效应。
本研究极早产儿中,早发临床败血症的诊断比例近50%,明显高于国外[11],可能是所有患儿中早期经验性抗菌药物短疗程停用率无明显改善的重要原因。目前国内外缺乏关于临床败血症诊治的指南和规范,诊断标准有待进一步明确[23-25]。CRP是指导临床败血症诊断和抗菌药物使用的重要非特异性炎症指标之一,但其敏感性和特异性仍有争议[19,20]。本研究中,判断早发感染的CRP阈值为≥8 mg·L-1,连续2次CRP阴性才停用抗菌药物。但RCT证据表明,提高CRP阈值不影响诊断早产儿EOS的敏感度,在更高的CRP阈值下停用经验性败血症抗菌药物也不增加临床败血症复发率及病死率[26,27],且不增加临床败血症复发率及死亡率[26,27]。因此,部分早发临床败血症抗菌药物使用可能是不合理的,进一步评估临床败血症诊断标准的合理性是必要的,从而为后续规范临床败血症诊治提供参考。
本研究中,极早产儿生后经验性抗菌药物使用率明显高于发达国家[28],且ASP对其未产生干预效应。首先,胎龄是评估EOS发生风险的重要危险因素[29-32],数项在VLBW/胎龄<34周早产儿中实施ASP的研究中,早期抗菌药物使用率下降亦不显著[14,33]。其次,ASP降低早期抗菌药物使用率的幅度在不同国家/地区NICU间差异较大,提示抗菌药物使用习惯一定程度影响了是否给予经验性抗菌药物治疗。最后,我院NICU接收的新生儿病情相对危重,入院的极早产儿中约50%在生后7 d内接受机械通气治疗,病情危重程度也是影响抗菌药物使用的重要因素之一[34,35]。目前降低中国NICU极早产儿早期抗菌药物使用率存在困难,应注重在开始抗菌药物治疗后及时评估,缩短EOS低危患儿抗菌药物疗程。
ASP能够优化NICU抗菌药物使用[36],规范EOS经验性抗菌药物治疗、及时评估和停用可以作为NICU开展ASP的首要靶点。本研究提示,72 h内停用抗菌药物可能减少住院期间抗菌药物使用LOT,而在极早产儿中,充分的证据表明48 h抗菌药物治疗排除败血症是足够的,也有研究尝试将这一时间缩短至36 h且不增加死亡及不良临床结局的发生风险[11,30,37,38]。因此,我国NICU中早期抗菌药物使用仍存在较大的改进空间,后续进一步缩短EOS经验性抗菌药物疗程也许是可行的。
本研究局限性,①缺乏EOS相关临床表现、非特异性炎症指标等详细信息,限制了对EOS患儿未及时停用抗菌药物具体原因的分析;②虽提供了经验性抗菌药物使用的评估流程,但可能存在临床执行不严格的情况,制定规范的早发感染诊疗指南是必要的;③本研究ASP干预措施实施时间较短,其减少抗菌药物使用的持续性效果有待进一步证实;④本研究为单中心研究,限制了研究结果的外推性。

