新生儿周期性放电167例病例系列报告
方秀英 王英杰 毛 健
连续脑电图(EEG)监测是一种非侵入性实时监测大脑电活动的监测手段,逐渐成为神经重症监护单元必备的监护方式,也是判断惊厥发作的“金标准”。惊厥发作和惊厥持续状态具有较高的死亡风险[1]。因此,识别惊厥发作及其强烈相关的EEG模式至关重要。但有些脑电活动模式介于发作期和发作间期,如周期性放电(PDs)等。美国临床神经生理学学会(ACNS)[2]认为,脑电活动中PDs是发作期-发作间期连续体(IIC)。

本文回顾性收集住院新生儿连续视频EEG监测(vEEG)和病历记录,并与头颅MR结果对照,探讨新生儿PDs的发生率及其与惊厥发作之间的关系、病因学差异,观察PDs是否与脑损伤部位及程度相关。
1 方法
1.1 伦理 本研究为新生儿惊厥全国多中心研究项目的部分内容,获得中国医科大学附属盛京医院(我院)伦理委员会批准(2021PS631K)。
1.2 诊断标准
1.2.1 PDs判断标准 根据2021年ACNS标准化重症监护EEG命名法[2],PDs定义为具有相对均匀形态和持续时间的重复波形,重复波形之间具有清晰可辨的放电间隔,并且波形以几乎规则的间隔复发。当PDs与临床明显惊厥发作体征呈锁时关系,如局灶性阵挛动作、自动症发作等,则认定为惊厥发作期EEG改变,排除PDs诊断。根据PDs发放部位,分为单灶(一个导联单独出现或2~3个相邻导联同步出现)、多灶(≥2个非相邻导联非同步独立出现),一侧半球(一侧半球所有导联同步出现)和双侧半球(双侧半球全部导联同步出现)(图1)。
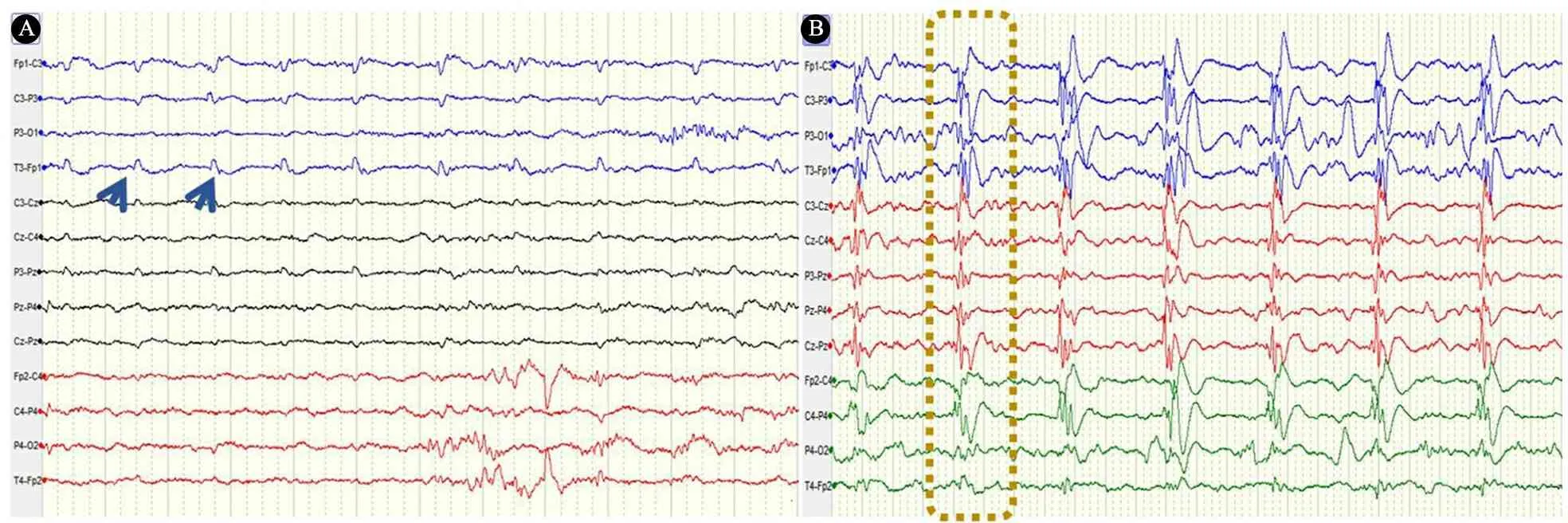
图1 周期性放电的不同形式注 A图波形简单,局灶性周期性放电(蓝色箭头所示);B图波形复杂,双半球同步性周期性放电(黄色虚框所示)

1.3 头颅MR检查及结果判读 头颅MR检查采用 Philips Intera Achieva 3.0 T MR 仪进行常规T1加权成像、T2加权成像及弥散加权成像序列扫描,具体扫描参数根据具体疾病诊断需要而定[13]。根据MR提示损伤的部位及范围[14-16],分为未见明显损伤、局灶或多灶性微小脑白质损伤、一侧半球大面积损伤和广泛性全脑性损伤。
1.4 脑电监测方法及结果判读 电极安放参考国际标准10-20系统及新生儿EEG标准,采用Nicolet Monitor脑功能监护仪记录脑电图,记录导联包括 FP1、FP2、C3、C4、P3、P4、O1、O2、T3、T4、Cz、Pz。脑电图导联低频滤波0.5 Hz,高频滤波70 Hz,时间常数0.3 s,灵敏度7 μV·mm-1,监测脑电的各电极阻抗<1.0 kΩ,单次监测时长≥4 h。
1.5 病例纳入标准 同时满足以下各项:①2018年1月至2022年12月于我院新生儿科住院确诊或疑诊存在脑损伤的患儿,在院期间至少完成1次vEEG监测;②存在惊厥发作或惊厥发作高危儿,发作3 d内完成首次vEEG监测;③监测中曾出现过PDs; ④惊厥发作起病7 d内在我院行头颅MR检查。
1.6 资料采集 对符合纳入标准的每个病例,①在我院新生儿EEG报告数据库找出所有原始vEEG监测资料,由2名神经电生理医生依据国际新生儿脑电解读规范指南[12],对vEEG资料进行分析;②在我院影像科数据中调出头颅MR影像,由专业影像科医生和新生儿科医生共同重新阅片做出判断;③由1名新生儿科医生对患儿病历信息进行汇总分析,包括基本情况(性别、胎龄、出生体重),基于出院诊断中导致脑损伤或惊厥的主要致病病因,分为缺血缺氧性脑病(HIE)、动脉缺血性卒中、颅内出血(包括脑室内出血、蛛网膜下腔出血等)、颅内感染、基因异常、代谢紊乱(低血糖、低钙、代谢异常等)、脑结构发育异常(多小脑回畸形、巨脑回等)、脑白质损伤和不明原因惊厥。
1.7 统计学方法 采用SPSS 22.0软件进行统计学分析。计数资料以n(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 研究期间共4 685例新生儿完成17 803例次vEEG监测,其中183例发现PDs现象,167例(605例次)符合本文纳入标准进入本文分析,其中139例于起病7 d内完成首次vEEG监测,28例于起病后7~14 d内完成首次监测。住院期间完成vEEG监测1次35例,~6次109例,≥7次23例。表1显示,167例存在PDs的患儿中,足月儿142例(85.0%),在已知明确病因中,最常见病因为HIE、脑白质损伤和颅内感染;早产儿25例(15.0%),最常见病因为颅内出血、脑白质损伤和HIE。
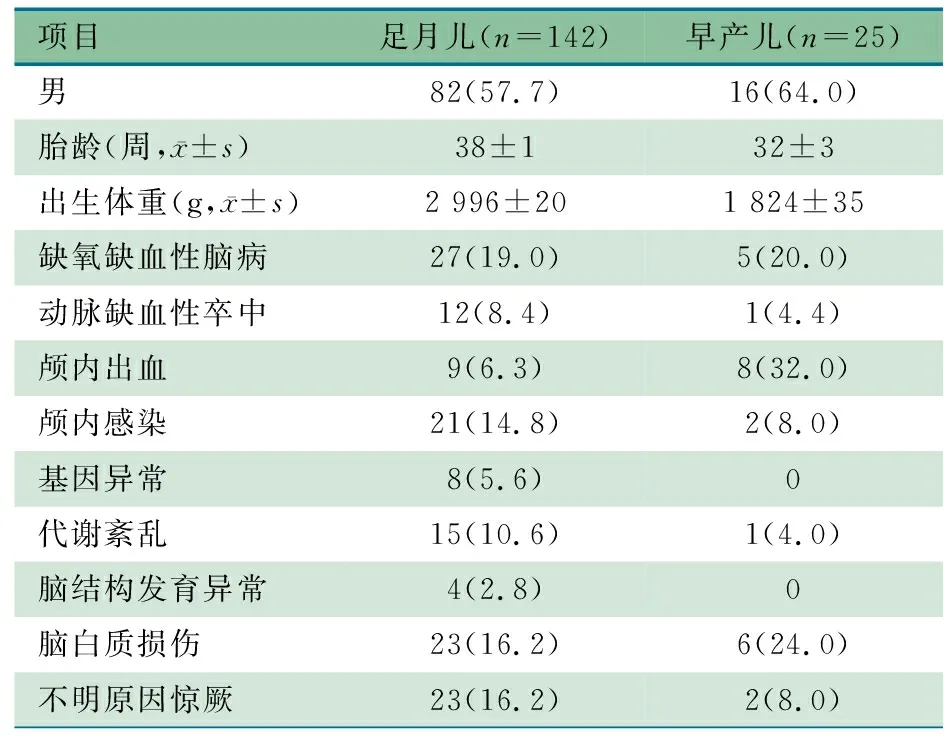
表1 一般资料[n(%)]
2.2 惊厥发作 表2显示,167例存在PDs的患儿中,143例(85.6%)于vEEG监测前疑似出现惊厥发作。156例(93.4%)于监测中出现电-临床发作或电发作,其中85例(54.5%)为多次发作或频繁发作,58例(37.1%)达到SE。足月儿和早产儿在多次-频繁发作和SE发作负荷上差异无统计学意义(P>0.05)。
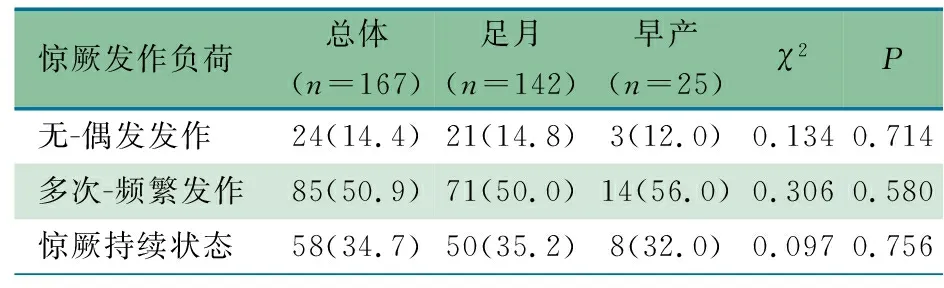
表2 足月儿和早产儿的惊厥发作负荷[n(%)]
2.3 PDs出现部位 表3显示,167例存在PDs的患儿中,68例(40.7%)在某一脑区单灶反复出现,47例(28.1%)呈多灶非同步发放,29例(17.4%)呈一侧半球同步出现,23例(13.8%)双半球同步出现。单灶反复出现和多灶非同步发放的115例中,89例(77.4%)涉及中央区和/或中线区以及颞区。HIE存在PDs 32例中,以单灶(20例,62.5%)、多灶(8例,25.0%)和双侧半球(4例,12.5%)多见,差异有统计学意义;动脉缺血性卒中存在PDs 13例中,以一侧半球(9例,69.2%)和单灶(4例,30.8%)多见,差异有统计学意义;颅内出血存在PDs 17例中,以多灶(9例,52.9%)、一侧半球(6例,35.3%)和单灶(2例,11.8%)多见,差异有统计学意义;颅内感染存在PDs 23例中,以多灶(11例,47.8%)、一侧半球(7例,30.4%)和双侧半球(3例,13.1%)多见,差异有统计学意义;脑白质损伤存在PDs 29例中,以单灶(18例,62.1%)、多灶(8例,27.6%)和一侧半球(3例,10.3%)多见,差异有统计学意义;不明原因惊厥存在PDs 25例中,以双侧半球(12例,48.0%)、单灶(9例,36.0%)和多灶(3例,12.0%)多见,差异有统计学意义。基因异常存在PDs 8例中,以单灶(5例,62.5%)多见;代谢紊乱存在PDs 16例中,以单灶(7例,43.8%)多见;脑结构发育异常存在PDs 4例中,以一侧半球(2例,50.0%)多见,差异有统计学意义。
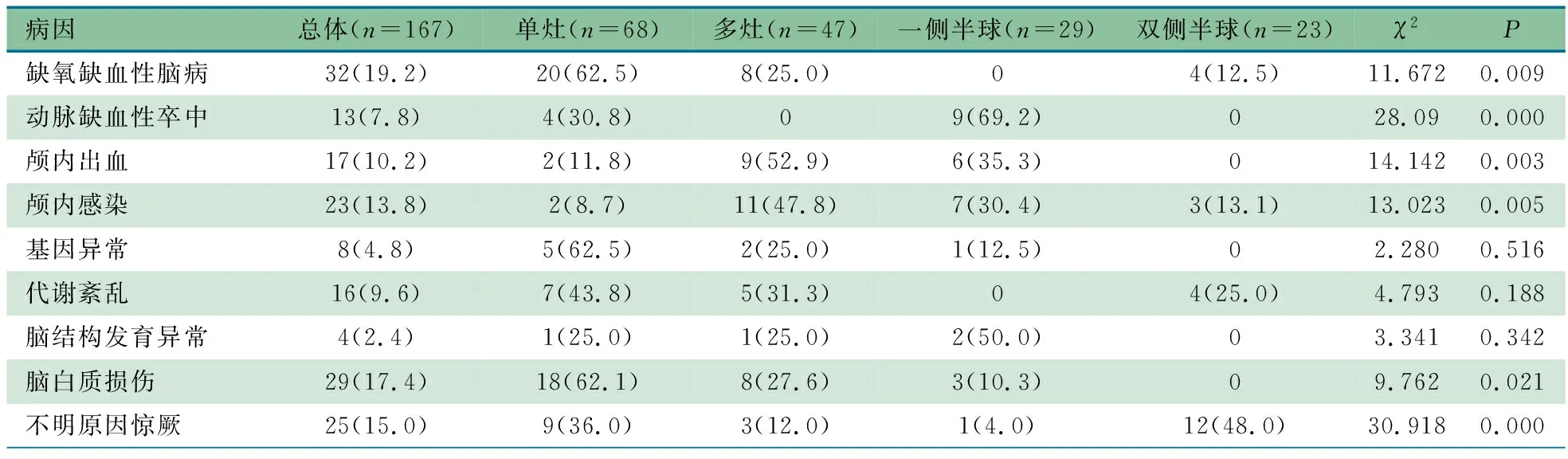
表3 PDs发放部位与病因对比[n(%)]
2.4 与头颅MR检查对比 表4显示,167例存在PDs的患儿中,38例(22.8%)无明显脑损伤但存在PDs,以双侧半球(15例,39.5%)、单灶(14例,36.8%)和多灶(7例,18.4%)多见,差异有统计学意义;129例(77.2%)不同部位的脑损伤存在PDs,其中局灶或多灶性微小白质损伤79例,以单灶(49例,62.0%)、多灶(19例,24.1%)和一侧半球(9例,11.4%)多见,差异有统计学意义;一侧半球大面积损伤28例,PDs以一侧半球(17例,60.7%)、多灶(6例,21.4%)和单灶(5例,17.9%)多见,差异有统计学意义;广泛性全脑性损伤22例,以多灶(15例,68.2%)和双侧半球(6例,27.3%)多见,差异有统计学意义。
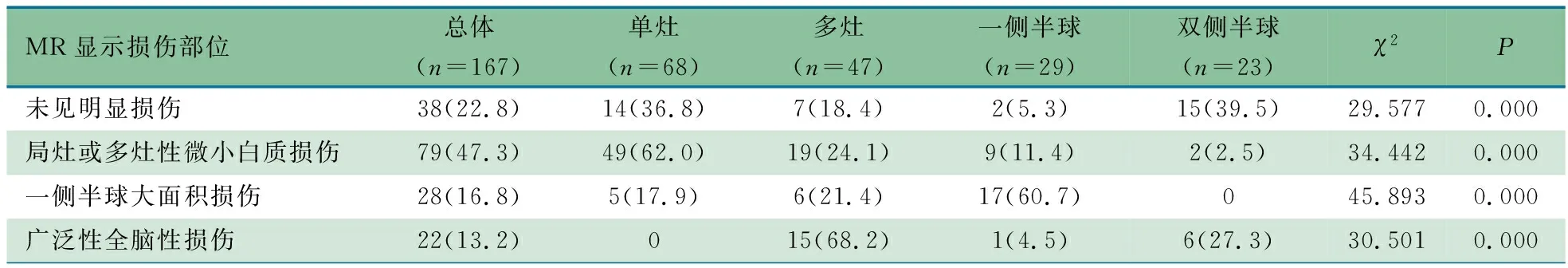
表4 PDs发放部位与MR损伤部位对比[n(%)]
2.5 典型病例 男,G1P1,胎龄41+3周,剖宫产娩出,出生体重4 200 g,Apgar评分1、5和10 min均为10分。出生后15 h出现抽搐发作。出生后30 h 行vEEG监测(图2A和B)结果显示,T3导联即左颞区出现PDs,放电间隔平均800 ms,PDs持续数十秒至数分钟,出生第5天,DWI显示左颞、顶区及胼胝体压部呈弥散受限高信号(图2C箭头所示),为细胞毒性水肿,PDs发放部位及左侧大脑半球与头颅MR提示损伤部位一致。
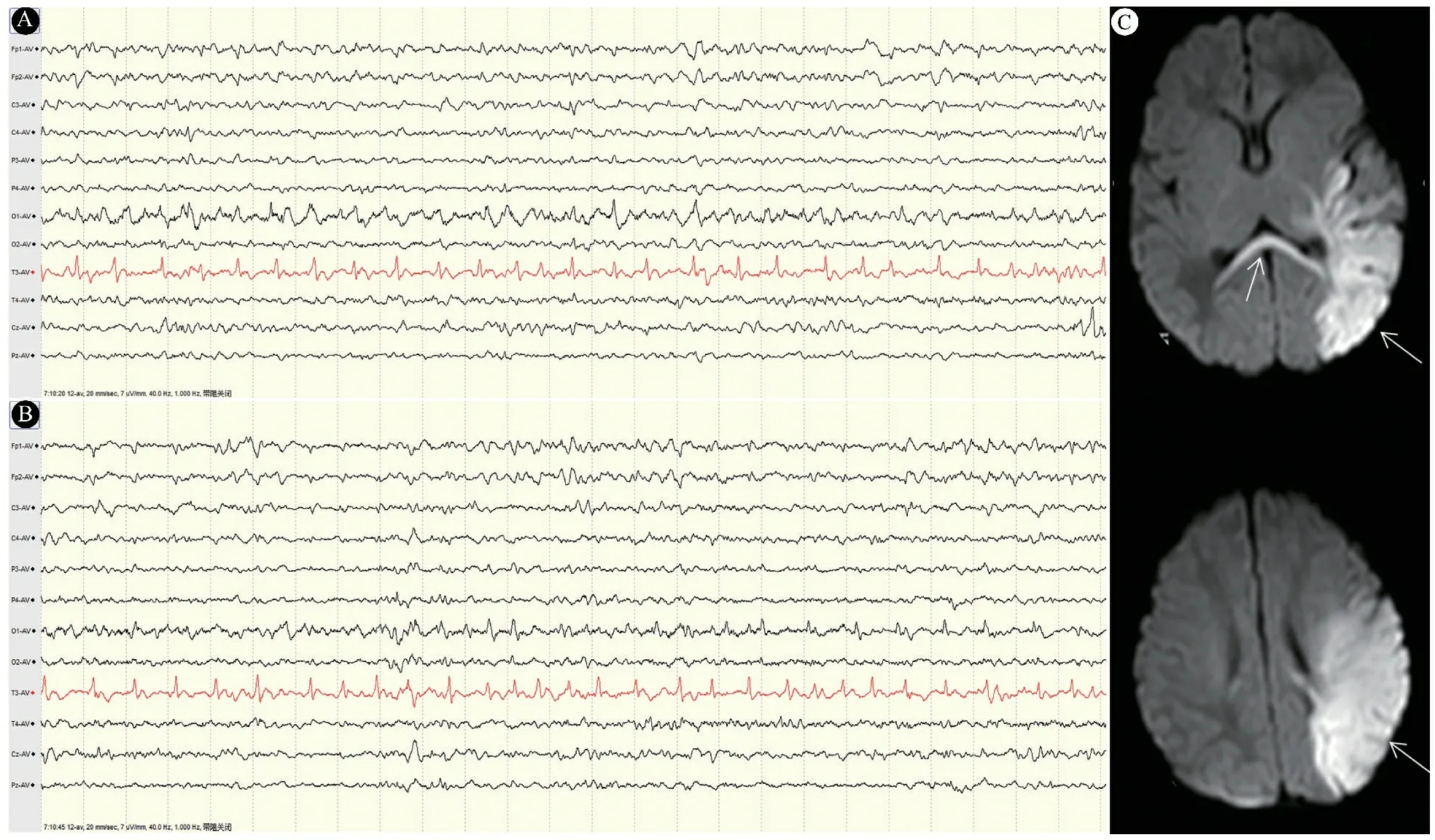
图2 典型病例vEEG监测和头颅MR注 A和B:出生后30 h vEEG监测;C:DWI显示左颞、顶区及胼胝体压部呈弥散受限高信号(箭头所示)
2.6 PDs转归 132例完成2次及以上监测的患儿中,58例(43.9%)于起病后第1~7天PDs逐渐消失,37例(28.0%)于第8~14天复查时消失,16例(12.1%)于第15~32天复查时消失,21例(15.9%)多次复查PDs持续存在,其中包括4例先天性脑结构发育异常及8例基因异常患儿。
3 讨论
本文新生儿期PDs的出现率为3.6%,HIE、脑白质损伤、颅内感染及颅内出血是PDs最常见病因。PDs出现于脑损伤的急性期,病程中多出现电-临床发作或电发作,且惊厥负荷较高,甚至达到SE。通过对比头颅MR,发现PDs发放部位与脑损伤的位置密切相关。
既往报道PDs在新生儿EEG监测中出现率较低,Scher等[9]曾在592例新生儿的1 114份EEG记录中,发现34例(5.7%)患儿出现PDs。实际上,由于过去监测方法的不完善、监测的时机不同以及对PDs的判别标准不一等原因,推测新生儿期PDs的发生率可能并不像文献报道中那么低,需要在未来对新生儿脑电活动研究中特别关注此类脑电现象。
新生儿期PDs产生的病因多种多样,足月儿中HIE、脑白质损伤和颅内感染是已知病因中最常见的,与成人及儿童相似[6, 17-20],而早产儿中则为颅内出血、脑白质损伤及HIE。除了以上几种病因外,先天性脑发育异常和遗传代谢病是新生儿期特有的病因[9]。成人人群中颅内肿瘤等慢性病病因在新生儿或早产儿中罕见。
本文病例中PDs可出现于任何脑区,以单灶或多灶非同步发放模式最多见,多涉及中央区及颞区。双半球同步出现现象最少见,推测可能与新生儿脑发育不成熟以及神经系统髓鞘化尚不完善有关。本研究中因早产儿病例数少,尚未发现PDs发生部位与大脑发育成熟度相关。将PDs发生部位与影像学改变对比发现,PDs发放部位及侧别与头颅MR提示损伤部位一致。以往影像学研究也发现67.4%的成人患者出现与PDs大脑半球侧别一致的MR异常,多与对应的大脑局部皮质、灰质和邻近白质的急性结构病变相关[21]。本文中有22.8%患儿影像学检查未见明显损伤,提示PDs的发生也可能与大脑局部功能紊乱相关。

在大多数情况下,PDs在8~10 d后消退[24]。新生儿期尽管病因不同,但本文存在PDs的患儿中72.0%于起病1~14 d内PDs随着发作的停止,逐渐消失。说明其具有自限性特点,可能代表急性脑损伤的愈合过程或惊厥发作恢复阶段。然而,在罕见的情况下,PDs也存在于慢性期,在无症状患者中长达20年均可观察到[25]。

本研究总结分析新生儿时期PDs脑电现象,发现与结构性脑损伤部位及病程相关。PDs可以视为新生儿脑损伤急性期的特征性EEG改变之一,与惊厥发作可能有相同的病理生理机制。对新生儿期PDs脑电模式的临床意义的正确判断和解读是制定最佳管理策略的基础,并提高新生儿vEEG监测资源的利用效力。

