氮添加对稀土尾砂地猴樟幼苗根系生长、生物量分配及非结构性碳水化合物的影响
陈志琪 张海娜 刘佳丽 鲁向晖 杨宝城
(南昌工程学院江西省樟树繁育与开发利用工程研究中心,南昌 330099)
我国南方赣南、闽西、粤北等地区拥有大量的稀土资源。自20 世纪80 年代以来,由于工业产品的大量需求,稀土资源被大规模开发,经历了池浸、堆浸、原位浸矿等无序开采工艺,导致当地植物遭到大面积破坏,遗留大面积的稀土尾矿废弃地[1]。这些废弃尾砂土壤结构遭到严重破坏,保水保肥能力差,且土壤酸化,营养元素缺乏[2],导致尾矿地植被恢复受限。已有研究表明,樟树(Cinnamomum camphora)可以在稀土尾砂上种植[3]。樟树作为江西省的特色经济植物,其作为香料的应用价值得到广泛关注。猴樟(C.bodinier)作为樟科(Lauraceae)樟属(Cinnamomum)的常绿乔木,其枝叶富含精油,目前以矮林栽培方式种植,每年地上部分被平茬提油。为了满足新一轮枝叶的连续生长,每年需补充大量氮肥,而尾砂保肥能力差,多余氮肥会造成更为严重的水土流失和面源污染问题。因此,在稀土尾砂植被恢复中,需要更为科学的施肥管理。
氮素作为植物的生命元素,影响着植物生长、营养元素的吸收利用和能量物质的贮藏等[4]代谢过程。通常情况,植物生长受氮限制时,氮添加有益于植物生长[5];而在氮相对丰富的区域,氮添加反而会抑制植物生长,降低植物生产力[6]。例如:高钿惠等[7]研究发现不同氮水平对中金杨(Populus×euramericana‘Zhongjin7’)幼苗的生长促进效果不同,其中高氮水平会抑制植物根系生长,影响生物量的积累;高晋丽等[8]的研究显示,高浓度氮素添加能够显著促进大兴安岭冻土区表层土壤(0~ 20 cm)中植物细根的生长;董姣姣等[9]和裴昊斐等[10]的研究发现适量添加氮会促进植物的生长和生物量的积累,并显著提高植物的生产能力,但更高水平的氮添加可能对植物生长产生一定抑制作用。由此可见,不同环境中植物对氮元素的需求量不同。稀土尾砂地土壤环境相对缺氮,在稀土尾砂地进行氮添加是否会影响植物体内营养物质的储存与转化目前尚不清楚。
非结构性碳水化合物(Non-structural carbohydrates,NSC)以可溶性糖和淀粉的形式为植物生长提供所需要的能量[11],其中可溶性糖(Soluble sugars,SS)是植物体内碳水化合物运输的主要形式,淀粉(Starch,St)是植物碳的主要储存物质,两者在一定条件下可以相互转换以维持正常的生理活动[12]。植物叶片光合作用新合成的碳和同化物,通过维管束运输,转移至茎秆或根中,当环境变化时,非结构性碳水化合物在植物不同组织的分配可能会发生变化,进而影响植物的生长和对环境变化的响应策略[13]。以往研究表明,缺氮时植物会增加分配到根系的碳水化合物比例,以促进氮的吸收[14],而氮有效性的增加则会导致更多的碳水化合物分配到地上组织[15],对杉木(Cunninghamia lanceolate)来说,氮添加则会降低叶片可溶性糖和NSC 含量[16];而史增顺等[17]的研究表明,氮添加会使细根比根长、比表面积增大,但NSC 含量降低,尤其是淀粉含量。造成这些影响的原因可能与植物对氮素的敏感性和具体的施氮水平有关。
基于此,本研究以寻乌县某典型稀土矿尾砂为基质,通过1 年生猴樟扦插幼苗的盆栽试验,研究氮添加对稀土尾砂基质中猴樟幼苗生长及非结构性碳水化合物含量的影响,为离子型稀土矿尾砂地生态修复提供理论参考。
1 材料与方法
1.1 研究区概况
试验在南昌工程学院生物技术试验基地进行(28°41′40.85″N,116°1′41.18″E)。该基地位于南昌市,属亚热带湿润季风气候,年降雨量1 600~1 700 mm,4—6 月为雨季,7—9 月为季节性干旱期,年平均相对湿度为78.5%,年日照时间为1 723~1 820 h。
供试植物为长势良好且均一的1 年生猴樟扦插幼苗,供试尾砂取自江西省赣州市寻乌县某废弃稀土矿。稀土尾砂的理化性质如下:土壤pH=5.08,属于强酸性,电导率高达79.12 dS·m-1,尾砂中土壤有机碳、有机质、全氮、全磷质量分数分别为6.29、10.85、0.20、1.21 g·kg-1,速效磷和速效钾质量分数分别为13.78、225.97 mg·kg-1。
1.2 试验设计
本研究采用盆栽控制试验。2022 年4 月初将30株长势均一的1年生猴樟扦插幼苗(株高28 cm,地径0.5 mm)移栽至底部开孔的塑料盆中(盆口直径29 cm,盆高16 cm),每盆1 株,盆中装入供试尾砂土8 kg,定期浇水,缓苗1 个月。为了促进香料用樟树的生长,当地农民会在樟树平茬之后进行施肥。本研究以硝酸铵钙为N源(含N 15%),共设置3个氮肥添加处理,分别为CK(0)、N1(1.8 g·株-1)、N2(3.6 g·株-1)。试验设计中,N1 施氮量根据当地农民常用的施肥量来定,并换算成单一元素的化肥施用量,为1.8 g·株-1;N2 施氮量根据冯瑜等[18]的研究来确定,发现氮、磷、钾施用量为2.5 g·株-1时对樟树生长的促进作用明显,产生的水土流失量较小,经换算后N2 的施肥量定为3.6 g·株-1。试验采用单因子三水平随机试验,每个处理10 盆,于当年5—8 月进行氮添加试验。施肥时,在樟树幼苗周围开挖环状施肥沟,将硝酸铵钙溶于200 mL 水均匀施入沟中,每月定期1 次。试验期间不同处理的植株随机摆放。生长期末,即10月15 日对所有植株进行破坏性采样,然后将每株植物分为根、茎、叶,分别装入自封袋中,带回实验室进行分析。
1.3 测定方法
根性状测定:根系采用“全根法”进行挖掘。首先将地上部分齐地剪断,然后沿着每条根的走向,用镊子和小铲子挖出根系并用清水冲洗干净,最后将粗根(直径>2 mm)和细根(直径≤2 mm)分开。根性状指标通过根系扫描仪(Epson Perfection V850 Pro,中国)和根系分析系统WinRHIZO获得,包括根长、根表面积、根直径。
生物量测定:将植物不同组织和扫描后的根系分别装入信封标记,105 ℃杀青30 min,之后80 ℃烘至恒质量,获得植株不同组织的生物量。其中,总生物量为各组织生物量之和;冠层生物量为叶、茎生物量之和;不同组织生物量占比为各组织生物量与总生物量之比。由于樟树叶片中的精油含量最高,而叶茎比反映了植物枝叶间光合产物的分配和积累状况,是樟树精油含量的重要指标,因此本试验增加了叶茎比指标。比根长(SRL)用根长/根干质量表示;比表面积(SRA)用根表面积/根干质量表示。
NSC 测定:NSC 包括可溶性糖和淀粉[19]。将烘干后的植物组织粉碎研磨、过0.25 mm 筛,用于NSC 含量测定。NSC 含量采用硫酸蒽酮法[20]测定。
1.4 数据处理
数据的统计分析用SPSS 26.0 进行,利用单因素方差分析检验氮添加对植株根系性状、总生物量和不同组织的生物量及NSC 含量的差异显著性。作图通过Origin 2018完成。
2 结果与分析
2.1 氮添加对猴樟幼苗生物量及分配的影响
不同水平的氮添加均能促进猴樟幼苗各组织及总生物量的增加,其中叶、茎、粗根、细根、冠层和总生物量均在N1 处理下最高,分别比CK 高392.78%、86.95%、116.17%、99.39%、170.99%、149.99%,也显著高于N2(P<0.05);N2 处理下的茎、根和总生物量与CK 无显著差异(P>0.05)。根冠比在N1 和N2 水平下分别降低了8.33%、31.67%,叶茎比在N1 和N2 处理下分别比CK 显著增加了163.16%、213.16%(P<0.05)(见表1)。
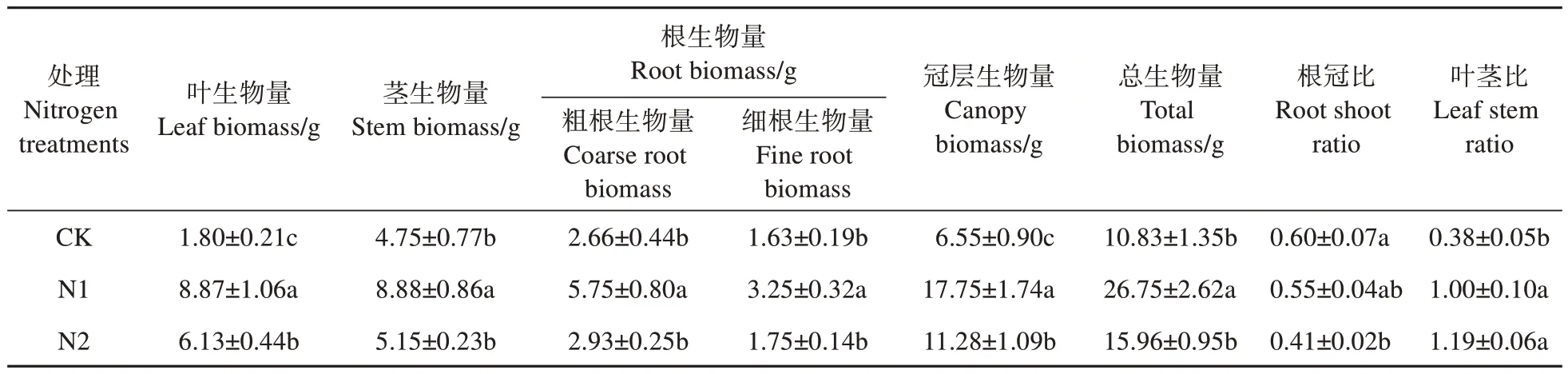
表1 不同氮水平对猴樟幼苗生物量的影响Table 1 Effects of different nitrogen levels on biomass of C. bodinieri seedlings
与CK 相比,叶比重在N1 和N2 水平下显著增加了123.53%、92.94%(P<0.05);N1 和N2 水平下,茎比重分别降低了9.46%、19.26%,而两者之间无显著差异(P>0.05),粗根比重较CK 分别显著降低了17.90%、27.63%(P<0.05),细根比重分别显著降低了27.16%、32.10%(P<0.05)(见表1、图1)。
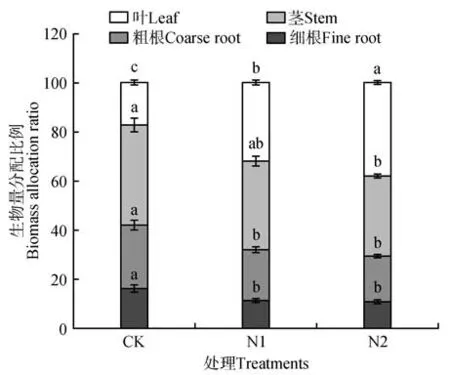
图1 不同氮水平下猴樟幼苗生物量的分配不同处理间,同一种生物量上的不同小写字母表示差异显著;下同。Fig.1 Biomass allocation of C. bodinieri seedlings under different nitrogen levels Different lowercase letters indicate significant differences among treatments(P<0.05);the same as below.
2.2 氮添加对猴樟幼苗根系生长的影响
与CK 相比,N1 和N2 水平下猴樟幼苗的粗根根长分别显著增加了85.66%、57.49%(P<0.05),不同施氮水平间无显著性差异(P>0.05)(见图2A);粗根表面积在N1 处理时显著高于CK 与N2(P<0.05)(见图2B);粗根直径在施氮条件下均低于CK,不同施氮水平间差异不显著(P>0.05)(见图2C);粗根比根长在N2 水平下分别比CK、N1增加了81.19%、23.27%(见图2D);粗根比表面积在N2 水平下显著高于CK 和N1(P<0.05)(见图2E)。
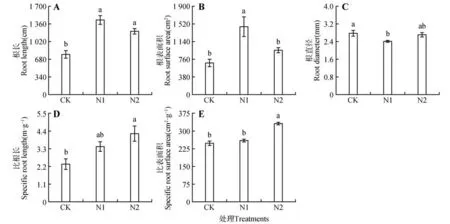
图2 不同氮水平下猴樟幼苗粗根性状Fig.2 Coarse root traits of C. bodinieri seedlings under different nitrogen levels
与CK 相比,细根根长在N1 和N2 水平下分别显著增加了123.81%、73.27%(P<0.05)(见图3A);细根表面积在N1 和N2 水平下分别比CK 显著增加了69.66%、46.93%(P<0.05)(见图3B);细根直径在N1条件下均低于CK和N2,且与CK有明显差异(P<0.05)(见图3C);细根比根长在N2 处理下最大,显著高于CK(P<0.05),不同施氮水平间差异不显著(P>0.05)(见图3D);细根比表面积在N2处理时最大,显著高于CK(P<0.05)(见图3E)。
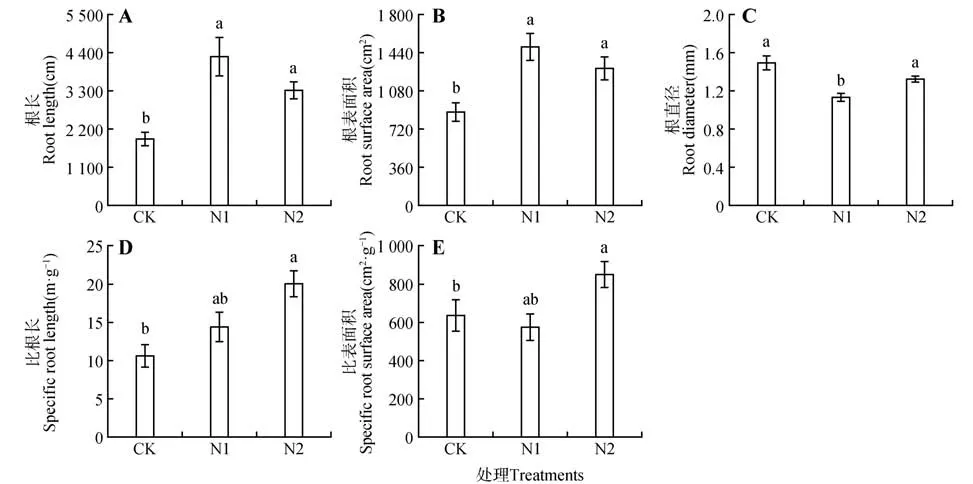
图3 不同氮水平下猴樟幼苗细根性状Fig.3 Fine root traits of C. bodinieri seedlings under different nitrogen levels
2.3 氮添加对猴樟幼苗非结构性碳水化合物的影响
不同氮添加处理对猴樟幼苗的叶、茎、粗根、细根4个组织的可溶性糖质量分数均有影响(见图4:A~D)。叶、茎可溶性糖质量分数均在N1 处理下质量分数最高,N2处理最低,N1处理下叶、茎中可溶性糖质量分数分别比CK、N2 提升了9.14%、26.59%、1.13%、13.56%(见图4:A~B)。此外,氮添加也会影响猴樟幼苗各组织的淀粉质量分数(见图4:E~H)。N1 处理下的叶淀粉质量分数最低,分别比CK、N2 降低了43.14%、29.17%(见图4E),并且CK 与N1 间差异显著(P<0.05);茎中的淀粉质量分数在N2处理下最低,分别比CK、N1降低了39.40%、6.01%(见图4F);粗根中的淀粉质量分数以N2 最低,比N1 显著降低37.93%(P<0.05)(见图4G)。N1、N2中的叶NSC质量分数分别比CK降低6.43%、12.28%(见图4I)。茎中的NSC质量分数以N2 处理最低,比CK 显著降低了14.29%(P<0.05)(见图4J)。N2 处理下粗根、细根中的NSC 较CK显著降低了53.41%、46.49%(P<0.05)(见图4:K~L)。叶的NSC 质量分数要明显高于茎、粗根与细根(见图4:I~L)。猴樟幼苗叶片的可溶性糖质量分数占NSC 的77.41%~93.21%,淀粉质量分数为13.18%~22.59%,茎、粗根与细根的表现相同。
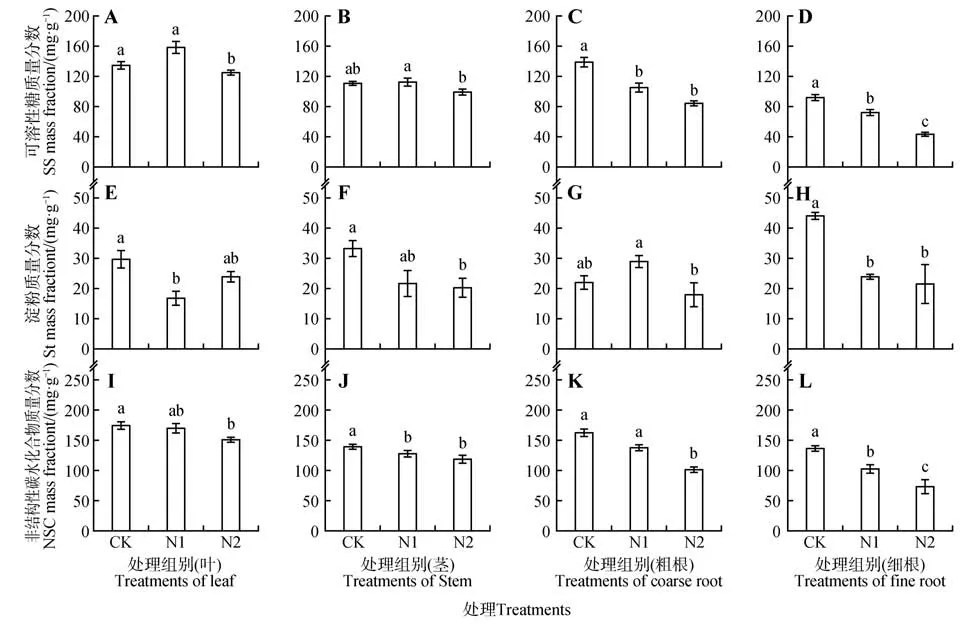
图4 不同氮水平对猴樟幼苗非结构性碳水化合物的影响Fig.4 Effects of different nitrogen levels on non-structural carbohydrates of C. bodinieri seedlings
3 讨 论
3.1 氮添加对猴樟幼苗生物量及分配的影响
生物量是光合产物积累的结果,氮的供应状况会影响植物对碳同化物质的分配格局和生物量的积累[21]。本研究中,猴樟幼苗叶、茎、粗根、细根生物量均在N1 处理下最高,显著高于N2 处理(P<0.05),说明低氮条件有利于促进猴樟幼苗的生物量积累,这与李树萍等[22]对树番茄(Cyphomandra betacea)的研究结果相似,树番茄的生物量在低氮条件下最高。齐成媚等[23]的研究发现,高氮水平对假臭草(Praxelis clematidea)生物量累积的效果最佳,这与本研究结果不同,原因可能是假臭草属于草本植物,对环境要求不高,且对土壤肥力的吸收能力较强,猴樟是木本植物,两者对氮素的响应不同。氮添加有利于提升植物光合作用产生有机物的能力,使植株生物量的积累效率得到提高[24]。猴樟幼苗的叶、茎生物量在N1、N2 处理时均高于CK,并且N1 处理的提升效果显著高于N2(P<0.05),说明N1条件下的氮添加量更能促进猴樟幼苗叶、茎生物量的积累,表明不同浓度氮添加处理下植物对养分吸收效率的提升效果不同。毛晋花等[25]的研究表明也说明了这一点。本研究还发现,N1 处理下猴樟幼苗的粗根、细根生物量均显著高于CK(P<0.05),而N2 处理时与CK 无明显差异(P>0.05),且N1处理的根生物量均显著高于N2(P<0.05)。这可能是因为低浓度氮添加(N1)条件下猴樟幼苗根的生长不会受限,而高浓度氮添加(N2)时,尾砂中的可利用氮源大幅增加,植物会减少叶片向根系分配的碳量,导致根发育所需的养分缺失,从而抑制根的生长。
氮素营养的改变还影响植物体内的碳分配格局[26]。植物不同组织中的生物量占比反映了植株分配给各组织生物量的比例,是判断植物生长状况的重要指标。本研究中,猴樟幼苗的叶比重在N2 处理时最高,说明相比于N1 添加水平,氮浓度更高的N2 处理更有利于叶生物量积累。这与王立冬等[27]对木荷(Schima superba)的研究结果相似,其研究结果表明,较高铵态氮浓度处理显著提升了木荷的叶生物量。根冠比反映了生物量在地上和地下部分之间分配的情况。本研究结果显示,猴樟幼苗根比重、根冠比在施氮条件下均低于CK,且N2处理差异最显著(P<0.05)。而高歌等[28]的研究发现,与不施氮相比,施氮后杉木(Cunninghamia lanceolate)、青冈(Quercus glauca)的根生物量比、根冠比均显著降低(P<0.05)。氮添加可能会增加土壤中N 的有效性[29],随着氮的施入,植物生长的资源限制由氮变成碳。因此,植物需要更多的叶片来获取更多的二氧化碳,从而导致植物的根系发育受到抑制,使植物根生物量下降。吴茜等[30]的研究显示氮添加后枫香(Liquidambar formosana)、木荷(Schima superba)、秃瓣杜英(Elaeocarpus glabripetalus)和青冈的根冠比与根比重均显著低于CK(P<0.05);而王晓荣等[31]发现氮沉降能够显著提升枹栎(Quercus glandulifera)的根冠比(P<0.05)。这些研究结果表明了不同植物间的根冠比对于氮添加的响应具有一定的差异。本研究发现,猴樟幼苗的茎、粗根、细根占比、以及根冠比在N2 水平下最低,而叶茎比在N2 时最高,说明高氮水平下,尾砂中氮元素含量较充足,植物会减少向根系分配碳元素的比例,从而改变植物地面部分与地下部分的碳分配格局[32]。
3.2 氮添加对猴樟幼苗根系生长的影响
根长、根表面积、根直径等根系形态指标与植物的生长发育有着密切联系,因其具有对环境变化敏感且可塑性强等特点,常被用于分析植物对环境的适应能力[33]。在逆境环境中,植物可以提高根系的碳投入量(如提高根冠比或总根长)、减小根系直径来降低根系的构建成本,以扩大根吸收面积来适应环境[34]。本研究中,无论粗根还是细根,其根长和根表面积在不同氮浓度处理下均有所增加,而根直径存在降低的情况,且N1 处理下的根直径均低于CK 与N2,这与高晋丽等[8]的研究结果相似。植物对营养元素的吸收主要通过细根来实现,细根比根长与比表面积体现了植物对营养资源的吸收能力[35]。本研究中细根的比根长、比表面积均以N2 处理下最佳,说明高浓度氮添加(N2)更有利于提高植物对养分的吸收效率,这与史顺增等[17]的研究结果相似。稀土尾砂的氮含量较低,植物可利用的氮元素较少,氮添加使土壤可利用氮增加,提高植物的净光合速率,从而提升植物的生产力,促进植物的生长[36]。本研究结果显示,与CK 相比,猴樟幼苗根长、根表面积在施氮条件下均有显著增加(P<0.05),其中N1 处理的提升效果高于N2,表明低氮(N1)条件更适合猴樟幼苗根系生长。这与郝龙飞等[37]对樟子松(Pinus sylvestrisvar.mongolica)的研究结果相似,其研究结果表明,高浓度氮添加会使樟子松根长、根表面积等根系形态指标下降。这可能是由于氮添加对植物生长的促进作用是有一定范围的,超过这个范围,植物的生长就不再受到氮输入的正面影响,甚至会出现抑制生长的现象[38]。
3.3 氮添加对猴樟幼苗NSC的影响
不同氮添加下植物各组织间的NSC 及其组分的分配格局体现了植物对其生活环境条件的适应[39]。本研究中,猴樟幼苗各组织NSC 含量由高到低依次为:叶、粗根、茎、细根。这可能是由于叶是植物NSC 的主要合成部位[40],根是NSC 的主要储存部位[41],植物完成NSC 合成后首先需要满足叶的需求,其次多余的NSC 再通过茎运输至根储存,同时一部分NSC 也会储存于茎中,而细根是养分吸收部位,NSC 含量低,这与吕茹冰等[42]的研究结果相似。本研究还发现,不同氮添加对猴樟幼苗叶、茎、粗根、细根等不同组织的可溶性糖、淀粉、NSC含量的影响不同,N1处理下叶中的可溶性糖高于CK,而N2 条件下却显著低于CK 与N1(P<0.05)。这可能是因为低浓度氮添加会提高植物叶片的光合速率,促进植物光合作用合成和积累有机物的能力[43],而氮浓度过高则会引起叶片的气孔导度下降,减弱叶片的净光合速率,使幼苗光合生产力受到抑制,导致植物积累有机物的能力下降[44]。叶、茎、细根中淀粉含量在施氮条件下均低于CK,不同施氮水平间差异不显著(P>0.05),其中,茎、细根在N2处理下显著低于CK(P<0.05),说明高氮条件下植物茎、细根中淀粉的积累受到抑制,导致根系生长受到影响,闫道良等[45]的研究也说明了这一点。而且,植物不同组织的NSC 含量对N 添加表现出不同的响应特点,相比于CK,施氮均降低了植物各组织NSC 含量,其中猴樟幼苗叶、茎、粗根、细根NSC 含量在N2 水平下差异最明显,表明高氮条件不利于植物NSC的积累。
4 结 论
稀土尾砂中氮输入对猴樟幼苗的生物量积累、根系生长与非结构性碳水化合物含量具有重要影响。氮添加显著增加了猴樟幼苗的生物量积累(P<0.05),其中N1 处理下猴樟幼苗通过增加根长和根表面积来加强根系构建,使植株对养分的获取能力增强,叶、茎、根和冠层生物量积累增加;N2 处理下猴樟幼苗主要通过增加细根的比根长与比表面积提升植物对养分的吸收能力。综合考虑植物生物量的积累和肥料的经济投入,稀土尾砂中添加N1 水平(即1.8 g·株-1)氮素可以满足猴樟幼苗生长所需。

