榄李开花生物学和繁育系统
蔡艳清 陈玉军 李 玫 邓创发 黄烈健*
(1.中国林业科学研究院热带林业研究所,广州 510520; 2.南京林业大学,南京 210037)
红树林生态系统是热带和亚热带海岸的主要湿地类型之一,在河口生态系统中扮演重要角色[1]。红树林生存于高盐度、极端潮汐、强风、高温以及泥泞的厌氧土中[2],其可以从海洋和大陆获取养分,是丰富的碳源[3],也是许多大陆和海洋生物的栖息地[4]。20 世纪50 年代以来,我国的红树林遭受了严重的人为破坏,面积不断减少[5]。我国37种原生红树植物和半红树植物近一半的种类处于不同程度的珍稀濒危状态[5],导致红树植物生物多样性不断下降。保护红树植物生物多样性工作迫在眉睫。
榄李(Lumnitzera racemosa)是使君子科(Combretaceae)榄李属(Lumnitzera)真红树植物,常绿灌木或小乔木,一般生长于高潮或大潮可淹及的泥沙滩[6]。据《中国植物志》[7]记载,榄李分布于东非热带、马达加斯加、亚洲热带、大洋洲北部和波利尼西亚至马来西亚;榄李在我国主要天然分布于海南、广东、广西、香港及台湾等地区,最北引种至福建。榄李天然林下更新速度慢[8],目前的保存数量正在减少,《广东省红树林保护修复专项行动计划实施方案》[9]将其列为广东省濒危植物,并提出加强榄李等珍稀濒危物种的抢救性保护修复。以往关于榄李的研究主要集中在生态学[10]、叶片结构[11]、化学计量特征[12]、木材解剖[13]、遗传多样性[8]、药用价值[14]和化学价值[15-16]等方面,而关于其开花生物学和繁育系统方面的报道则缺乏系统的梳理。因此,开展榄李的开花生物学以及繁育系统方面相关研究,对揭示其濒危机制以及开展相关保护行动,具有重要意义。
1 材料与方法
1.1 试验地自然地理概况
研究地点为广东省珠海淇澳担杆岛省级自然保护区(22°25′38.72″N,113°37′44.3″E),位于高潮带,大中潮时期可淹。该区域为南亚热带海洋性气候,年平均气温为22.4 ℃,年降水量为1 964.4 mm,选择红树林保护区内10 年生的11 株榄李(引种地为海南)作为研究对象,株距大约1.5 m×2.0 m,周围生长的红树植物主要有老鼠簕(Acanthus ilicifolius)、桐花树(Aegiceras corniculatum)、卤蕨(Acrostichum aureum)、秋茄树(Kandelia obovata)、银叶树(Heritiera littoralis)等,研究时间为2022年5~9月。
1.2 开花动态及花部特征观察
参照Dafni[17]方法,从群体、花序、单花水平进行开花动态观察以及对花部综合特征进行观测。花序及花部综合特征观测主要包括:花序长度、每花序上小花数目、花总长、花丝长度、每花雄蕊数目、花柱长度、子房长度、每子房胚珠数目、花冠直径、花瓣长、花瓣宽、每花花瓣数目,使用精度为0.01 mm 的电子数显游标卡尺进行花序长度及花部器官的测量。
1.3 花粉活力测定
1.3.1 花粉离体培养
为筛选最佳花粉萌发条件,于榄李盛花期,选取当天上午开放的花朵,采用液体培养基法[18],设置不同浓度硼酸、蔗糖组合(0.10、0.20、0.30 g·L-1硼酸,5.00、10.00 、30.00 、50.00、100.00 g·L-1蔗糖),以检测硼酸、蔗糖梯度处理下对榄李花粉萌发的影响。以上花粉萌发试验均在温度27~28 ℃、空气湿度70%~80%环境条件下进行,每处理重复3 次试验,每重复随机选取3 个视野,每视野观察花粉数量不少于30 粒,每重复试验总花粉数量不少于100粒,培养12 h后,光学显微镜(40倍物镜)下观察花粉萌发情况。花粉管长度大于1倍花粉粒直径,视为花粉萌发标准,统计花粉萌发率并以此评估花粉活力:
花粉萌发率=(平均每视野萌发花粉数量/平均每视野花粉数量)×100% (1)
1.3.2 花粉活力检测
采用最佳花粉离体萌发处理,分别收集第1~3 天的花粉,进行花粉活力测定,各重复3 次试验。
1.4 柱头可授性测定
选取开花前2 天、前1 天,以及开花当天、第2天、第3 天、第4 天、第5 天(分别以A2d、A1d、B1d、B2d、B3d、B4d、B5d表示)的花朵各30朵,采用Dafni 等[17]方法,用尖头镊子将花柱取下,放置在凹面载玻片上,滴入适量3%过氧化氢溶液,静置30 s后于光学显微镜(10 倍物镜)下观察,若柱头周围有气泡产生,则证明柱头具有活性,气泡越多柱头可授性越强,反之不产生气泡,柱头无活性,记录具有可授性柱头数目并拍照记录。
1.5 繁育系统
1.5.1 单花花粉量及花粉-胚珠比
在天气晴朗的上午,09:00~10:00选取花药尚未爆裂的榄李花朵20朵,放入45 mL 离心管带回,将每朵花全部花药在未开裂时用尖头镊子剥下,装入1.5 mL 离心管中,室内放置待花药完全开裂后,滴入1.5 mL 蒸馏水,盖好盖子摇晃3~4 min,得到花粉悬浮液,使用移液枪吸取1.5 μL 滴于载玻片上,光学显微镜(10 倍物镜)下观察统计花粉数量,重复10 次,算出花粉平均数量,花粉平均数量乘以1 000,即得到每朵花的花粉量,同时用手术刀沿着小苞片位置纵切,记录每朵花的胚珠数量。用该花朵的单花花粉量除以对应单花胚珠数量计算得出花粉-胚珠比(P/O)。根据Cruden[19]标准评判繁育系统类型。
1.5.2 杂交指数(OCI)
采用花部数量特征观测数据以及单花盛花期开花特征观察结果,计算杂交指数(OCI)。根据Dafni[17]的标准判断榄李的繁育系统类型。具体评判标准为:(1)花朵直径(d)为1 mm 记为0,1 mm
1.5.3 授粉试验
随机选取3株榄李,进行授粉试验。①自然授粉(对照组):不做任何授粉处理,不套袋。②人工自花授粉:将同一花序上的其他花苞掐掉,在开花前1 天,只留1 朵花苞进行套袋处理,待花开时用自花的花粉授粉,套袋。③人工同株异花授粉:开花前1 天去瓣,去雄,套袋处理,待2 d 后授于同株花异花的花粉,套袋。④人工异株异花授粉:开花前1 天去瓣,去雄,套袋处理,待2 d 后授于异株花的花粉,套袋。⑤无融合生殖:在花开放前对花去瓣后去雄,套袋。每处理套袋40 朵花,重复3 次试验,授粉15 d 后将硫酸纸袋摘下,待果实成熟后摘取,带回,统计结实率(结实率=结果数量/试验花朵数量×100%)、败育率(败育率=空胚或胚败育的果实数量/试验花朵数量×100%)。
1.6 数据分析
用Excel 2019软件进行数据处理和图表制作,用SPSS 25.0 进行数据处理和方差分析,以邓肯(Duncan)法进行多重比较评价不同蔗糖、硼酸梯度组合处理下对花粉萌发、不同授粉方式对结实率和败育率差异的显著性,结果以平均值±标准差表示。
2 结果与分析
2.1 开花生物学特征
2.1.1 群体、花序开花动态
2022 年4 月25 日开始有花芽产生,从叶腋内爆出,2022 年4 月25 日至5 月16 日处于低温状态。5 月16 日有2 株榄李开花,5 月17 日开始气温逐渐升高,共有3 株榄李开花,大于25%植株开花,群体进入始花期。5 月18 日温度升高,位于向阳地带的榄李花朵大量开放,共有6 株榄李开花,大于50%植株开花,进入群体盛花期,位于庇荫环境下的榄李尚未进入花期,时间间隔6~7 d开始开花。5 月31 日最后一株榄李开花,群体全部进入花期。8 月14 日,少于10%植株开花,群体进入终花期,个别榄李植株处于零星开花阶段,主要表现为新花苞继续在花序上爆出,或自叶腋内爆出,开花量较少,8 月31 日所有榄李植株开花结束。综上所述,榄李群体开花时长约为106 d。
榄李花序为腋生总状花序,偶有花序轴着生花序,或花苞直接从叶腋爆出,花序轴上单花互生排列,成熟花序轴上小花2~12 朵不等,花序上开花顺序为自基部由下而上开放,持续时间5~18 d不等,平均天数为(10.80±3.58) d,果实成熟后花序轴变红褐色留存于枝条。
2.1.2 单花开花动态
榄李的单花期为7~13 d,平均(9.1±1.3) d,榄李的单花花期的开放可分为4个时期,分别经历萌动期、初展期、盛开期、掉落期。①萌动期(图1:A~B):花萼紧包花蕾,后花蕾逐渐膨大,花瓣伸长,露白。②初展期(图1:C~D):花瓣分离逐渐张开,花药白色尚未开裂,花丝卷曲尚未伸展,花药位于柱头下方,且距离花柱较近,柱头有少量黏液分泌;从萌动期到初展期需3~7 d,平均(4.1±1.1) d。③盛开期(图1:E~F):盛开期需要2 d 左右。开花当天花瓣完全张开,花丝伸展,花药呈五五两轮排列,一般于06:00~09:00 点开放,此阶段花药白色尚未开裂,柱头花药之间总体几乎平齐,随着温度升高,花上露水蒸发,花药迅速开裂。在天气晴朗无雨水时,4~5 h 内花药从内轮到外轮依次开裂,此时花粉爆出,呈淡黄色,开始散粉,到傍晚时花药从淡黄色变为黄色,此时柱头高度与外轮花药几乎平齐,内轮花药低于柱头。初展期到花盛开大概需要0.5 或1.0 d,温度较低时需要经历1 d 时间,温度高时当天即可进入盛花状态。开花第2天,花药变为淡褐色,肉眼可见花药携带花粉量减少,带有少许花粉,花粉呈现黄褐色或黄色,此时柱头与花药位置总体仍保持平齐且柱头有黏液分泌。④掉落期(图1:G~I):从花丝脱落到花瓣脱落大约需要2~3 d,一般于开花第3 天,花丝开始松动,此时柱头高度高于花药,柱头有粘液分泌,花药从淡褐色变为褐色。开花第4~5 天,花瓣开始脱落,花丝脱落完成,花瓣开始脱落到全部脱落约1~2 d,柱头宿存,不再有黏液分泌,单花花期结束。⑤果实成熟期(图1J):从花朵掉落期算起,果实成熟时间平均需(31.7±2.4) d。子房膨大后,果实颜色变为黄色,视为果实成熟。

图1 榄李单花开花动态A~B.萌动期;C~D.初展期;E~F.盛开期;G~I.掉落期;J.果实。Fig.1 Flowering dynamics of single flower of Lumnitzera racemosa A-B.Budding period;C-D.Initial period;E-F.Full blooming period;G-I.Drop period;J.Fruit.
2.1.3 花序及花部特征
由表1 可知,花序长度为34.18~70.34 mm,平均长度(53.18±9.42) mm。每花序单花平均(6.40±2.02)枚。花总长(15.37±0.94) mm。花萼绿色杯状合生,基部窄上部宽,上端常有5个三角形萼齿,被绒毛,偶有11 萼齿,具小苞片2 枚,鳞片状三角形,宿存。花冠直径为(13.82±1.33) mm,花瓣白色与 萼 齿 互 生,花 瓣 长 为(6.66±0.63) mm,宽 为(2.64±0.24) mm。每花平均花瓣数目为(5.03±0.30),常见4 瓣、5 瓣、6 瓣,偶有8 瓣;雄蕊8~17个,常见10个。雄蕊呈内外两轮均匀排列,内轮雄蕊高度矮于外侧雄蕊高度,花丝长(5.74±0.44)mm,花柱长(7.50±0.69) mm,插生于萼筒中央,弯曲或者波浪状,个数1,偶有2 个花柱现象。子房下位,常见1室,偶有2室,子房长(5.92±0.58) mm,内含胚珠3~5枚,平均(4.00±0.68)枚,常见4枚,倒挂悬生子房内,长椭圆球状淡黄色,珠柄合生不等长,白色海绵絮状。榄李果实为核果,胚珠多数,最终只有1 枚胚珠发育为种子,存在少数多胚现象。

表1 榄李花部器官数量特征Table 1 Statistics of floral organs of Lumnitzera racemosa
2.2 柱头可授性及花粉活力
2.2.1 柱头可授性
由图2 所示,柱头在开花2 d 前可授性为0。开放前1 天(初展期:图1C)可授性为20.00%。开放当天上午(盛开期:图1E)柱头可授性为30.00%。开花当天下午柱头可授性为55.67%,柱头可授性明显升高,第3 天柱头可授性达到100.00%,后可授性急速下降,在第5 天之后基本不具可授性。
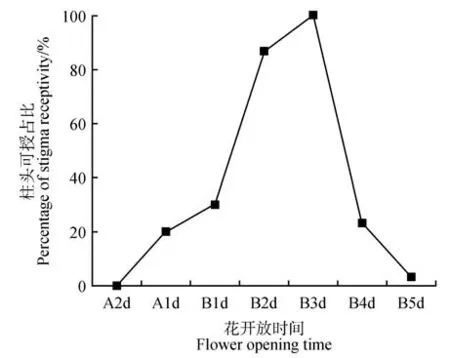
图2 开放至不同天数柱头可授情况Fig.2 Stigma receptivity under flower opening different days
开花前2 天柱头不产生气泡(图3A),不具备可授性,肉眼可见花柱为浅绿色。开花当天上午部分柱头具有可授性,产生气泡数量很少且速度慢(图3B),可授性较弱。第2 天柱头可授性增强,产生气泡增多(图3C)。第3 天可授性达到最强,产生气泡数量多且快速(图3D),此时柱头颜色变为淡褐色,花柱颜色为白色。第4天部分柱头具有可授性,有气泡产生,但大部分柱头变干且颜色为褐色到深褐色不等(图3E),基本不具可授性。
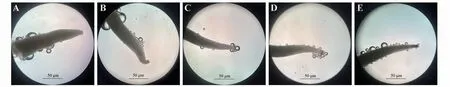
图3 柱头可授性变化A.开花前2天;B.开花当天;C.开花第2天;D.开花第3天;E.开花第4天。Fig.3 Changes of stigma receptivity under flower opening different days A.2 days before flowering;B.The day of flowering;C.The second day of flowering;D.The third day of flowering;E.The Fourth day of flowering.
2.2.2 花粉离体萌发
如图4所示,不同蔗糖、硼酸质量浓度多重比较结果表明,在同一蔗糖质量浓度下,50.00 g·L-1蔗糖+0.20 g·L-1硼酸处理下花粉活力最高(图5),为58.73%,显著高于50.00 g·L-1蔗糖+0.3 g·L-1硼酸处理,与5.00 g·L-1、50.00 g·L-1蔗糖+0.2 g·L-1硼酸处理结果不显著。5.00 g·L-1、3.00 g·L-1蔗糖处理下,花粉活力随硼酸质量浓度升高而降低,其余为随硼酸质量浓度升高呈现花粉活力先升高后降低趋势。在同一硼酸质量浓度下,0.20 g·L-1硼酸+5.00 g·L-1蔗糖处理为最佳处理,显著高于0.20 g·L-1硼酸下,5.00 g·L-1蔗糖,3.00 g·L-1蔗糖,100.00 g·L-1蔗糖处理,其中与10.00 g·L-1蔗糖处理不显著,是因为10.00 g·L-1蔗糖下处理试验中有花粉活力相对较高的重复结果,标准差偏大。0.1 g·L-1硼酸+100.00 g·L-1蔗糖处理下花粉不萌发,说明相对高的蔗糖质量浓度并不利于榄李花粉萌发。
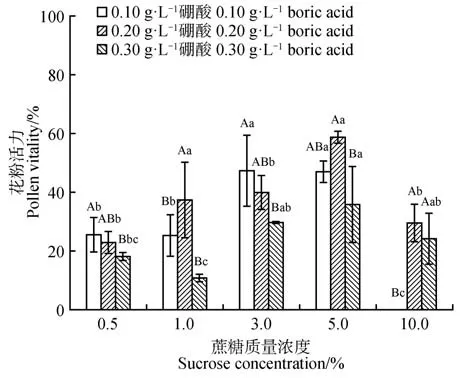
图4 不同质量浓度蔗糖、硼酸组合处理对花粉萌发的影响不同大写字母代表同一蔗糖质量浓度下,不同硼酸质量浓度下的花粉活力之间差异显著(P<0.05);小写字母代表同一硼酸质量浓度下,不同蔗糖质量浓度下的花粉活力之间差异显著(P<0.05)。Fig.4 Effect of different combinations of sucrose and boricacid concentrations on pollen germination The graphs containing different capital letters represented significant difference(sP<0.05) between pollen viability at the same sucrose concentration and different boric acid concentrations;Lowercase letters represented significant difference(sP<0.05) between pollen viability at the same boric acid concentration and different sucrose concentrations.

图5 最佳处理下花粉萌发状态(40倍物镜)Fig.5 Pollen germination status under optimal medium(40× objective)
2.2.3 花粉活力测定结果
由图6 可知,榄李在开花当天花粉活力最高,为58.73%,第2 天花粉活力显著下降,为20.37%。第3天花粉不再具有活力,花丝开始松动脱落。
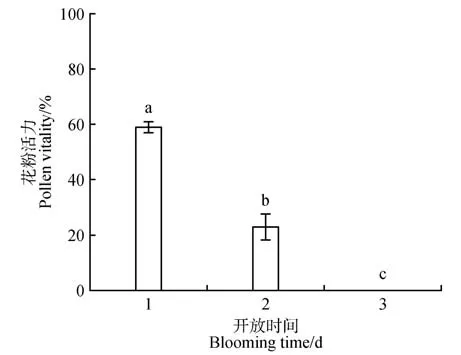
图6 不同开放时间的花粉活力不同小写字母代表不同开放时间的花粉活力之间差异显著(P<0.05)。Fig.6 Pollen viability at different days The graphs containing different lowercase letters represent significant differences between pollen viability of different days.
2.3 繁育系统评判结果
2.3.1 单花花粉量及花粉-胚珠比
经统计,榄李单花平均花粉量为(19 856.8±3 190.6)粒,胚珠数目(3.6±0.6)粒,P/O为5 740.50±1 318.20。根据Cruden[19]标准,榄李的繁育系统为专性异交。
2.3.2 杂交指数(OCI)
榄李盛开时期花朵直径为(13.82±1.33) mm(n=132),大于6 mm,OCI值记为3;花药开裂后,柱头具有较弱可授性,雌蕊尚未完全成熟,此时花粉已具有最高活力,由此推断,榄李花朵为雄蕊先熟,OCI 值记为1;柱头与花药高度平齐,OCI 值计为0;榄李杂交指数(OCI)为4,参照Dafni[17]标准,榄李繁育系统为部分自交亲和,异交,需要传粉者。
2.3.3 授粉试验结果
榄李果实成熟后,每个果实只有1 粒种子产生,为单种子果实。由表2 可知,无融合生殖试验结实率较高,为95.00%,败育率为100%,无种子产生,所以榄李在结实过程中基本不存在无融合生殖现象。自然授粉(对照组)、人工自花授粉、同株异花、异株异花授粉结实率分别为91.67%、78.33%、72.50%、76.67%,败育率分别为35.00%、85.83%、46.67%、64.17%,各处理下均有种子产生,说明榄李自交和异交均是亲和的。榄李果实自然对照下处理败育率显著低于人工自花授粉、人工异株异花授粉,低于人工同株异花败育率(46.67%),但差异不显著,说明可能在自然状态下榄李花朵传粉同株异花传粉机会更多,其次为异株异花传粉。授粉试验结果表明,榄李人工自花授粉和同株异花授粉败育率的平均值接近于异株异花授粉,则表明榄李繁育系统为自交和异交同时存在的混合交配系统。
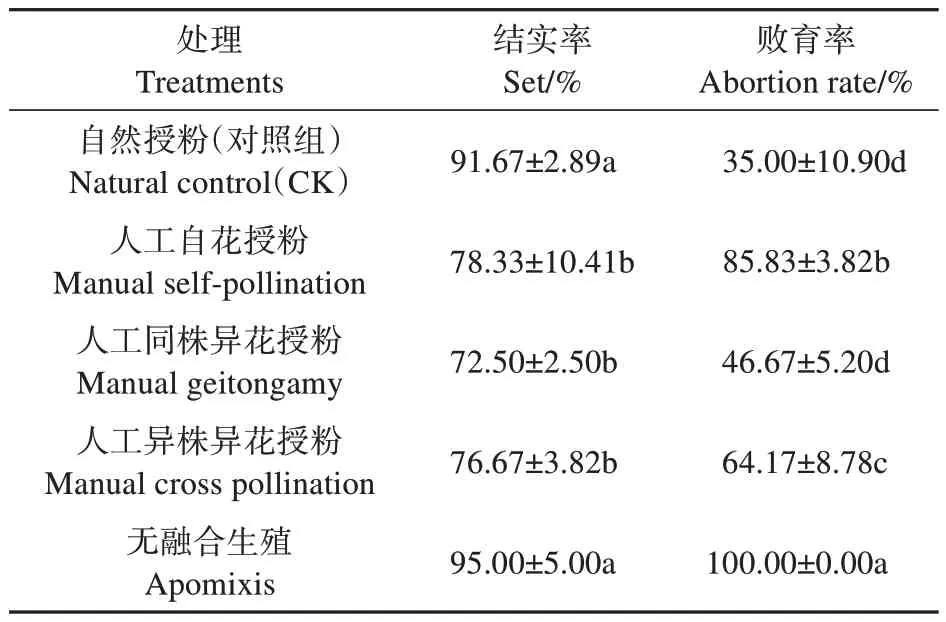
表2 授粉试验结果Table 2 Pollination test results
通过杂交指数(OCI)、花药-胚珠比(P/O)、以及授粉试验测定结果,综合判定榄李繁育系统为异交为主,部分自交亲和,需要传粉者。
3 讨论
榄李存在林下更新慢、更新困难等现象,并因此造成其逐渐濒危的现状。开展榄李开花生物学及繁育系统研究,为今后揭示其濒危机制以及开展相关保护行动,具有重要意义。
位于不同地理位置榄李开花时间以及开花时长不同。位于澳大利亚昆士兰州的榄李开花时间为10 月到次年3 月[20],为期约6 个月;位于印度安得拉邦的榄李开花时间为7 月中旬至8 月中旬[21],为期约1 个月;本研究中,位于珠海淇澳所引种的榄李花期为5 月中旬至8 月末,约3 个月。 3 个地区榄李开花时间以及时长均不同,位于印度安得拉邦的榄李群体开花时间,开花时间较短,而位于澳大利亚昆士兰州、广东珠海淇澳开花时间相对较长,同一树种在不同的地区,往往表现出不同开花物候来适应环境,从而保障繁殖成功。
本研究中,异花授粉的败育率显著低于自花授粉的败育率,且异株异花授粉的种子更加饱满,榄李更适合异花授粉。根据柱头可授性与花粉活力检测结果,花朵开放第1 天花粉活力最强,为58.73%,开放至第3 天柱头可授性最强,达到100.00%,为提高榄李授粉成功率,可以采集开花当天的花粉授粉到开花第3天的花朵上,从而提高榄李结实率以及种子质量和产量。
参照Cruden[19]标准,根据花粉-胚珠比(P/O),榄李的繁育系统为专性异交,但根据Dafni[17]标准,杂交指数(OCI)为4 时其繁育系统为异交为主,部分自交亲和,需要传粉者。授粉试验也表明榄李繁育系统为自交和异交兼有的混合交配系统,所以根据P/O得出其繁育系统为专性异交的结果并不准确,这在植物长柱紫茎[22](Stewartia rostrata)、夏腊梅[23](Sinocalycanthus chinensis)的研究中也得到类似矛盾的结果。P/O 是雄性资源分配量的一个指标[24],本研究中P/O为5 740.50±1 318.20,花粉量较大,利于传粉者将更多的花粉携带到其他花朵上,增加其远交的机会,可以证实其繁育系统体现更多的是异交。所以综合来看,榄李繁育系统为异交为主,部分自交亲和,需要传粉者。另外,人工授粉试验表明榄李繁育系统为自交和异交同时存在的混合交配系统,自交及异交败育率接近,而不是体现为异交败育率低,导致这种结果的可能原因是榄李群体花期为5 月中旬,正值雨季,可能导致授粉效果有偏差。
无论从花部结构来看,还是从花寿命角度来看,榄李繁育系统更趋向于异交,不利于自交。榄李花药呈现内外2圈(每圈各4或5个花药)的排列方式,内圈花药低于外圈花药,所在位置高度低于柱头,外圈花药与柱头位置高度平齐,但距离柱头位置相对较远并不利于自花授粉,但有利于传粉者将花粉携带到其他花朵之上,则更有利于异花授粉。Tomlinson 等[20]研究认为,榄李为明显的雄蕊先熟,单个花朵并不能自花授粉。Raju 等[21]研究结果表明,榄李人工自花授粉结实率为35.00%,非人工自花授粉结实率为21.00%,榄李具备自花授粉能力。本研究中,人工自花授粉结实率为78.33%,败育率为85.83%,存在自花授粉现象,也得到榄李具有自花授粉能力的结果,这与Tomlinson 等[20]认为榄李不具备自花授粉结论相反,与Raju 等[21]所得结果相一致。经柱头可授性检测,柱头在开花后的第1 天至第3 天均有可授性,但第1、2 天的柱头可授性小于第3 天,这明显不利于自花授粉,更趋于异花授粉,人工授粉试验也表明榄李异花授粉成功率高于自花授粉成功率。
榄李的传粉机制更倾向于异交。根据相关研究结果,大多数植物的繁育系统表现为自交与异交同时存在的混合交配模式[25-28],这种交配模式可使得植物在面临差的环境条件保证繁殖成功,榄李的异交繁育系统,也正是符合该模式的一种体现。

