藻-菌颗粒污泥处理低C/N生活污水的研究
张夏,陈红兵,胡惠秩,汪锐,陈乐言,万仁辉,徐芳
(湖北大学资源环境学院, 湖北 武汉 430062)
0 引言
微藻-细菌颗粒污泥(microalgal-bacterial granular sludge, MBGS)工艺作为一种新兴污水处理技术具有能耗低、温室气体排放量少等优点,满足低碳节能的要求,在污水处理中受到越来越多的关注[1]。在MBGS工艺中微藻-细菌间的共生关系使微藻光合作用产生的O2供给细菌氧化有机物并转化为富能物质,同时细菌产生的CO2作为微藻光合作用的原料[2]。在此过程中实现CO2的循环利用,可减少污水处理过程中温室气体的排放量。
近年来生活污水中有机物浓度偏低,氮、磷含量较高,生化需氧量/总氮(COD/TN,C/N)呈现降低趋势。通常认为低C/N类污水很难满足传统活性污泥法对碳源的需求,影响脱氮效果[3]。在微藻体系中,碳是微藻生长的重要营养物质,氮是微藻合成蛋白质的主要元素,调控微藻生长代谢[4],C/N过低会抑制微藻的生长,不利于微藻发挥作用[5]。因此,MBGS工艺对低C/N污水的处理及其长期运行的效果值得深入探究。本研究旨在探索MBGS工艺对低C/N污水的处理效果,并通过分析元素组成及胞外聚合物的变化,揭示C/N对藻菌结构和比例的影响,以期为MBGS工艺的工程应用提供理论基础。
1 实验材料与方法
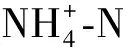

胞外聚合物(extracellular polymeric substances,EPS)分为松散结合型EPS (loosely-bond EPS,LB-EPS)和紧密结合型EPS (tightly-bond EPS,TB-EPS),提取方法参照张冰的研究[7]。蛋白质的测定采用SK3501 BCA 改良型试剂盒(上海生工,中国)。多糖的测定为苯酚-浓硫酸法,方法参照DUBOIS等[8]的研究。
乙酰辅酶A、谷氨酸脱氢酶(glutamate dehydrogenase,GDH)和ATP酶的测定分别采用北京盒子生工生产的乙酰辅酶A含量检测试剂盒、谷氨酸脱氢酶活性检测试剂盒和ATP酶活性检测试剂盒,在检测酶活前均需先称取样品加入相应药剂,冰浴匀浆,4 ℃ 8 000 g 离心 10 min,取上清为粗酶液置于冰上待测。
P元素的含量分析采用电感耦合等离子体发射光谱法(inductively coupled plasma optical emission spectrometry, ICP-OES, PerkinElmer 8300),将样品烘干,磨成粉末状,酸溶后待测[9]。C、H、N、S、O元素的含量分析采用有机元素分析仪(element analyzer, EA, Elementar Vario EL),将样品烘干,磨成粉末状,分别选择CHNS模式和O模式检测[10]。
1.3 数据处理根据下式计算MBGS中细菌的比例,继而得到微藻比例[11]。
(1)
式中:Pb为细菌比例(%);C/Nm为微藻的C/N;C/NMBGS为MBGS的C/N;C/Nb为细菌的C/N。其中细菌的经验公式为C5H7O2N[12],微藻的经验公式为C5H8.9O1.8N0.6[13]。
SPSS Statistics软件用于分析数据的差异性与相关性,并用软件Origin 2021作图。
2 结果与讨论
2.1 MBGS的组成及物理特性经过一段时间的培养后,R1、R2反应器内颗粒形态发生明显改变。由图1可见,R1中颗粒结构紧密,表面光滑呈现绿色,R2中颗粒结构松散,表面粗糙呈现绒毛状,颜色较黑,部分颗粒呈现不规则形状,这是因为在碳源匮乏的条件下,丝状微藻具有更高的比表面积使其能够更好地生长,并在颗粒表面交织成致密的网络,捕获其他微藻和细菌[14]。
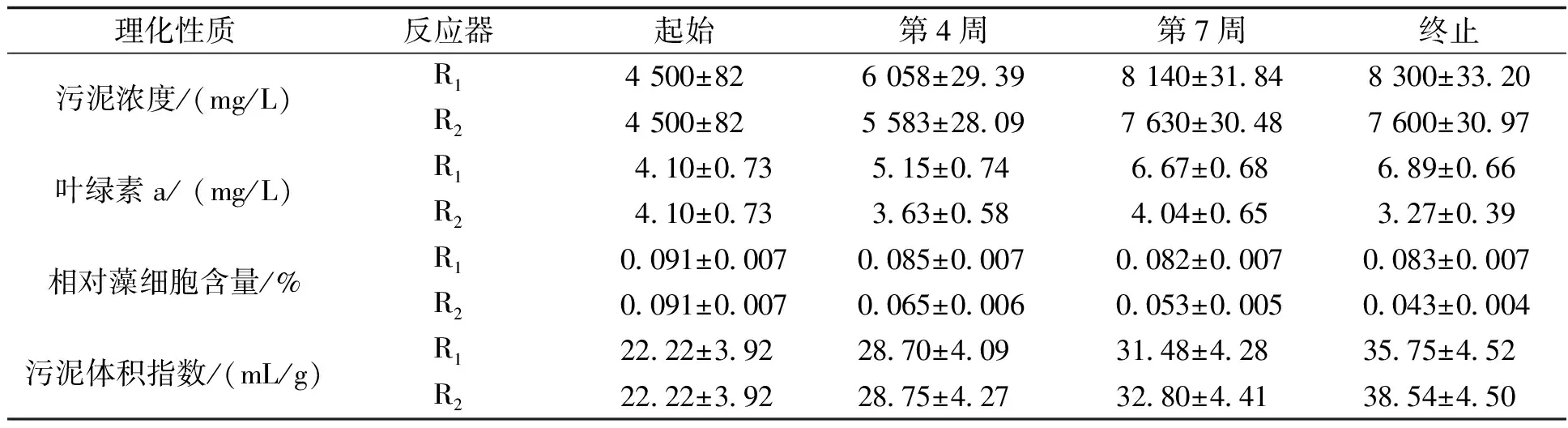
表1 起始和结束阶段颗粒的理化性质

图1 显微镜下颗粒形态
MLSS和SVI分别表示颗粒的浓度和沉降性。在0~4周实验初期对反应器内颗粒进行筛选,去除悬浮态藻类,导致反应器内污泥浓度增长较慢并呈现波动状,第4周时R1、R2分别达到(6 058±29.39) mg/L和(5 583±28.09) mg/L。5~7周MLSS快速增长,分别达到(8 140±31.84) mg/L和(7 630±30.48) mg/L。第8周后保持稳定,最终维持在(8 300±33.20) mg/L和(7 600±30.97) mg/L左右。R2体系内MLSS始终低于R1,说明低C/N对MBGS的生长产生影响。SV5/SV30在实验期间一直在1左右,说明低C/N对MBGS的沉降性无明显影响。叶绿素a/MLSS 来表征藻细胞的相对含量[7],实验期间R1无显著变化,结束时约为(0.083±0.007)%,而R2则呈现下降趋势,最终降到约(0.043±0.004 4)%,说明低C/N会限制微藻的生长。
为了进一步分析低C/N条件下MBGS的组成变化,对R1和R2中MBGS的元素组成进行测定。本次实验装置与空气流通,根据之前的研究,空气的进入量与藻类气体的释放量相比很小,故忽略不计[1,15]。按质量计,MBGSR1含有37.04%的C、18.77%的O、6.34%的N、5.49%的H、1.55%的P,MBGSR2含有43.98%的C、22.27%的O、8.21%的N、6.37%的H、1.93%的P。据此,MBGSR1和MBGSR2的经验公式可以估算为C5H8.9O1.9N0.7P0.081和C5H8.7O1.9N0.8P0.085。R1、R2中MBGS的元素组成均介于微藻(C5H8.9O1.8N0.6)和细菌(C5H7O2N)的元素组成之间[12]。根据式(1)计算得MBGSR1中细菌与微藻的占比约为49∶51,MBGSR2中细菌与微藻的占比约为17∶3,与相对藻细胞含量的计算结果一致,说明低C/N会对藻类生长产生抑制作用。
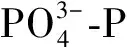
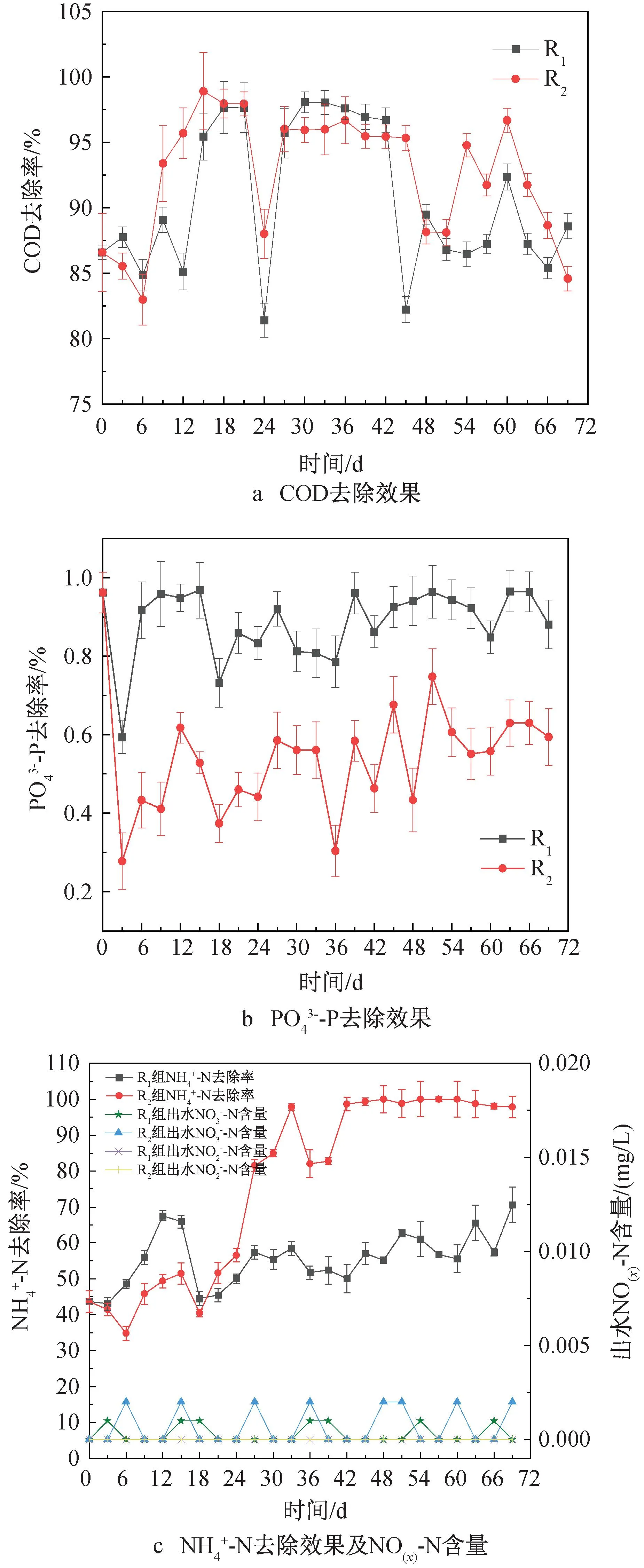
图2 污染物去除效果
为了进一步探究低C/N比对MBGS去除污染物的影响,在运行稳定阶段对一个光/暗周期内污染物的变化情况进行监测。DO是衡量细菌与微藻协同关系的重要指标。图3(a)显示了一个典型光/暗周期内DO与出水COD浓度的变化趋势。光周期内可以分为两个阶段,第一阶段(0~4 h),R1、R2中DO含量几乎为零,此时COD去除率分别为(77.94±0.29)%、(78.23±1.70) %,说明在此阶段中细菌代谢与微藻光合作用紧密耦合,微藻产生的O2完全被细菌利用,无DO积累,并且好氧细菌利用O2去除COD,使COD含量迅速下降。第二阶段(4~12 h),没有充足的有机物继续供给好氧细菌,好氧细菌对O2的需求量减少,DO开始积累。而在暗周期内,由于0 h时进水时交换了1/2体积的污水,导致DO极速降低,并一直保持较低水平。此时,COD在前6 h得到较好的去除,R1、R2暗周期COD去除率分别为95.06%和91.96%。
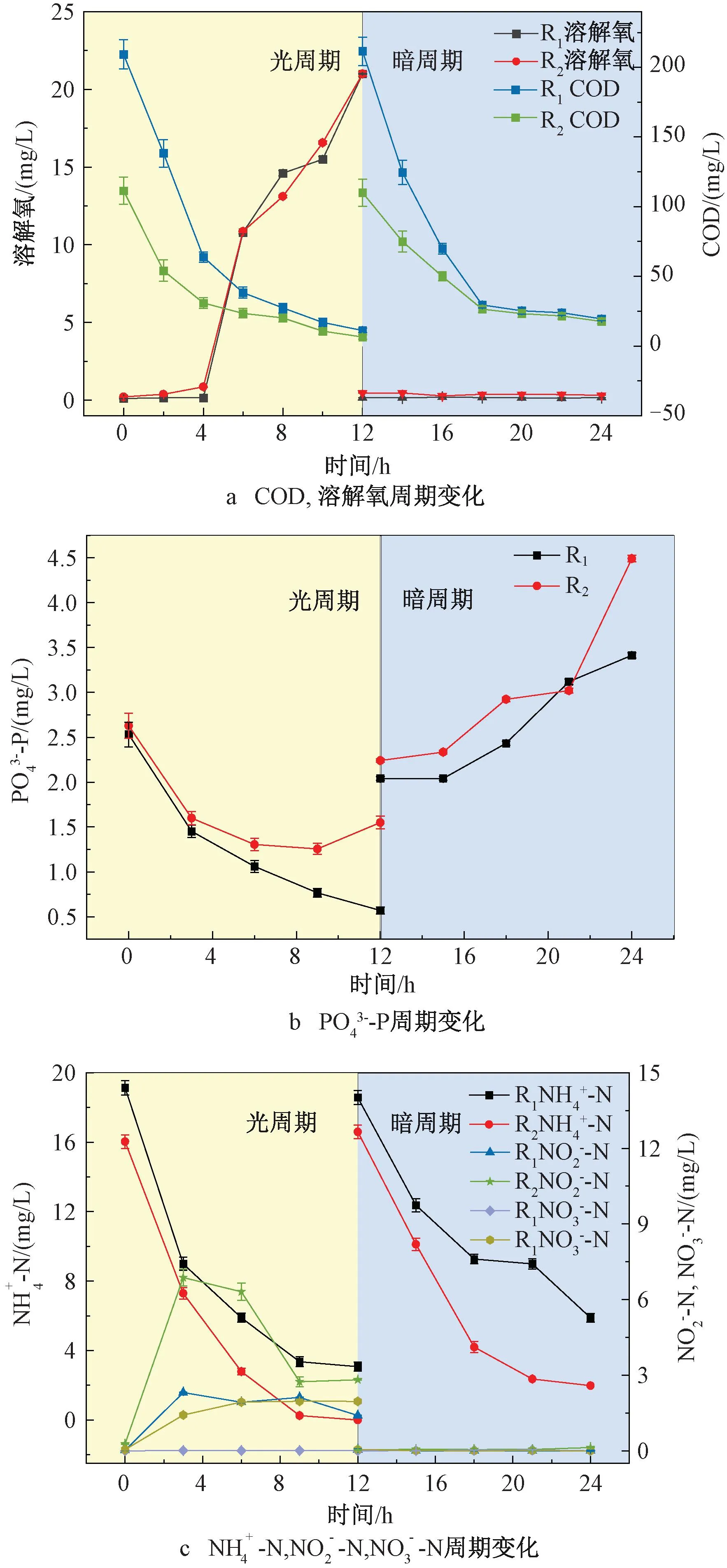
图3 典型周期内污染物浓度变化
为了探究MBGS中通过同化作用去除COD、N、P的情况,应用公式(2)、(3)进行推导。假定R1中去除的COD全部由式 (2) 描述的同化作用去除,则可相应去除(22.54±1.76) mg/L的N和(5.89±0.34) mg/L的P,占N和P去除量的(98.86±7.72)%和100%。假定R2中去除的COD全部由式 (3) 描述的同化作用去除,则可相对应去除(14.56±0.72) mg/L的N和(3.41±0.005 4) mg/L的P,占N和P去除量的(38.45±1.90)%和100%。这表明,在正常C/N比条件下,藻菌的同化作用是MBGS去除COD、N、P的主要途径;在低C/N比条件下,P的去除主要依靠同化作用,而N的去除以硝化细菌脱氮过程为主,与前文N去除的分析结果一致。此外,若P全部通过藻菌间的同化作用去除,去除率可达100%,而实际检测的R1组P去除率为(88.65±8.98)%,R2组P去除率为(50.69±13.64)%,说明藻菌间的同化作用对P的去除效率优于细菌聚磷。由于R2组N的去除率显著高于R1组,由此可知硝化细菌的脱氮效率高于同化作用,与前人研究一致[17]。
(2)
(3)
为了进一步确定微藻和细菌在MBGS中对去除C、N、P的贡献,根据式(4)(5)进行计算。在R1中约44.39%的COD、35.09%的N、32.01%的P被细菌去除,46.21%的COD、21.91%的N、56.64%的P被微藻去除,剩余9.40%的COD、43.00%的N、11.35%的P随出水流出。在R2中约78.71%的COD、85.61%的N、38.99%的P被细菌去除,13.89%的COD、9.07%的N、11.70%的P被微藻去除,剩余7.40%的COD、5.32%的N、49.31%的P随出水流出。由上述结果可知,低C/N对微藻的生长影响较大,改变了MBGS中细菌和微藻的比例,导致P的去除效果差异较大,但提高了N的去除率。
(4)
(5)
低C/N对微藻的生长产生抑制用,影响MBGS中细菌和微藻的含量,使R2中MBGS藻菌比例与R1相比变化较大。COD主要由细菌去除,R2中细菌比例高于R1,所以,R2中COD的去除率大于R1;R1中微藻的比例高于R2,而微藻对P的去除效率高于细菌,所以R1中P的去除率大于R2;R2中富集了硝化细菌,硝化细菌的脱氮效率高于微藻的同化作用,所以,R2中N的去除率大于R1。
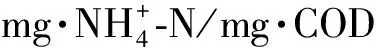

注:*表示与R1组相比变化显著(p < 0.05)
2.4 MBGS中EPS组分及含量分析EPS在维持MBGS稳定性方面发挥重要作用。如图5a所示,两组EPS含量呈现波动上升,从(41.28±1.38) mg/g·MLVSS分别增长至(94.79±1.25) mg/g·MLVSS(R1)和 (106.19±3.41) mg/g·MLVSS(R2)。R2组总EPS含量明显高于R1组,在运行结束时比R1组高出21.21%。这是因为细菌比例的增加会促进EPS的产生,R2组MBGS细菌比例高于R1组,因而分泌出更多的EPS[23]。蛋白质(protein,PN)、多糖(polysaccharide,PS )是EPS的主要组成部分。PN能作为保护剂维持颗粒的内部结构,提高颗粒的稳定性以适应水质的波动[24]。PS是污泥亲水性重要成分,可促进原核微藻的运动,利于细胞聚集和造粒[25]。PN/PS可以表征颗粒的稳定性和抵抗外界有毒物质的能力。由图5a 可知当实验结束时R2组PN/PS值(1.47±0.099)明显高于R1组(0.78±0.14),这说明低C/N进水对EPS的作用更多地体现在提高PN含量上,有利于增强颗粒的稳定性,从而帮助微生物适应不利环境。
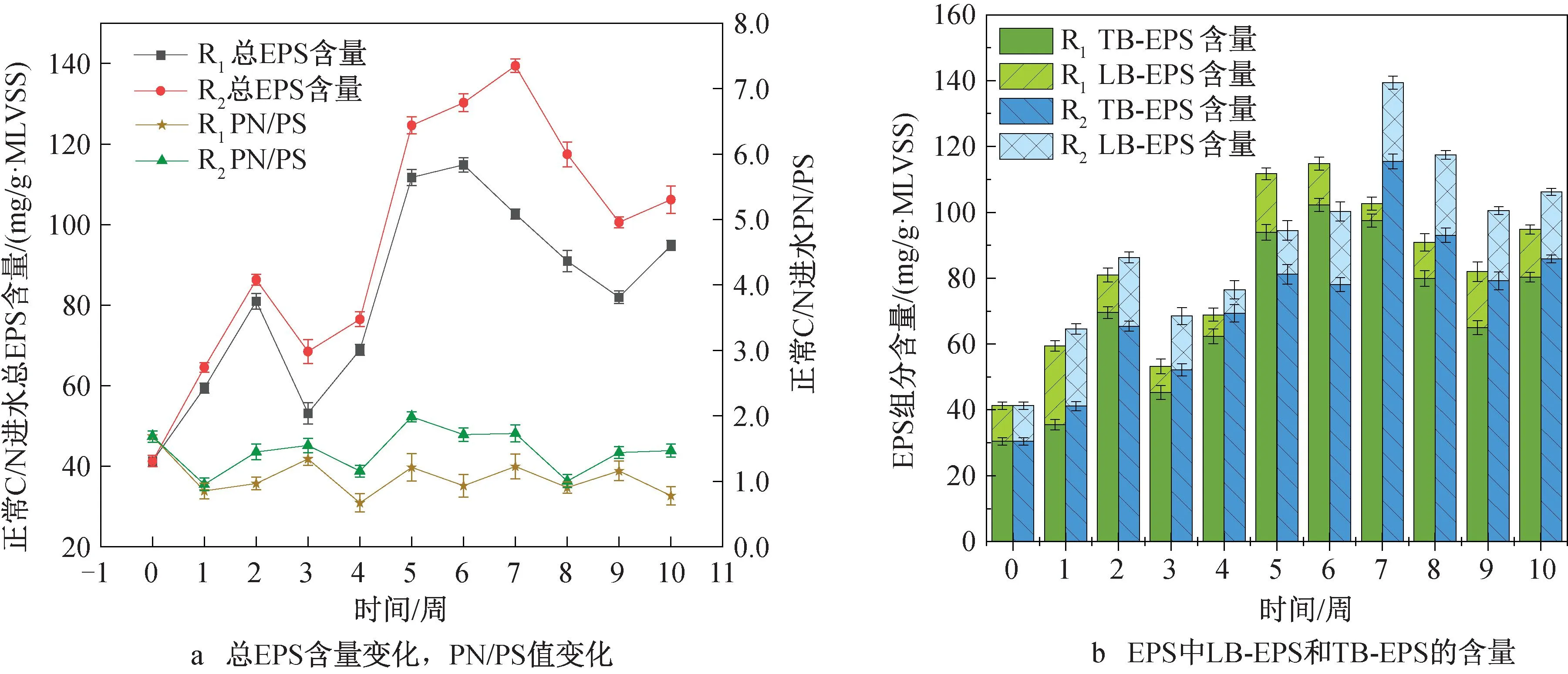
图5 EPS含量,PN/PS值变化及EPS组成及分类
根据EPS与细胞结合紧密程度的不同,可以将EPS主要分为两种:LB-EPS和TB-EPS。如图5b所示,TB-EPS是MBGS中EPS的主要成分,其含量变化趋势与总EPS的趋势相似。TB-EPS的存在有利于细胞相互粘附形成集合体[26],通常被认为是造粒过程中的主要贡献者。R1和R2的TB-EPS分别从(30.42±1.10) mg/g·MLVSS逐渐增加到(80.31±1.47) mg/g·MLVSS(R1)和(85.88±1.21) mg/g·MLVSS(R2),LB-EPS从(10.86±1.13) mg/g·MLVSS增加到(14.47±1.42) mg/g· MLVSS(R1)和(20.31±1.05) mg/g· MLVSS(R2)。实验结束时R2组TB-EPS比R1组高6.94%,LB-EPS比R1组高40.36%,说明低C/N进水主要影响LB-EPS的分泌。这可能是因为LB-EPS较易从颗粒表面脱离,在碳源不足时可充当碳源[27],使R2中藻菌分泌更多的LB-EPS。
3 结论

2)低C/N更易影响藻类生长,从而改变MBGS中菌藻比例。通过化学计量分析发现,在正常C/N中微生物同化作用是去除污染物的主要机制,低C/N中有机物和磷主要依靠微生物同化作用去除,氮主要依靠硝化作用去除。
3) TB-EPS是MBGS中主要的EPS,低C/N对EPS成分的影响主要体现在提高了PN含量,对EPS种类的影响主要体现在分泌更多的LB-EPS上。

