小叶栀子再生体系的建立研究
刘海涛,刘玲,吕沙妹
(1.淮南师范学院生物工程学院,安徽 淮南 232038;2.资源与环境生物技术安徽普通高校重点实验室,安徽 淮南 232038)
栀子属(Gardenia Ellis.)植物分布广泛,在热带、亚热带及温带地区均有栽培或野生植株,具有观赏[1]、药用[2-7]、制作饮料[8]、提炼油脂和香料等多种用途[9],具有较大的开发潜力.小叶栀子(Gardenia jasminoidesEllis.var.radicans)为茜草科栀子属植物中栀子(Gardenia jasminoidesEllis.)的一个栽培变种,为叶小浓密、花白具有浓郁香气的常绿灌木,是优良的园林绿化景观植物,应用前景广泛.前人多利用有性、营养繁殖方式产生小叶栀子幼苗,但总体上成活率较低,难以满足市场需求.
近年来,植物组织培养技术日趋成熟,已广泛应用于农业[10]、园林[11]、园艺[12]、林业[13]、工业[14]和植物化学物质生产[15]等诸多领域.迄今为止,对于栀子属植物再生体系的研究多见于利用茎段[16-17]、叶片[18]、果皮[19]、种子或种子团[20]等材料作为外植体进行组织培养以获得再生植株的研究,而利用无菌叶片和顶芽做为外植体进行木本植物组织培养的研究较少.小叶栀子具有较高的研究价值及应用前景,但目前国内外利用组织培养建立再生体系的研究多集中在栀子属其它物种,针对小叶栀子的离体快繁技术的研究鲜见.因此,本研究利用小叶栀子的无菌叶片和顶芽为外植体,通过不同质量浓度、种类的植物生长调节剂配比,以期建立小叶栀子的组织培养再生体系,为大规模扩繁小叶栀子幼苗提供理论参考与技术支持.
1 材料与方法
1.1 外植体的获取
于2022 年5 月中旬天气晴朗的上午10 时左右,在淮南师范学院小叶栀子培养基地的向阳面,采集生长健壮且无病虫害的当年生具顶芽的小叶栀子枝条(长3 cm 左右),放入收纳盒后带回实验室;用剪刀去除枝条上、顶芽外部的叶片,5%洗衣液浸泡30 min 后,用清水冲洗数遍,直至无泡沫,用纱布包裹去叶顶芽,流水缓慢冲洗1 h,将杂质和灰尘清洗干净,放置备用.
1.2 无菌无根苗的培养
于超净工作台(智诚ZHJH-C112B,购自北京创博环球生物科技有限公司)上,将前期处理好的顶芽置于无菌瓶中,75%的乙醇、0.1%的HgCl2溶液依次浸泡30 s、8 min,无菌水冲洗6 遍后用灭菌刀片切去木质化的茎段,保留0.5 cm 长的顶芽,分别置于50 mg/L 氨苄西林钠+50 mg/L 硫酸链霉素的1∶1 混合溶液(处理1)和200 mg/L 的头孢霉素溶液(处理2)(均购自北京索莱宝科技有限公司)中浸泡30 s 后接种于启动培养基上,启动培养基为不加植物生长调节剂的MS 培养基(pH5.8),设置空白对照组.每组处理接种30 瓶,每瓶接种2 个顶芽.在无菌室内,培养环境为25 ℃、16/8 h(光照/黑暗)、光照强度1 500 lx.接种30 d 后统计外植体污染率.
1.3 愈伤组织诱导和增殖
以MS 为基本培养基,添加不同质量浓度的2,4-D(1.0 mg/L、2.0 mg/L、3.0 mg/L)和6-BA(0.5 mg/L、1.0 mg/L、1.5 mg/L),两种植物生长调节剂正交,共9 个处理(Y1-Y9).在超净工作台上,将启动培养基上生长的顶芽展开的无菌叶片切成大小约5 mm×5 mm 的小块,将新长出的芽的底端切除一小部分,分别接种到愈伤组织诱导培养基中.每种处理重复15 次,每瓶接种2 个叶片或2 个顶芽.培养条件:25 ℃,遮光处理.定期观察、统计两种外植体最早出伤时间、愈伤组织状况,并于出伤后2 周统计愈伤组织诱导率.在确定愈伤组织最佳诱导条件的基础上,对诱导产生的愈伤组织进行增殖培养.培养条件同上.
1.4 愈伤组织分化
以MS 为基本培养基,添加不同质量浓度的NAA(0.03 mg/L、0.05 mg/L、0.08 mg/L)和6-BA(1.2 mg/L、1.5 mg/L、1.8 mg/L),两种植物生长调节剂正交,共9 个处理(F1-F9).在超净工作台上,将诱导培养基上产生的愈伤组织切成5 mm×5 mm×5 mm 的小块,接种至分化培养基上,进行分化培养.每种处理重复15次,每瓶接种2 块愈伤组织.培养条件同上.出芽30 d 后统计愈伤组织分化率.
1.5 生根培养
以1/2 MS 培养基为基本培养基,添加不同质量浓度的NAA(0.05 mg/L、0.1 mg/L、0.15 mg/L)和IBA(0 mg/L、0.1 mg/L、0.5 mg/L),两种植物生长调节剂正交,共9 个处理(G1-G9).在超净工作台上,将分化培养基上分化出的芽从基部切下,转接至生根培养基中,进行生根培养.每种处理重复15 次,每瓶接种2 个不定芽.培养条件同上.从第一瓶苗生根30 d 后统计再生苗生根率.
1.6 数据处理
用SPSS19.0 统计分析软件对数据进行处理,利用SNK 法对数据均值进行多重比较,并对影响因变量的各因素进行Pearson 相关性分析.
2 结果与分析
2.1 不同抑菌剂对小叶栀子顶芽启动培养的影响
不同质量浓度抗生素对外植体的杂菌抑制作用结果见表1.

表1 不同质量浓度抗生素对外植体的杂菌抑制作用Tab.1 Mixed bacterium inhibition of antibiotics with different concentrations on explant
由表1 可知,不使用抗生素的外植体污染率最高,达到了73.33%,处理2 次之,污染率达53.33%,处理1 的效果最好,污染率仅为25.00%.与处理1 相比,对照组和处理2 的污染率分别达到了处理1 的2.93 倍和2.13 倍.
对比三组处理的外植体生长状况(图1)可见,处理1 和对照组中的无菌苗生长状况较好,处理2 中的无菌苗生长状况相对较差,说明200 mg/L 的头孢霉素对植物生长有一定的抑制作用.

图1 不同抑菌剂下外植体的生长状况Fig.1 growth statusof explant under different bacteriostatic agent
2.2 愈伤组织诱导和增殖
不同植物生长调节剂组合对小叶栀子愈伤组织诱导的影响结果见表2.

表2 不同植物生长调节剂组合对小叶栀子愈伤组织诱导的影响Tab.2 Effects of callus tissue induction of Gardenia jasminoides Ellis.var.radicans on different combination plant growth regulators
由表2 可知,去叶无菌顶芽的最快出伤时间在接种后的第10 d,而无菌叶片的最快出伤时间在接种后的第18 d.对两种外植体的最早出伤时间和愈伤组织诱导率进行综合分析可知,芽比叶片更适宜进行愈伤组织的诱导,且对于两种外植体而言,2,4-D 质量浓度在3.0 mg/L 时,愈伤组织诱导率最高只达到60%;2,4-D 质量浓度为2.0 mg/L 时,各处理组愈伤组织诱导效果较好,2,4-D 保持最佳水平,6-BA 质量浓度设置0.5 mg/L,愈伤组织诱导效果最好.因此,两种外植体最佳培养基配方组合皆为Y4 号处理(MS培养基+2.0 mg/L 2,4-D+0.5 mg/L 6-BA),去叶无菌顶芽的愈伤组织诱导率可达93.3%,无菌叶片的愈伤组织诱导率亦可达90%,愈伤组织生长状况和增殖状况皆处于良好状态(见图2).

图2 无菌外植体诱导产生愈伤组织与愈伤组织增殖情况Fig.2 Callus tissue induction status under different sterile explant and callus tissue proliferation status
影响愈伤组织诱导率各因素方差分析结果见表3.

表3 影响愈伤组织诱导率各因素方差分析结果Tab.3 Between-subjects effects tests for influencing factors of callus tissue induction rate
由表3 可知,不同2,4-D质量浓度和不同6-BA质量浓度对愈伤组织诱导率均有极显著影响(P<0.01).多重比较结果显示,3 种2,4-D 质量浓度和3 种6-BA 质量浓度间的愈伤组织诱导率均存在极显著差异(P<0.01).
相关分析结果见表4.由表4 可知:2,4-D 与愈伤组织诱导率的偏相关系数为-0.721*(P<0.05),两者具有显著负相关关系;6-BA 与愈伤组织诱导率的偏相关系数为-0.547(P>0.05),两者不存在显著相关关系;2,4-D 与6-BA 的偏相关系数为-0.394(P>0.05),两者不存在显著相关关系.
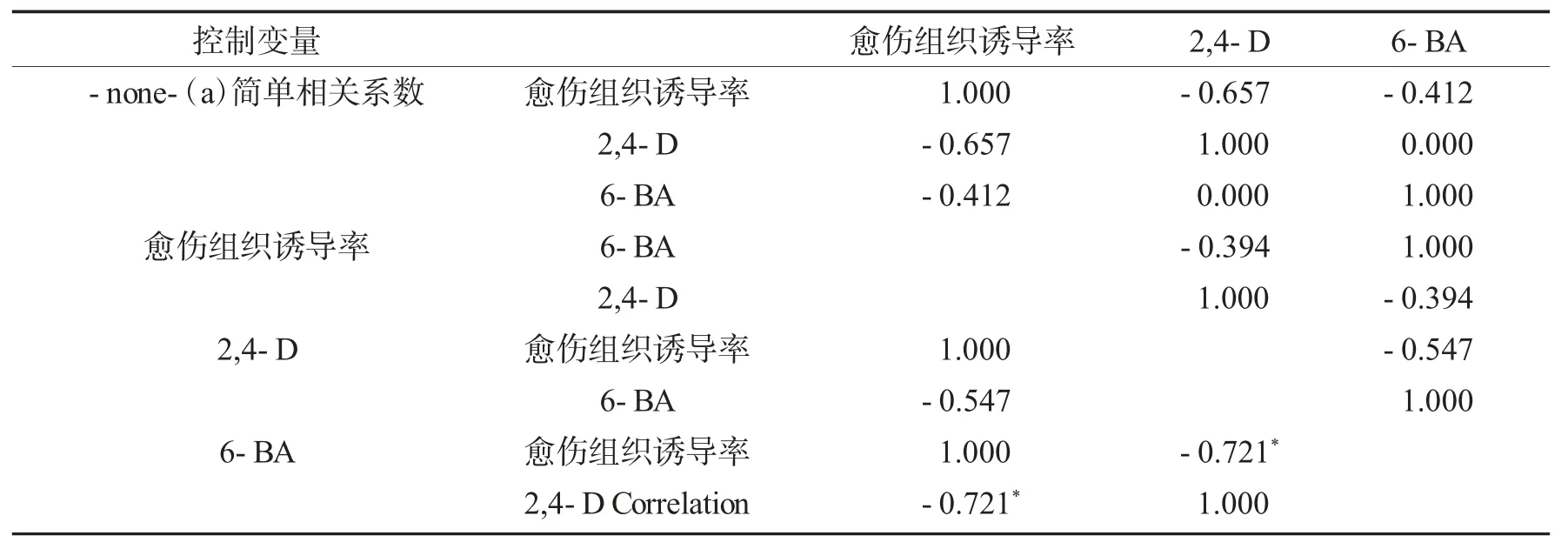
表4 愈伤组织诱导中控制各因素的偏相关分析结果Tab.4 Partial correlation analysis results of controlling factors in callus tissue induction
2.3 愈伤组织分化成芽
不同植物生长调节剂组合对小叶栀子愈伤组织分化的影响结果见表5.

表5 不同植物生长调节剂组合对小叶栀子愈伤组织分化的影响Tab.5 Effects of callus tissue differentiation of Gardenia jasminoides Ellis.var.radicans on different combination plant growth regulators
由表5 可知,当NAA 质量浓度为0.08 mg/L 时,愈伤组织分化率最高只达到43.3%,在此质量浓度下,6-BA 质量浓度设置为1.2 mg/L,愈伤组织分化率低至16.7%,说明6-BA 质量浓度过低,会严重影响NAA 作用的发挥;当NAA 质量浓度为0.05 mg/L 时,愈伤组织分化率普遍较高,在此质量浓度下,6-BA质量浓度设置1.8 mg/L,愈伤组织分化率最高,达到96.7%.因此,最适宜进行愈伤组织分化的植物生长调节剂组合为F6 号处理(MS 培养基+0.05 mg/L NAA+1.8 mg/L 6-BA),且该处理分化的芽及获得的无根再生苗皆处于最佳状态(见图3).

图3 愈伤组织分化状况Fig.3 Differentiation status of callus tissue
影响愈伤组织分化率各因素方差分析结果见表6.

表6 影响愈伤组织分化率各因素方差分析结果Tab.6 Between-subjects effects tests for influencing factors of callus tissue differentiation rate
由表6 可知,不同NAA 质量浓度和不同6-BA 质量浓度对愈伤组织分化率均有极显著影响(P<0.01).多重比较结果显示,0.08 mg/L 的NAA 质量浓度与0.03 mg/L、0.05 mg/L 的NAA 质量浓度的愈伤组织分化率存在极显著差异(P<0.01),0.03 mg/L、0.05 mg/L 的NAA 质量浓度的愈伤组织分化率差异不显著(P>0.05);1.2 mg/L 的6-BA 质量浓度与1.5 mg/L 的6-BA 质量浓度的愈伤组织分化率存在显著差异(P<0.05),与1.8 mg/L 的6-BA 质量浓度的愈伤组织分化率存在极显著差异(P<0.01),1.5 mg/L 的6-BA 质量浓度与1.8 mg/L 的6-BA 质量浓度的愈伤组织分化率差异不显著(P>0.05).
相关分析结果见表7.由表7 可知:NAA 与愈伤组织分化率的偏相关系数为-0.692(P>0.05),两者不存在显著相关关系;6-BA 愈伤组织分化率的偏相关系数为0.716*(P<0.05),两者具有显著负相关关系;NAA 与6-BA 的偏相关系数为0.469(P>0.05),两者不存在显著相关关系.

表7 愈伤组织分化中控制各因素的偏相关分析结果Tab.7 Partial correlation analysis results of controlling factors in callus tissue differentiation
2.4 生根诱导和培养
不同植物生长调节剂组合对小叶栀子再生苗生根的影响结果见表8.
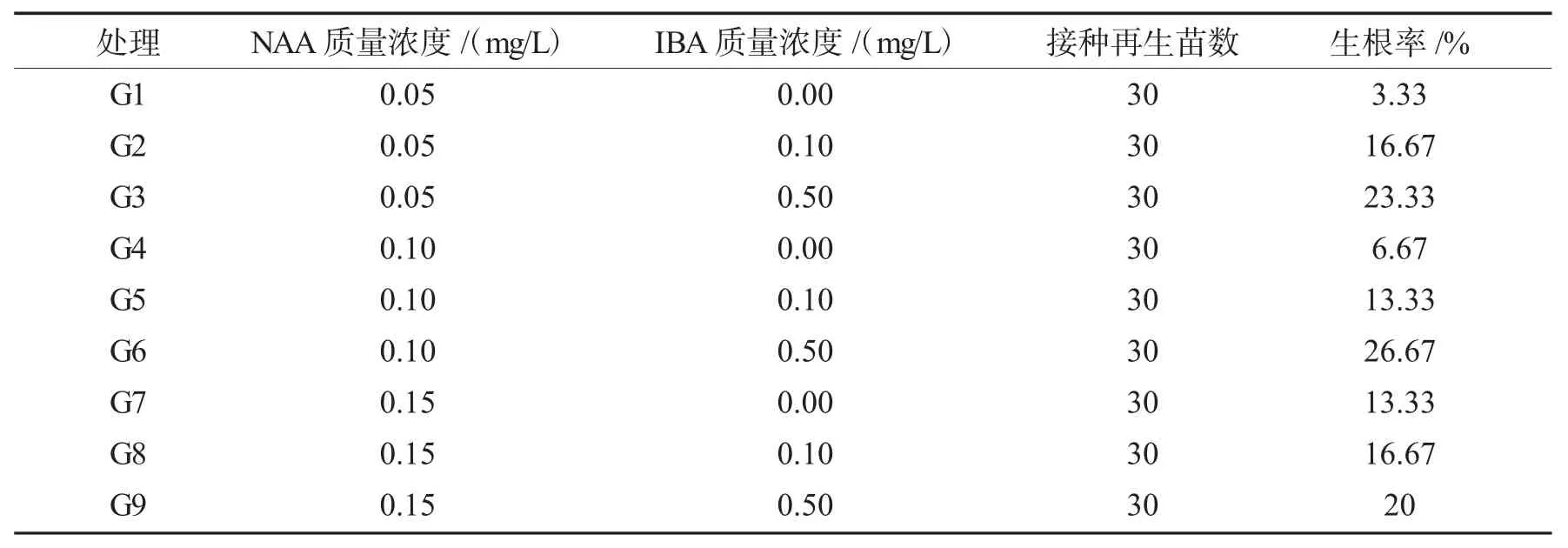
表8 不同植物生长调节剂组合对小叶栀子再生苗生根的影响Tab.8 Effects of rooting of regenerated plantlets of Gardenia jasminoides Ellis.var.radicans on different combination plant growth regulators
由表8 可知,在不添加IBA 且NAA 质量浓度在0.05 mg/L 时,再生苗生根率最高仅达到3.33%;在IBA 质量浓度为0.5 mg/L 时,生根率普遍较高,NAA 质量浓度设置为0.10 mg/L 时,效果最好,再生苗生根率达到26.67%.因此,最适宜进行再生苗生根的植物生长调节剂组合为G6 号处理(1/2 MS 培养基+0.10 mg/L NAA+0.50 mg/L IBA),且该处理下的再生苗产生不定根和再生苗生长情况皆处于最佳状态(见图4).

图4 再生苗产生不定根Fig.4 Adventitious root status of regenerated plantlets
影响无菌无根苗生根率各因素方差分析结果见表9.
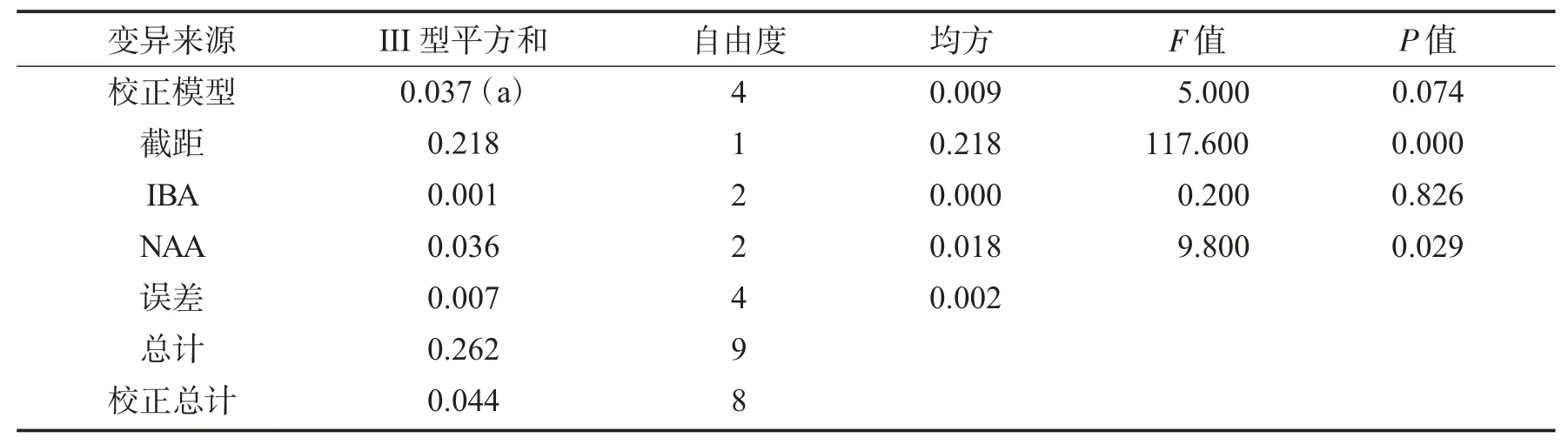
表9 影响无菌无根苗生根率各因素方差分析结果Tab.9 Between-subjects effects tests for influencing factors of sterile rootless seedlings rooting rate
由表9 可知,不同NAA 质量浓度对无菌无根苗生根率无显著影响(P>0.05),不同IBA 质量浓度对无菌无根苗生根率有显著影响(P<0.05),因此,只需对IBA 质量浓度的不同水平的均值进行多重比较即可.多重比较的结果显示,0.00 mg/L 的IBA 质量浓度与0.50 mg/L 的IBA 质量浓度的无菌无根苗生根率存在显著差异(P<0.05),0.00 mg/L 的IBA 质量浓度与0.10 mg/L 的IBA 质量浓度以及0.10 mg/L 的IBA 质量浓度与0.50 mg/L 的IBA 质量浓度的无菌无根苗生根率差异不显著(P>0.05).
相关分析结果见表10.由表10 可知:NAA 与再生苗生根率的偏相关系数为0.248(P>0.05),两者不存在显著相关关系;IBA 与再生苗生根率的偏相关系数为0.861**(P<0.01),两者具有极显著的正相关关系;NAA 与IBA 的偏相关系数为-0.214(P>0.05),两者不存在显著相关关系.

表10 再生苗生根中控制各因素的偏相关分析结果Tab.10 Partial correlation analysis results of controlling factors in rooting of regenerated plantlets
3 讨论与结论
植物材料经过消毒处理后,材料内部一定程度上依然会留存杂菌,存在发生内源菌体污染的风险[21].无菌外植体具有明显的优点:可确保外植体的无菌状态,从而有效提高组培接种的成功率和有效性.前人研究发现,选用合适的抗生素溶解在培养基中,可以产生不同程度的抑菌效果[22].本研究采用外植体接种前在抗生素溶液中浸泡的方法,寻找到了能够显著降低外植体污染的最佳抗生素配方.利用获取的无菌材料进行愈伤组织诱导,能够最大程度地规避影响愈伤组织诱导率产生变化的菌体污染因素.
愈伤组织诱导实验的成功,不仅取决于植物材料本身,很多情况下更重要的是取决于培养基中激素种类及配比的影响[23-24].有研究表明,单独使用2,4-D 仅可诱导出少量愈伤组织,而2,4-D 与6-BA 配合使用则可诱导出大量愈伤组织[25].本研究采用小叶栀子的无菌叶片和无菌顶芽为外植体,通过添加不同质量浓度水平的2,4-D 和6-BA 进行对比实验,发现不同的植物生长调节剂质量浓度配比对愈伤组织诱导率有极显著影响,2,4-D 在此过程中发挥了较为重要的作用,这与前人的研究结果基本一致[26-28].同时,本研究中顶芽的愈伤组织诱导率高达93.3%,启动培养基上生长的顶芽展开的无菌叶片的愈伤组织诱导率亦达到90%,这表明了幼嫩、分裂旺盛的部位具有较强的脱分化与再分化的能力,更易产生愈伤组织,这与潘清平等[19]、张虹等[29]、Deng 等[30]的研究结果相似.
细胞分裂素可以促进细胞的分裂与膨大,生长素则可以促进细胞的生长.研究表明,细胞分裂素/生长素比例较高时可促进芽的分化,比例适中时有利于愈伤组织的诱导和苗的生长,比例较低时促进根的生长[31-33].本研究采用了高质量浓度细胞分裂素和低质量浓度生长素搭配,进行愈伤组织分化,结果显示愈伤组织分化最佳培养基配方为MS 培养基附加0.05 mg/L NAA 和1.8 mg/L 6-BA,分化率高达96.7%,这与商圆圆[34]的研究结果相一致.值得注意的是,在实验过程中还发现,有些愈伤组织不能进行分化,原因可能是愈伤组织生长时间太长,失去了分化能力或没有形成胚状体.有研究表明,TDZ 是一种多功能性的人工合成的植物生长调节剂,能有效促进木本植物芽的诱导[35-36].因此,后续研究可考虑在培养基中添加TDZ,以解决部分愈伤组织未能有效分化,以达到更为有效地促进愈伤组织不定芽诱导的目的.
前人研究表明,愈伤组织诱导和分化阶段使用MS 培养基最为常见,而在生根壮苗阶段使用1/2 或1/4MS 培养基效果较好[34,37-38].本研究选用1/2 MS 培养基作为再生苗生根培养的基本培养基,对小叶栀子再生苗进行生根培养,生根率相对较高,最佳植物生长调节剂配比为0.05 mg/L NAA 和1.8 mg/L 6-BA,生根率可达26.67%.值得一提的是,不同IBA 质量浓度对无菌无根苗的生根率有显著影响,存在极显著的正相关关系,在生根过程中发挥了重要作用.
本研究利用小叶栀子的无菌叶片、顶芽进行离体培养,针对小叶栀子离体快繁过程中外植体启动、愈伤组织诱导、分化、生根阶段存在的关键问题,对小叶栀子的再生体系进行了优化,成功建立了小叶栀子的离体再生体系,为大规模扩繁生产小叶栀子幼苗奠定了基础,也为其广泛推广应用创造了有利条件.

