‘红粉佳人’樱花对高温胁迫的生理响应
洪志猛,夏思颖
(1. 福建省林业科学研究院,福建 福州 350012;2. 福建农林大学林学院,福建 福州 350002)
随着全球气候变暖,温室效应的不断加剧,高温极端天气日趋严重。高温胁迫对植物的生长产生不良影响,导致其生理生化反应发生异常变化,严重时甚至导致植物死亡[1]。城市夏季的温室效应已经成为制约绿化树种生长的主要环境因子[2]。近年来一些学者开展樱花抗热性研究。聂超仁等[3]对12个樱花新品种耐热性从强到弱依次为‘吉野垂枝’>‘八重红大岛’> ‘御车返’>‘琉球绯樱’> ‘衣通姬’> ‘松月’> ‘染井吉野’> ‘八重红枝垂’> ‘椿寒樱’> ‘河津樱’> ‘神代曙’> ‘奖章’。胡娜等[4]对4 种原生樱花耐热性研究表明,华中樱Prunusconradinae耐热性较强, 迎春樱P.discoidea、福建山樱P.campanulata次之,尾叶樱P.dielsiana较弱。许学洪等[5]对热带北缘樱花引种表明,‘广州樱’、‘中国红’生长好,‘日本晚樱’适应性差。相关研究主要集中于生长适应性观测、细胞损伤率等研究,系统地从生理生化指标开展樱花耐热性研究鲜有报道。
‘红粉佳人’樱花P.pseudocerasus×incisa,系中国樱桃P.pseudocerasus与富士樱P.incisa培育出来的特殊品种,颜色粉嫩,带有淡淡的香味,十分特殊,花期2~3 月,原为台湾武陵农场独特品种,素有武陵“樱花皇后”之称[6]。2014 年从台湾引进‘红粉佳人’品种种植于海拔1100 m 的三明大田县屏山乡仙居山樱花园基地,苗木长势良好,适应性强。据观测,在2018 年冬季极端低温零下11~12 ℃条件下,樱花树不受冻,耐寒冷性强。近年来,‘红粉佳人’因树形美观、观赏效果好而广泛推广应用于城市绿化和公园建设,城市高温胁迫环境是影响‘红粉佳人’推广应用效果的主要环境因子。为了探讨其耐热适应性情况,本文对引进‘红粉佳人’品种开展高温胁迫下生理响应研究,为其在南方更大区域的推广应用提供理论依据。
1 材料与方法
1.1 材料
试验材料来源于国家林业和草原局“948”项目大田县屏山乡引种试验基地,选择培育1 年生生长健壮、整齐一致的‘红粉佳人’嫁接袋装苗,嫁接砧木为台湾绯寒樱P.campanulata,袋装苗容器袋规格10 cm×15 cm,容器袋材质为无纺布育苗袋,苗高70 cm 左右。试验设计为5 组,每组6 株。在光照强度10000 lx、相对湿度50%的人工气候培养箱培养。培养箱温度设置25 ℃、30 ℃、35 ℃、40 ℃、45 ℃等5 个温度梯度,胁迫处理时间为2 h、4 h、6 h、8 h,不同温度梯度均以25 ℃处理0 h 作为对照处理。从顶芽以下选取第5片幼叶测定生理指标,重复3 次。
1.2 方法
参照孔祥生等[7]方法测定叶绿素含量,采用考马斯亮蓝法G-250 染色法测定可溶性蛋白含量[8],硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,紫外吸收法测定过氧化氢酶(CAT)活性,抑制氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性,可溶性糖含量测定均按照王学奎[9]的方法,过氧化物酶(POD)活性采用愈创木酚法测定[10]。耐热性指标系数参照周广生等[11]的方法计算,各个生理单项指标的耐热系数进行主成分分析。
生理指标耐热系数(a):a=各指标测定值/对照测定值×100%
1.3 数据分析
利用SPSS 软件进行数据相关性分析、显著性差异检验和主成分分析,利用Origin2018 软件制图。
2 结果与分析
2.1 高温胁迫对‘红粉佳人’叶片生理指标的影响
2.1.1 叶绿素含量
从图1 可见,随着胁迫时间延长,在温度25 ℃条件下‘红粉佳人’叶绿素含量呈下降趋势,30 ℃、35 ℃处理则叶绿素含量不降反增,40 ℃处理叶绿素含量是先降后升,最高值是最低值的1.2 倍。45 ℃胁迫处理2 h,叶绿素含量达最高值2.412 mg·g-1,是25 ℃胁迫2 h 的2.05 倍。45 ℃胁迫处理2 h、4 h、6 h、8 h 分别比25 ℃对应胁迫时间的值增加105%、39.58%、75.91%和69.24%;45 ℃胁迫处理的叶绿素含量反而增加。总体来说,高温胁迫下‘红粉佳人’叶绿素含量随着温度升高,呈现先下降后增长的趋势,除25 ℃外,同一温度处理随着胁迫时间延长叶绿素含量有显著变化。
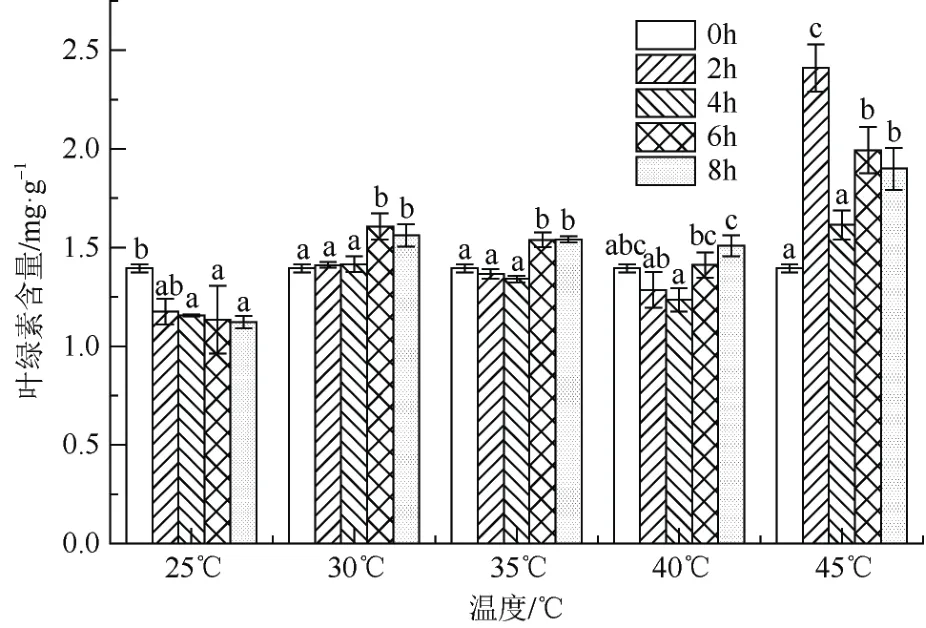
图1 高温胁迫对‘红粉佳人’叶绿素含量的影响Fig. 1 Effects of high temperature stress on chlorophyll contents of Prunus pseudocerasus × incisa
2.1.2 可溶性蛋白含量
从图2 可以看出,处理6 h 后,随着胁迫温度提升,可溶性蛋白含量呈先升后降的趋势。30 ℃胁迫处理6 h 可溶性蛋白含量达最高值1.748 mg·g-1,是25 ℃、35 ℃处理6 h 的1.51 倍和1.41 倍。45 ℃高温胁迫处理2 h、4 h、6 h、8 h 可溶性蛋白含量仅占25 ℃相对应胁迫处理时间的55.66%、68.74%、55.63%、56.38%,降低近一半,可见高温胁迫对可溶性蛋白影响较大。
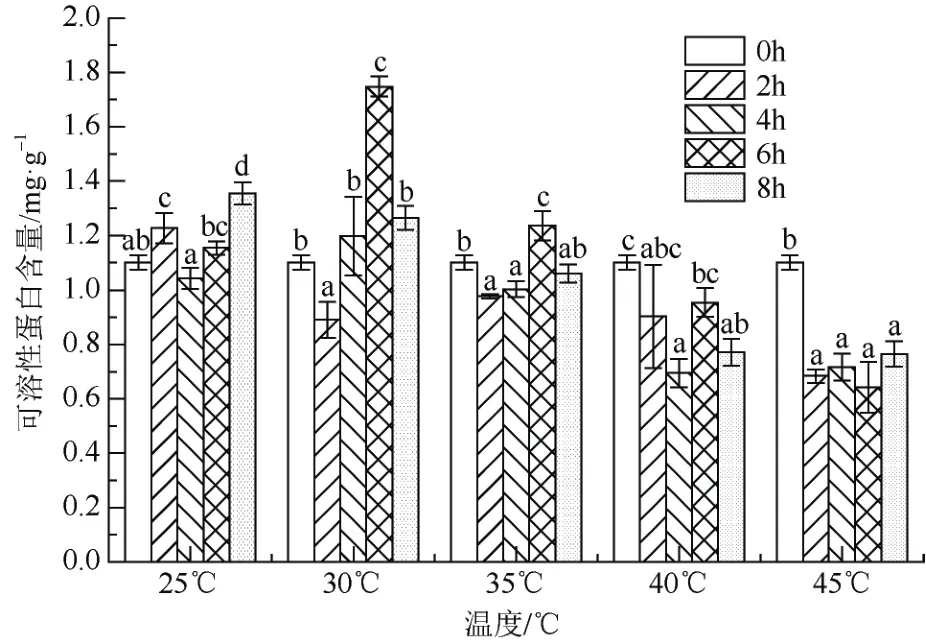
图2 高温胁迫对‘红粉佳人’可溶性蛋白含量的影响Fig. 2 Effects of high temperature stress on soluble protein contents of Prunus pseudocerasus × incisa
2.1.3 MDA 含量
从图3 可以看出,在25 ℃和30 ℃处理下,随着胁迫时间的延长,‘红粉佳人’MDA 含量先增加后下降,分别在6 h、4 h 达到峰值而后下降,峰值是比对照增加24.41%、31.50%。当温度达35 ℃以上,随则胁迫温度升高,MDA 含量变化不大,45 ℃胁迫处理 2 h,MDA 含量达到最高,为0.191 μmol·g-1,比25 ℃胁迫处理2 h 增加38.41%。从整体上来看,随着胁迫温度的升高,MDA 含量呈先增加后下降的趋势,同一温度不同处理时间也均存在一定的差异。
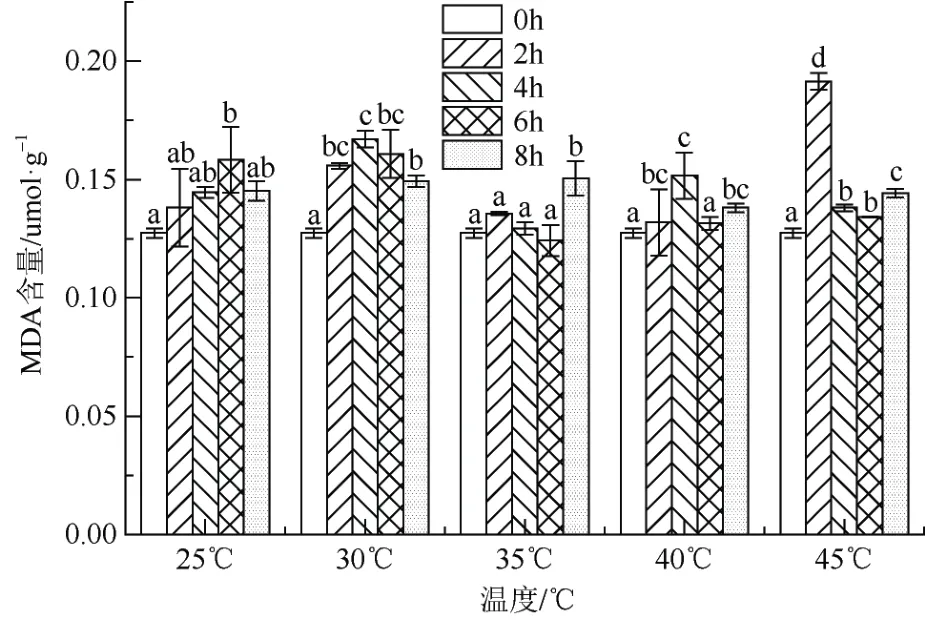
图3 高温胁迫对‘红粉佳人’MDA 含量的影响Fig. 3 Effects of high temperature stress on MDA contents of Prunus pseudocerasus × incisa
2.1.4 CAT 活性
温度胁迫处理对‘红粉佳人’CAT 影响如图4所示。随着胁迫温度的升高,在处理4 h 时,CAT活性呈现逐渐上升趋势;在处理6 h 时,35 ℃、40 ℃条件下的CAT 活性达到高峰,45 ℃的CAT 活性相对于40 ℃有所下降。同一温度下随着胁迫时间的延长CAT 活性大致呈先升高后下降的趋势。45 ℃处理2 h、4 h、6 h、8 h 比25 ℃对应时间处理的值增加14.38%、39.04%、1.69%、19.08%。总体来说,高温胁迫下CAT 活性增强。
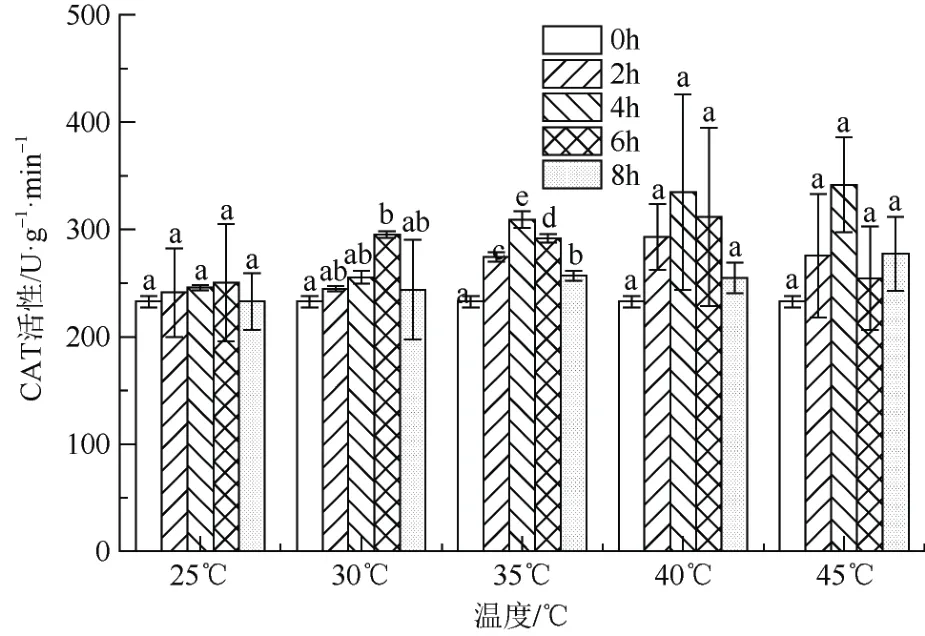
图4 高温胁迫对‘红粉佳人’CAT 活性的影响Fig. 4 Effects of high temperature stress on CAT activities in Prunus pseudocerasus × incisa
2.1.5 POD 活性
从图5 可看出,POD 随着温度的增加而增加,45 ℃高温胁迫处理2 h、4 h、6 h、8 h 是25 ℃对应胁迫时间的3.92 倍、1.80 倍、1.03 倍、1.17 倍。同一温度的随着胁迫时间的延长均呈现显著差异性。总体上,温度胁迫提高‘红粉佳人’POD 活性。
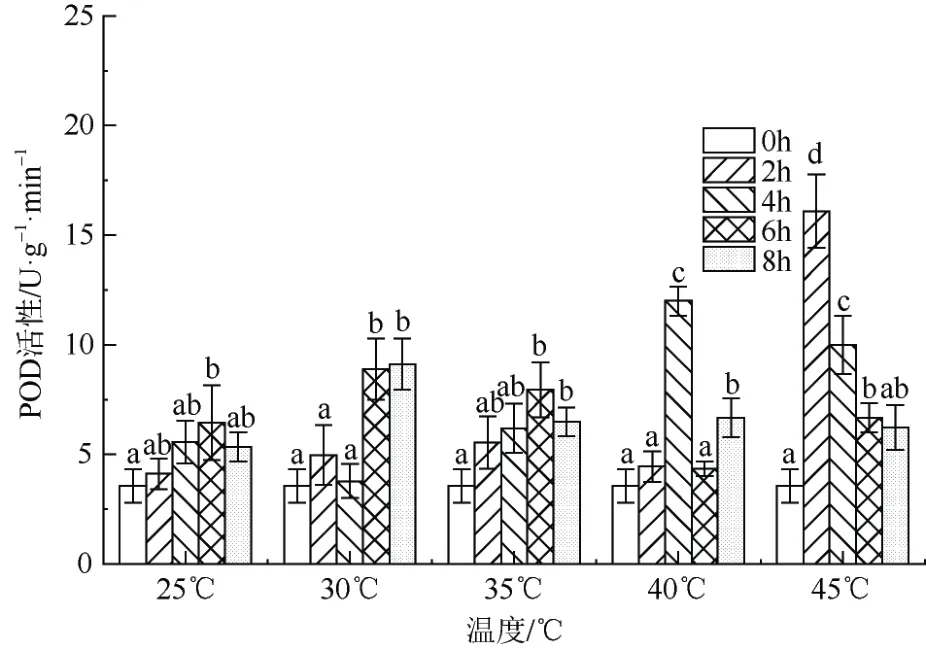
图5 高温胁迫对‘红粉佳人’POD 活性的影响Fig. 5 Effects of high temperature stress on POD activities of Prunus pseudocerasus × incisa
2.1.6 SOD 活性
在不同温度处理下,SOD 活性随时间变化的趋势有所差异(图6)。在40 ℃范围内,SOD 活性随时间变化波动上升,45 ℃高温胁迫下SOD 活性显著增强,并在处理6 h 时达高峰,是对照的1.3 倍,随后显著下降。40 ℃条件下,SOD 活性在处理4 h 时达最低,仅为对照的84.23%。从SOD 活性来看,‘红粉佳人’在40 ℃以上高温时出现异常变化。
2.1.7 可溶性糖含量
从可溶性糖含量变化来看(图7),随着胁迫温度的升高,可溶性榶含量呈先下降再升高的现象。40℃达到最低值,40 ℃胁迫处理2 h、4 h、6 h、8 h的可溶性糖含量分别为 25 ℃相应处理时间的46.31%、27.67%、68.73%、55.88%,最低值为40 ℃胁迫处理4 h,仅为对照的32.48%。45 ℃高温胁迫下可溶性糖含量呈现升高趋势,45 ℃胁迫8 h 的可溶性糖含量为1.787 mg·g-1,是40 ℃胁迫8 h 值为1.026 mg·g-1的1.74 倍。在同一温度下,可溶性糖含量随着胁迫时间延长均存在显著性差异(P<0.05)。
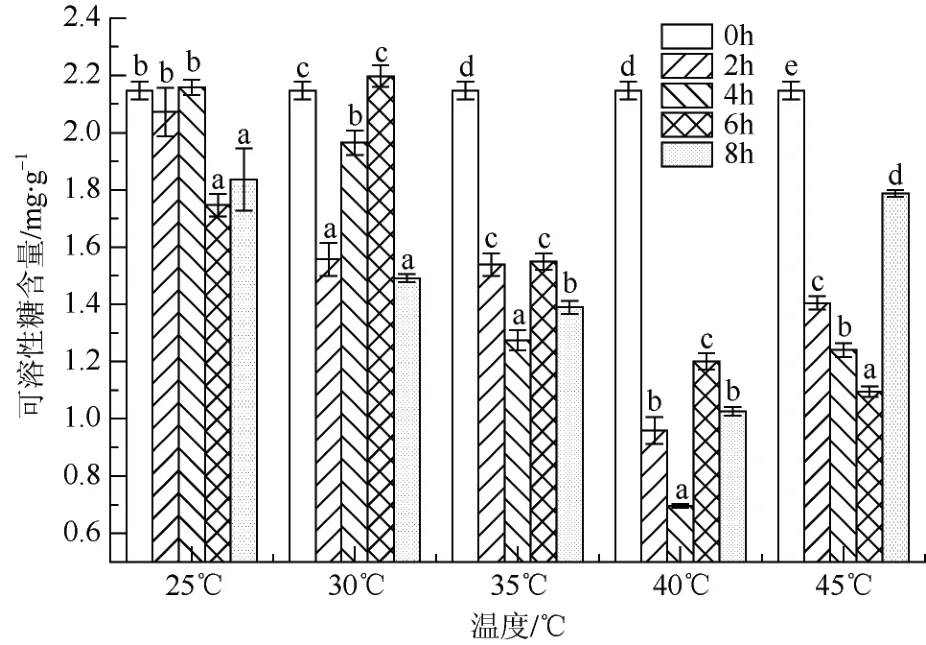
图7 高温胁迫对‘红粉佳人’可溶性糖含量的影响Fig. 7 Effects of high temperature stress on soluble sugar contents of Prunus pseudocerasus × incisa
2.2 生理指标的主成分分析
依据主成分分析法将7 项生理指标的耐热性系数转换成7 个主成分,按照累积贡献率≥80%的标准提取主成分作为‘红粉佳人’耐热性的综合指标。前4 个主成分的贡献率分别为36.80%、24.21%、13.82%和8.54%,累积贡献率达83.37%。各指标的特征值如表2 所示。提取的4 个主成分(Y1、Y2、Y3和Y4)、X1~X7分别表示7 个生理指标,各指标特征向量为系数[11],建立4 个主成分的函数关系式:
Y1=0.678X1-0.627X2+0.547X3+0.515X4+0.770X5+0.171X6-0.733X7
Y2=0.354X1+0.402X2+0.568X3-0.491X4+0.190X5+0.782X6+0.443X7
Y3=-0.311X1+0.564X2+0.355X3+0.487X4+0.331X5-0.253X6+0.125X7
Y4=0.283X1-0.130X2+0.083X3-0.229X4+0.200X5-0.519X6+0.363X7
主成分的特征向量值越大,其单项生理指标对综合指标的贡献值也越大[13]。从表1 的各指标分析得知,高温胁迫‘红粉佳人’耐热性评价第1 主成分中贡献最大是POD 值活性,为0.770,其次是叶绿素含量,特征向量值为0.678,体现出高温胁迫下首先植物细胞结构受到破坏、过氧化物增加,植物启动抗氧化酶系统维持体内平衡;第2 主成分中SOD 活性贡献最大,为0.782,其次是MDA 含量,主要是细胞保护酶系统,消除过氧化物维护细胞体内机体平衡;第3 主成分可溶性蛋白最大,其次是CAT 含量,主要是细胞渗透调节和抗氧化系统保护;第4 主成分可溶性糖特征向量最大,主要反应植物渗透调节能力[14]。
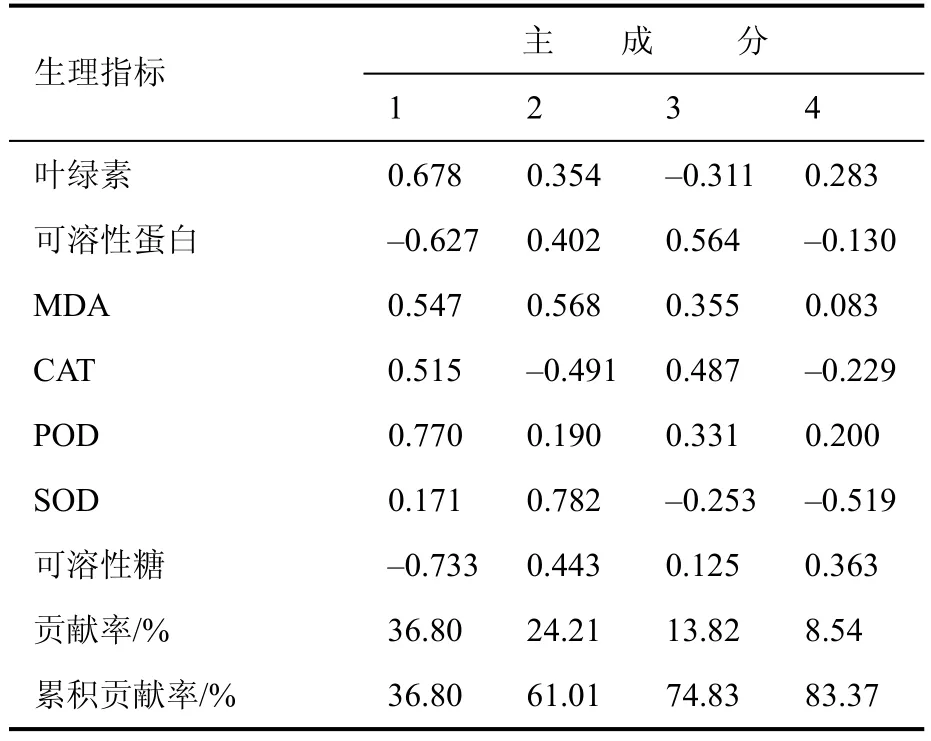
表1 生理指标的主成分分析Table 1 Principal component analysis of physiological biochemical indexes
3 结论与讨论
叶绿素作为光合作用的重要色素,其含量变化反映植物抗逆能力[15]。一般认为,高温胁迫导致叶绿体结构被破坏,叶绿素含量显著减少,植株光合效率低下[16—17]。而本研究表明,较长时间高温促进‘红粉佳人’叶绿素含量显著升高,虽然35 ℃、40 ℃胁迫处理2 h、4 h 时叶绿素含量减少,但处理6 h、8 h 时叶绿素含量增多,在45 ℃胁迫状态下叶绿素含量反而增加并达到最高值。可见,‘红粉佳人’抗热性较强,能较好适应高温环境。此外,高温胁迫使植物叶片相对含水量降低,叶片生长受阻,叶面积减小,以致单位面积的叶绿素含量升高[18]。
丙二醛(MDA)是膜脂过氧化最重要的产物之一。本研究表明,随着胁迫处理时间延长,‘红粉佳人’MDA 含量先增加而后下降,同一温度的不同处理时间也均呈现显著性差异,但除35 ℃胁迫处理8 h 达到最高值外,其余同一温度随着胁迫处理时间的延长MDA 含量均呈现先升后降的趋势。因此,从MDA 含量的变化来看,‘红粉佳人’可在一定范围内耐受较高温度环境,具有一定的抗热性。
植物通过自我调节渗透物质含量提高应对外界环境胁迫的能力[19—20],主要是调节自身可溶性蛋白和可溶性糖含量来稳定细胞内环境[21]。随着胁迫温度升高,‘红粉佳人’叶片可溶性蛋白呈现先升后降、的现象,这与郑宇等[2]、杨炜茹等[22]研究成果相致。‘红粉佳人’在应对外界环境变化时,首先是提高自身的渗透物质含量来维持细胞平衡,应对外界不利环境。随后可溶性蛋白含量下降可能与‘红粉佳人’自身基因抗热性有关[21]。可溶性糖的积累则呈现先下降再升高的变化趋势。‘红粉佳人’引种于台湾,长期适应于低纬度环境,虽然在大田县屏山乡海拔1100 m 生长良好,但其抗热性较强,这与聂仁等[3]对12 个樱花新品种耐热性LT50 均达到57 ℃以上的结论相一致。45 ℃胁迫处理下其可溶性糖增加是为适应高温胁迫环境而自身提升调节免疫。
植物在高温胁迫环境下会产生过量的活性氧,对细胞内环境的造成破坏[23]。由CAT、POD、SOD等构成抗氧化酶系统,能消除活性氧的危害,有效保护细胞维持正常生理过程。在高温胁迫下,‘红粉佳人’的CAT、POD、SOD 等抗氧化酶均得到显著提高,表明植物体在受到外界环境胁迫时,能够迅速提升自身的防御能力,保持细胞内环境的稳定。但随着胁迫温度的升高,CAT、SOD 等值均呈下降趋势,说明‘红粉佳人’具有较强的抗热性,能够应对外界温度的变化。通过对生理指标耐热性系数进行主成分分析,POD 活性、叶绿素、SOD含量、可溶性蛋白和可溶性糖是影响高温胁迫的主导指标。

