EBV下调miR-34c促进鼻咽癌细胞增殖、迁移的作用及机制研究
张 萃,吴应玲,丁景菊,王 胜,谷 雨,何 磊,蒋正举
(1.贵州省六盘水市人民医院 耳鼻喉科,553001;2.遵义医科大学附属医院 耳鼻咽喉头颈外科,贵州 遵义 563001)
鼻咽癌 (nasopharyngeal carcinoma,NPC) 是一种源自鼻咽隐窝上皮的人类恶性肿瘤,在东南亚的发病率高,并且与遗传及爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV)感染有关[1]。EBV被认为是NPC的病因,是第一个鉴定的编码miRNA的人类致癌病毒[2]。研究[3-5]显示EBV-miRNA有助于癌症存活率和肿瘤细胞迁移。目前,放疗是NPC的首选治疗方法,已被证明可以提高病人生存率。尽管NPC的5年局部控制率已达到80%~90%,但仍有15%~30%的病人发生远处转移[6]。因此,阐明NPC转移的机制对于改善预后和治疗结果具有重要意义。
miR-34c是位于人类11号染色体上的77 bp非编码RNA,属于miR-34家族,可通过与靶基因序列片段结合调控细胞进程[7]。miR-34c通过与Bcl2基因的3′非翻译区配对抑制Bcl2,从而下调喉癌细胞的活力并诱导其凋亡[7]。miR-34c可调节非小细胞肺癌的发展和维持内质网稳态[8]。研究[9]显示,低水平的miR-34c是NPC病人的危险因素,miR-34c在NPC组织中下调,其下调显示可抑制细胞凋亡。相关研究[2]表明,EBV感染和EBV编码的miRNA也与鼻咽癌的发展有关。到目前为止,EBV下调miR-34c在NPC进展中的作用仍然未知。本研究旨在探讨EBV下调miR-34c对促进NPC细胞增殖和迁移的作用及机制。
1 材料与方法
1.1 细胞培养
人EBV阴性NPC细胞系(SUNE1、CNE2和HK1)和EBV阳性C666-1细胞系购自中国典型培养物保藏中心。所有NPC细胞均在含有10%胎牛血清RPMI-1640培养基中于5% CO2、37 ℃孵箱培养。
1.2 试剂和耗材
胎牛血清(Gibco),RPMI-1640培养基(HyClone),Lipofectamine 2000转染试剂盒、PrimeScript RT Master Mix试剂盒(Invitrogen),引物[生工生物工程(上海)股份有限公司],磷酸酶抑制剂混合物(Sigma Chemical),RIPA裂解缓冲液(Beyotime Biotech),GAPDH、Vimentin、Snail、MMP2、MMP3和Erk1、Erk12抗体(Abcam),CCK-8(Solarbio)。
1.3 细胞转染
细胞转染前,将培养基更换为不含胎牛血清的培养基,转染当天将细胞以1×105个/孔接种于6孔板中。miR-34c模拟物和NC siRNA均购自上海生工生物科技有限公司,分为miR-34c转染EBV阳性NPC细胞组(miR-34c组)和EBV阳性NPC细胞组(EBV组)。细胞转染严格按照Lipofectamine 2000转染试剂盒说明书进行,转染8 h后,将培养基更换新鲜培养基。
1.4 实时定量荧光PCR(qPCR)
使用RNAiso Plus试剂提取细胞中的总RNA,通过PrimeScript RT Master Mix试剂盒反转录为cDNA,GAPDH作为内参,每个样本3个复孔。miR-34c引物,F:5′-AAG AAC CTG CTA GAC CCC TGG AG-3′;R:5′-TGC TTC CTC AGT CTT CTC ACT CAG-3′,由生工生物工程(上海)股份有限公司合成。根据制造商的说明,使用ABI PRISM 7000仪器对样品进行分析,采用2-ΔΔCT法计算目的基因相对表达量。
1.5 Western blotting
使用蛋白酶和磷酸酶抑制剂混合物的RIPA裂解缓冲液中裂解细胞。将细胞以1.6×104g离心15 min取上清,SDS/PAGE电泳分离蛋白,转移至硝酸纤维素(NC)膜。将膜在室温下以5%脱脂牛奶-PBS溶液封闭1 h。随后,待测蛋白与一抗4 ℃静置过夜,NC膜用PBS溶液洗涤3次,加入山羊抗兔IgG(HRP偶联物),室温孵育1 h。最后,用PBS溶液洗涤NC膜,并通过电化学发光试剂显色。并通过ImageJ 软件(Image J 1.8.0,National Institute of Health)可视化目标条带,以GAPDH为内参蛋白。
1.6 细胞活力测定
通过 CCK-8 测量细胞活力。NPC细胞(1×103个/孔)在96孔板中培养8、12、24和48 h,加入10 μL CCK-8溶液,继续培养4 h。最后,通过酶标仪(SpectraMax iD5,Molecular Devices,USA)在450 nm处测定吸光度(OD)。
1.7 划痕愈合试验
将细胞接种到6孔板中,并在血清饥饿24 h后使用无菌200 μL枪头创建人工伤口。然后用无血清培养基洗涤细胞以去除碎片和漂浮细胞。24 h后在倒置显微镜下拍照。使用Image J软件打开图片后,随机划取6至8条水平线,计算细胞划痕面积均值。伤口愈合率=(0 h划痕面积-24 h划痕面积)/0 h划痕面积。
1.8 Transwell细胞侵袭试验
对转染细胞经胰蛋白酶酶解制备成细胞悬液,将2×104个细胞接种在200 μL含有1%胎牛血清DMEM溶液的铺有8%基质凝胶的Transwell小室上室,下室加入500 μL含有10%胎牛血清的DMEM。细胞培养2 h后,除去上室中的液体,擦去上室壁上的细胞。Transwell小室另一侧的细胞固定20 min,Transwell小室用结晶紫染色15 min,然后用PBS溶液冲洗。在200倍显微镜下拍照。对随机选取的3个视野中的细胞进行计数,取平均值作为穿透膜的细胞数。实验重复3次。
1.9 统计学方法
采用t检验、方差分析和q检验。
2 结果
2.1 EBV下调miR-34c在NPC细胞中的表达
EBV阴性NPC细胞系(SUNE1、CNE2和HK1)和EBV阳性NPC细胞系(C666-1)中miR-34c水平检测显示,miR-34c在C666-1细胞中低表达(P<0.05)(见表1)。 miR-34c模拟物表达载体转染C666-1细胞后,采用qPCR测定转染细胞中miR-34c的水平,结果显示,miR-34c明显上调(P<0.01)(见表2)。

表1 EBV阴性NPC细胞系和阳性NPC细胞系中miR-34c水平比较

表2 C666-1细胞中miR-34c的水平比较
2.2 EBV下调miR-34c促进C666-1细胞增殖、迁移和侵袭
CCK-8结果显示,miR-34c组C666-1细胞在16、24、48 h的活力均明显低于EBV组(P<0.01)(见表3)。划痕试验和Transwell试验结果显示,与miR-34c组比较,EBV组C666-1细胞迁移和侵袭能力均明显增强(P<0.01)(见图1、表3)。

表3 EBV下调miR-34c促进C666-1细胞增殖、迁移和侵袭能力
2.3 EBV下调miR-34c对C666-1细胞迁移相关蛋白水平的影响
Western blotting结果显示,与miR-34c组比较,EBV组C666-1细胞迁移和侵袭相关蛋白Vimentin、Snail、MMP-2和MMP-3表达均明显升高(P<0.01)(见图2、表4)。
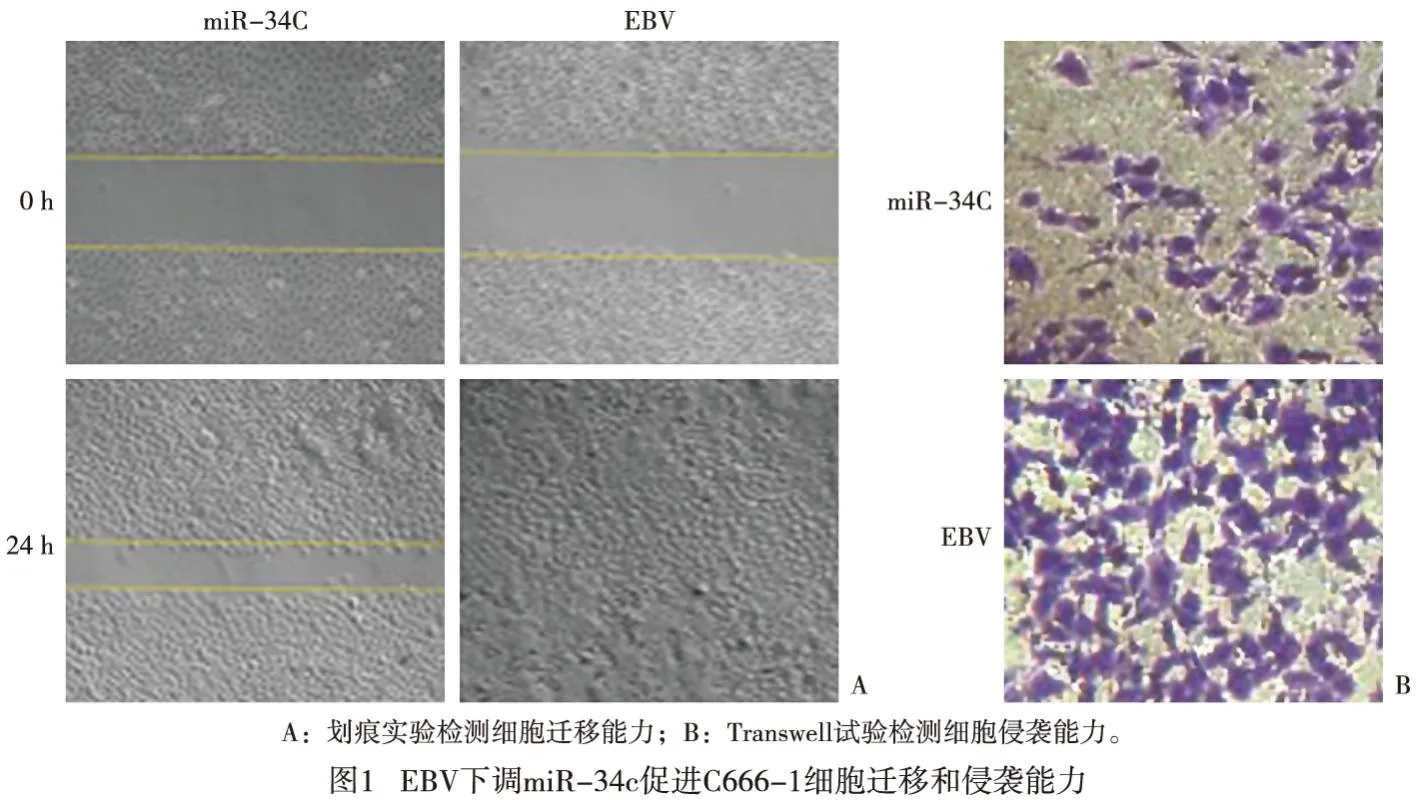
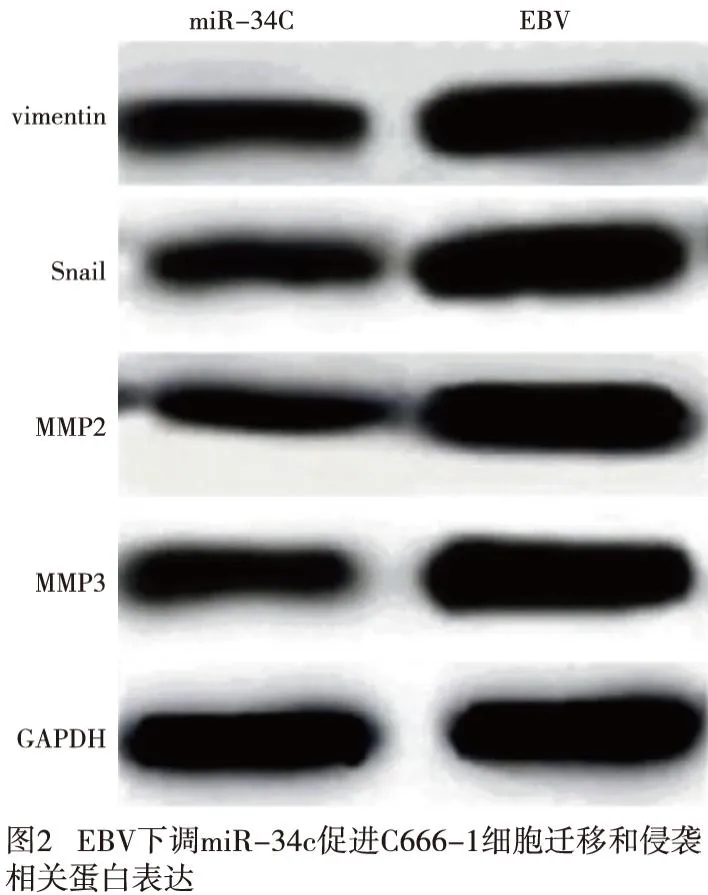

表4 EBV下调miR-34c促进C666-1细胞迁移和侵袭相关蛋白的表达
2.4 EBV下调miR-34c通过激活Erk1/2通路对C666-1细胞迁移作用
与miR-34c组比较,EBV组C666-1细胞Erk1、Erk2蛋白表达均明显升高(P<0.01)(见图3、表5)。

表5 Western blotting检测Erk1、Erk2蛋白表达
3 讨论
NPC是一种具有高度侵袭性和转移性的恶性肿瘤[10]。增殖、转移是恶性肿瘤的主要标志,是大多数癌症相关死亡的原因,放疗是NPC治疗的主要手段[11],NPC局部控制的多模式治疗取得长足进步和改善[12]。因此,更好地了解NPC增殖、转移的分子模式对于开发NPC新治疗策略至关重要[13]。在NPC病例中,观察到miRNA表达失调,发现特定miRNA的异常表达与NPC细胞的增殖、转移和侵袭有关[14]。EBV感染已被证明与多种淋巴和上皮恶性肿瘤密切相关,尤其是NPC[15]。研究[9]显示,NPC组织标本检测发现标本中miR-34c下调,miR-34c可能与NPC的发展有关[9]。本研究结果显示,EBV下调miR-34c促进NPC增殖、迁移及侵袭,miR-34c可能是治疗转移性NPC的潜在治疗靶点。
为了确认EBV下调miR-34c对促进NPC增殖转移的作用及机制研究,研究了其对C666-1细胞的细胞活力、迁移和侵袭的影响。结果显示,EBV下调miR-34c与NPC转移的关系,表明EBV下调miR-34c通过促进NPC细胞的转移促进了NPC的发展。异常增殖在癌变中起重要作用,NPC的主要生物学特征是局部侵袭和远处转移[16]。迁移通常是指体内任何定向的细胞运动,癌的侵袭意味着细胞穿透组织屏障[17]。癌细胞的迁移和侵袭允许从原发肿瘤部位脱离和癌症在组织内扩散[18]。在本研究中,发现在C666-1细胞中miR-34c的过表达抑制了其活力、迁移和侵袭,也降低了细胞迁移和侵袭相关蛋白的表达水平。而EBV下调miR-34c促进了细胞的活力和迁移和侵袭,但也促进了细胞迁移和侵袭相关蛋白的表达水平。
Vimentin是肿瘤细胞迁移和侵袭过程中的一种细胞黏附分子,促进NPC细胞迁移和侵袭[19]。研究[20-21]显示,Snail的高表达表明NPC具有高转移潜力,MMP2的抑制与NPC细胞转移的抑制有关。NPC肿瘤细胞中MMP3的分泌可刺激肿瘤细胞迁移[22]。本研究显示,EBV下调miR-34c促进了Vimentin、Snail、MMP2和MMP3的表达,促进细胞迁移和侵袭,表明EBV下调miR-34c对NPC细胞迁移和侵袭的影响可能与迁移相关因子(Vimentin和Snail)和侵袭相关因子(MMP2和MMP3)有关,EBV下调miR-34c在调节NPC细胞的迁移和侵袭中起关键作用。
有证据[23]表明,Erk1/2信号通路对细胞转移以及MMP的上调至关重要。研究[24]显示,Erk1/2信号通路参与了EBV-miR-BART8-3p诱导的NPC转移过程,EBV-miR-BART8-3p 的上调通过激活Erk1/2信号通路诱导 NPC转移,而 EBV-miR-BART8-3p的下调具有相反的效果。此外,也有研究[25]表明EBV-miR-BART1激活MAPK-ERK1/2通路,激活β-catenin/Snail信号,促进NPC转移。本研究结果显示,Erk1/2信号通路与NPC细胞的迁移密切相关,Erk1/2信号通路传导有助于EBV下调miR-34c诱导的NPC迁移。
综上所述,miR-34c在EBV阳性 NPC细胞标本中下调,EBV下调miR-34c可增强NPC细胞增殖、侵袭和迁移能力及激活Erk1/2信号通路。

