鸡传染性法氏囊病病毒VP5 的原核表达、多抗制备及初步应用
韩金泽,牛鑫鑫,王国栋,葛成菲,张玉龙,黄萌萌,许萌萌,于航博,刘润杭,韩京哲,吴子文,于晓雪,高玉龙,李留安,祁小乐
(1.天津农学院动物科学与动物医学学院,天津市农业动物繁育与健康养殖重点实验室,天津300392;2. 中国农业科学院哈尔滨兽医研究所,动物疫病防控全国重点实验室禽免疫抑制病创新团队,黑龙江哈尔滨 150069;3. 中国农业科学院哈尔滨兽医研究所,世界动物卫生组织传染性法氏囊病参考实验室,黑龙江哈尔滨 150069)
传染性法氏囊病(infectious bursal disease,IBD)是由传染性法氏囊病病毒(infectious bursal disease virus,IBDV)引起的一种主要危害雏鸡的急性传染病。IBDV 的主要靶器官是鸡的中枢免疫器官法氏囊,可导致法氏囊的急性损伤和B淋巴细胞的坏死、崩解,进而导致严重的免疫抑制,给养禽业造成了巨大经济损失[1-2]。IBDV 属于双RNA 病毒科(Birnaviridae)禽双RNA 病毒属(Avibirnavirus),其基因组由A 和B 两个双股RNA 节段组成,其中A 节段编码VP2、VP3、VP4、VP5 蛋白,B 节段编码VPl 蛋白[3-4]。
在IBDV 编码的5 个蛋白中,VP5 是最后一个被鉴定的蛋白,它是由病毒基因组A 节段的一个独立读码框编码的,分子质量大小约17 kDa,属于病毒的非结构蛋白[5]。VP5 蛋白也是一个毒力因子,其在病毒复制早期抑制细胞凋亡,而在病毒复制晚期促进细胞凋亡[6-8]。研究[9-12]还发现,VP5 是病毒复制非必需蛋白,因此利用反向遗传操作技术可拯救出VP5基因缺失的IBDV。作为一个多功能蛋白,VP5 的更多生物学功能尚待鉴定,其分子机制尚待挖掘。本试验利用原核表达系统表达了IBDV 超强毒株(vvIBDV)中的优势流行毒株VP5 蛋白,用镍柱纯化了呈可溶性表达形态的重组VP5 蛋白,用BALB/c 小鼠制备了鼠源VP5 多抗,并进行了初步应用,为深入探究VP5 蛋白的结构和功能提供了物质基础。
1 材料与方法
1.1 材料
1.1.1 毒株、载体和细胞 IBDV rHLJ0504-HT株及其VP5基因缺失株rHLJ0504-HT-KOVP5,由中国农科院哈尔滨兽医研究所禽免疫抑制病团队(简称本实验室)制备。原核表达载体pCold-I、真核表达载体pCAGGS、重组真核表达质粒pCAGGS-HLJ0504-VP5(将IBDVVP5基因克隆入pCAGGS 中)、DF-1 细胞,均由本实验室保存。E.coliBL21(DE3)工程菌,购自于宝生物工程(大连)有限公司(TaKaRa)。
1.1.2 主要试剂 限制性内切酶EcoRI 和XhoI,为TaKaRa 公司产品;His 标签蛋白纯化树脂Ni琼脂糖凝胶,购自Cytiva 公司;抗β-actin 标签的抗体、HRP 标记的兔抗鼠IgG、FITC 标记的山羊抗兔IgG 抗体、弗氏佐剂、脱脂奶粉、IPTG,为Sigma 公司产品;山羊抗小鼠IgG(IRDye800CW标记),为LiCor Bio-Sciences 公司产品;His 标签抗体为上海仝元生物科技有限公司产品;辣根过氧化氢酶DAB 显色试剂盒(超敏型)为生工生物工程(上海)股份有限公司产品;PageRuler 预染蛋白Marker 26616,为Thermo Scientific 公司产品;DNA Marker(DL 2000)、DNA 聚合酶Mix、同源重组试剂盒,为诺唯赞生物科技股份有限公司产品;IBDV VP1 蛋白单克隆抗体,由本实验室制备和保存;胶回收试剂盒,为Omega 公司产品;质粒中提试剂盒,为 QIAGEN 公司产品;转染试剂TransIT-X2®Dynamic Delivery System,为Mirusbio公司产品;考马斯亮蓝染色液,为索来宝公司产品。
1.1.3 主要仪器 生物安全柜、台式低温高速离心机,为Thermo Scientific 公司产品;PCR 仪,为TaKaRa 公司产品;组织研磨仪,为Retsch 公司产品;超微量分光光度计,为Implen 公司产品;凝胶电泳仪,为北京六一仪器厂产品;Odyssey 红外扫描仪,为Licor 公司产品;ELISA 酶标板,为Costar 公司产品;全自动酶标仪,为BioTek 公司产品;超声细胞破碎仪,为SONICS 公司产品。
1.1.4 实验动物 6 周龄雌性BALB/c 小鼠,购自辽宁长生生物技术有限公司。
1.2 方法
1.2.1VP5基因扩增和原核表达载体构建参 考IBDV HLJ0504 株 基 因 组(GenBank 号GQ451330),设计VP5基因特异性引物(上游引物pCold 1-VP5-F:5'-atggagctcggtaccctcgagGTTAGTAGAGATCAGACAAACGATCGC-3';下游引物pCold 1-VP5-R:5'-caggtcgacaagcttgaattcTCACTCAGGCTTCCTTGGAAGG-3'),送睿博兴科生物技术(哈尔滨)有限公司合成。以rHLJ0504-HT株为模板,通过RT-PCR 进行VP5基因扩增。按常规方法提取病毒RNA 并反转录为cDNA,然后进行PCR 扩增。PCR 反应体系:DNA 聚合酶Mix 25 μL、cDNA 1 μL、上游引物2 μL、下游引物2 μL、ddH2O 20 μL。反应条件:95 ℃ 2 min;95 ℃20 s,58 ℃ 30 s,72 ℃ 1 min,30 个循环;72 ℃5 min。PCR 产物经琼脂糖凝胶电泳鉴定后,按凝胶回收试剂盒说明书进行目的片段回收。以EcoRI和XhoI 为酶切位点线性化pCold I 载体,将胶回收的目的片段与pCold I 空载体,在37 ℃利用同源同组试剂盒进行同源重组。将同源重组产物转化感受态细胞大肠杆菌BL21(DE3),12 h 后从LB 固体培养基(氨苄抗性)上挑取单克隆菌落,通过菌液PCR 筛选阳性克隆,并将阳性克隆送睿博兴科生物技术有限公司进行测序。将鉴定正确的重组原核表达质粒命名为pCold-HLJ-VP5。
1.2.2 VP5 蛋白诱导表达 首先将重组质粒pCold-HLJ-VP5 转化工程菌E.coliBL21(DE3),12 h 后挑单菌落接种到5 mL 氨苄抗性的LB 培养液中,于200 r/min 37 ℃过夜培养;次日,将过夜培养的菌种以1:100 接种于1 L 氨苄抗性的LB 中,200 r/min、37 ℃振荡培养;待OD 值达到0.4~0.6时,加终浓度为0.2 mmol/L 的IPTG 进行诱导,150 r/min 20 ℃振荡培养,22 h 后、10 000g/min 室温离心10 min 收集菌体,并用超声细胞破碎仪破碎菌体,12 000g/min 室温离心10 min。离心后分离回收沉淀和上清,进行聚丙烯凝胶电泳(SDS-PAGE)。
1.2.3 VP5 蛋白纯化和鉴定 将诱导表达后的菌体用超声细胞破碎仪进行裂解,用His 标签蛋白纯化树脂Ni 琼脂糖凝胶作为填料,纯化目的蛋白。通过考马斯亮蓝染色法检验洗脱液洗脱效率,选用50、100、150、200、250、300 mmol/L 咪唑进行蛋白洗脱的最佳条件摸索。利用摸索得到的最佳洗脱条件洗脱目的蛋白,最后使用超微量分光光度计检测纯化后蛋白浓度。将纯化的目的蛋白进行SDS-PAGE 电泳鉴定,然后用His 标签抗体进行Western Blot 鉴定。Western Blot 鉴定过程:将转印有VP5 的硝酸纤维素膜(NC 膜)用5%的脱脂乳于4 ℃封闭过夜,用PBST 缓冲液洗涤3 次,5 min/次;加入按1:1 000 稀释的His 标签抗体,室温孵育1.5 h;用PBST 洗涤3 次,5 min/次;加入1:20 000 稀释的抗鼠荧光二抗,于室温孵育50 min;用PBST 洗涤3 次,5 min/ 次;最后在Odyssey 红外扫描仪下鉴定表达情况。
1.2.4 VP5 鼠源多抗制备 将纯化的重组VP5 蛋白与等体积弗氏佐剂混匀乳化(首次免疫用弗氏完全佐剂,此后均用弗氏不完全佐剂)。首次免疫以200 μg/只的剂量通过腹腔注射方式免疫小鼠,间隔14 d 进行下一次免疫,共免疫5 次。每次免疫后7 d,使用间接ELISA 方法测定血清抗体效价,在效价达到标准后采集小鼠血液并分离血清,作为VP5 蛋白的多克隆抗体(多抗)血清。间接ELISA 检测过程:用碳酸盐包被液稀释VP5 蛋白至质量浓度1.3 μg/mL 时包被ELISA 板,4 ℃过夜孵育,PBST 洗板5 次;每孔加入200 μL 5%脱脂乳封闭液,37 ℃下孵育1 h,PBST 洗板5 次;每孔加入100 μL 稀释的待检血清样品,37 ℃下孵育30 min,PBST 洗板5 次;每孔加入100 μL 稀释的HRP-兔抗鸡抗体IgG,37 ℃下孵育30 min,PBST 洗板5 次;每孔加入100 μL TMB 底物显色液,作用15 min;每孔加入100 μL 终止液终止反应,用全自动酶标仪测定吸光值OD450。
1.2.5 VP5 多抗鉴定
1.2.5.1 VP5 多抗的间接免疫荧光法(IFA)检测 将DF-1 细胞培养于12 孔细胞培养板中,当细胞汇合度达到70%时,在TransIT-X2 转染试剂介导下分别转染真核表达质粒pCAGGS-HLJ0504-VP5 和空质粒pCAGGS,均1 μg/孔。将细胞置于37 ℃、5% CO2培养箱内继续培养30 h;弃掉培养液,用PBS 洗涤3 次;加入4%的多聚甲醛,于4 ℃固定细胞30 min;PBS 洗涤3 次后用5%的脱脂乳于37 ℃温箱封闭1 h;将1:200 稀释的VP5多抗加入细胞单层,于37 ℃湿盒孵育1 h;PBS 洗涤3 次,加入1:200 稀释的FITC 标记的山羊抗兔IgG 抗体,37 ℃孵育1 h;PBS 洗涤3 次,于倒置荧光显微镜下观察。
1.2.5.2 VP5 多抗Western Blot 鉴定 将重组蛋白VP5 进行SDS-PAGE 后,转印至NC 膜上,用VP5 多抗通过Western Blot 进行检测。
1.2.6 VP5 多抗初步应用 通过IFA 和Western Blot 检测,用VP5 多抗对rHLJ0504-HT 株及其VP5基因缺失株rHLJ0504-HT-KOVP5 进行鉴别检测。
1.2.6.1 IFA 检测 将r H L J 0 5 0 4-H T 株和rHLJ0504-HT-KOVP5 株分别感染饲养于12 孔板的70%汇合度的DF-1 细胞,同时设空白对照细胞。病毒感染后24 h,用VP5 多抗进行IFA 检测。
1.2.6.2 Western Blot 检测 将1.2.6.1 收集的细胞样品用VP5 多抗进行Western Blot 检测。同时,采用β-actin 抗体、IBDV VP1 单抗对样品进行Western Blot 检测。
2 结果
2.1 VP5 基因扩增及原核表达质粒构建
通过RT-PCR 扩增获得了IBDV HLJ054 株的VP5基因,扩增片段长435 bp(图1)。测序结果显示,克隆有IBDV HLJ0504 株VP5基因的重组原核表达质粒pCold-HLJ-VP5 构建正确。
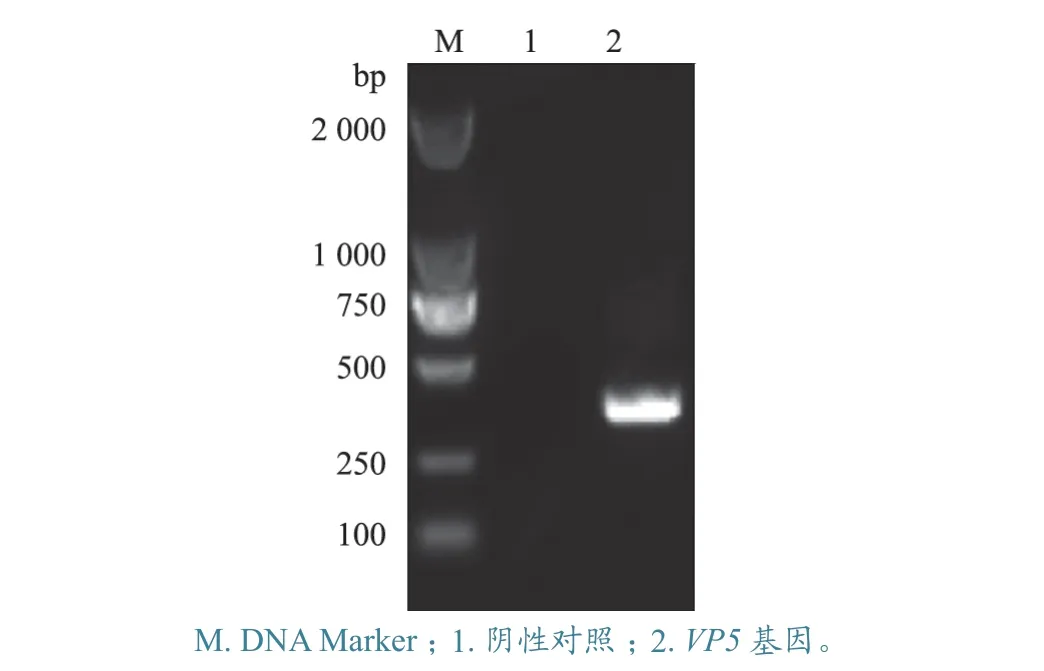
图1 IBDV VP5 基因PCR 扩增结果
2.2 VP5 重组蛋白表达
SDS-PAGE 鉴定结果显示,VP5 蛋白主要以上清形式可溶性表达(分子质量约17 kDa),在菌体沉淀(包涵体形式)中量较少(图2)。
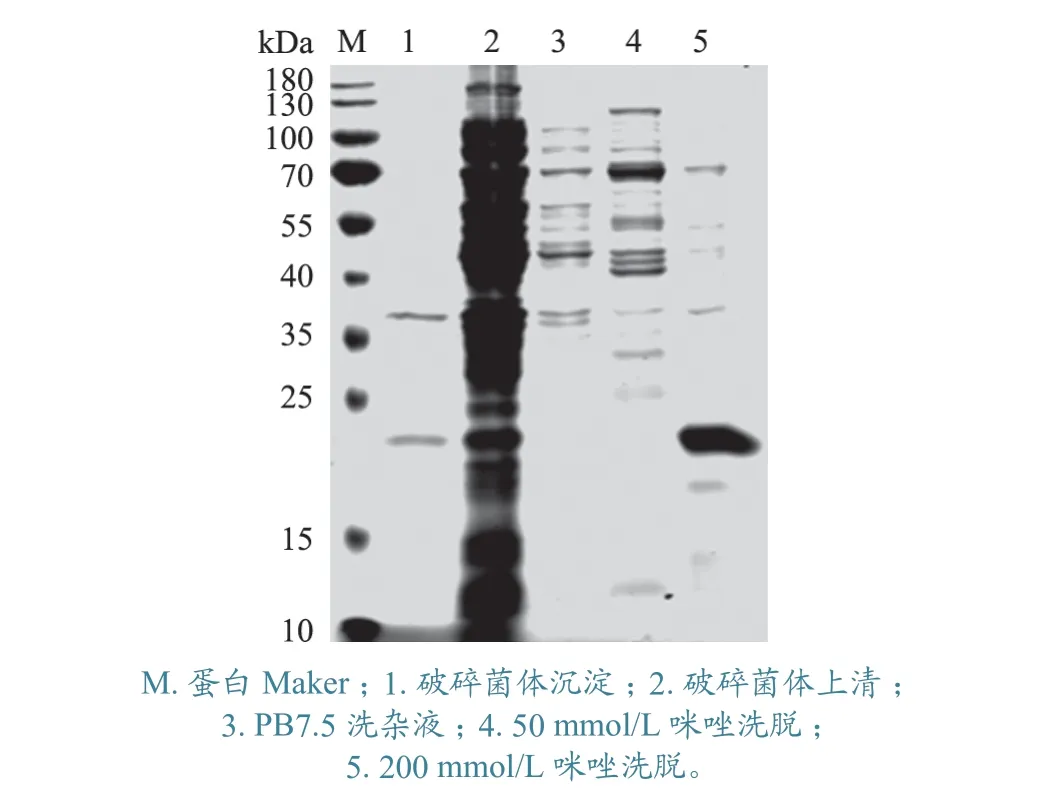
图2 重组VP5 蛋白的表达与纯化结果
2.3 VP5 重组蛋白纯化
SDS-PAGE 鉴定结果显示,表达的重组VP5蛋白在200 mmol/L 咪唑洗脱条件下获得了良好纯化(图2)。经测定,该蛋白的质量浓度为850 ng/μL。
2.4 VP5 重组蛋白鉴定
对纯化后的表达蛋白进行Western Blot 鉴定。结果(图3)显示,在约17 kDa 处出现清晰的特异条带,说明所表达和纯化的VP5 重组蛋白与His标签抗体可以发生特异性反应。
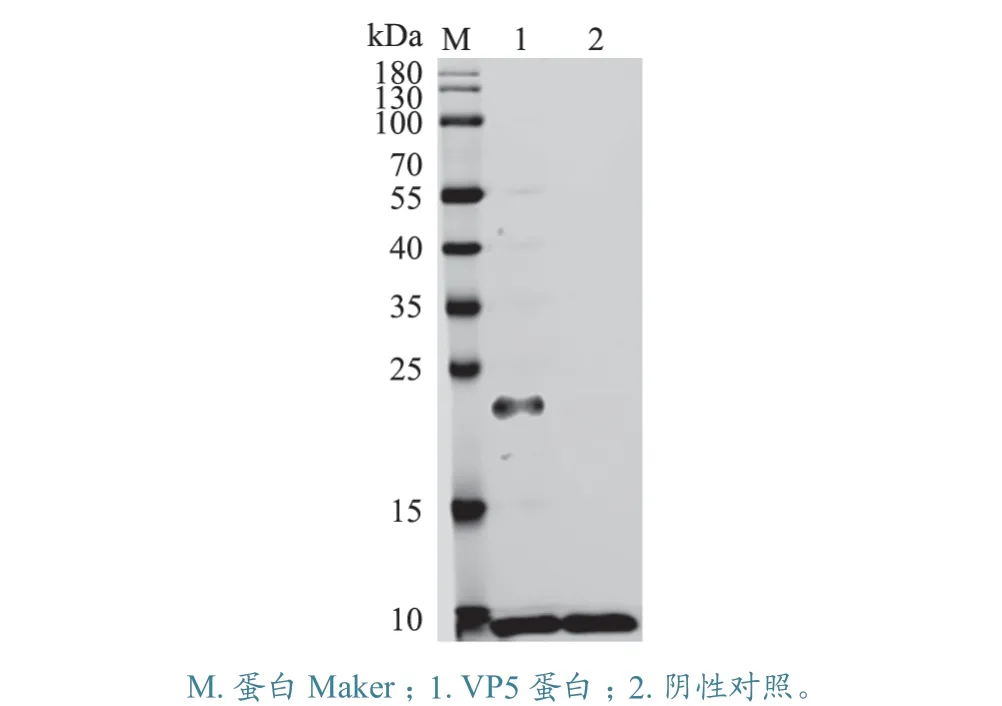
图3 His 标签抗体介导的重组VP5 蛋白Western Blot 鉴定结果
2.5 VP5 多抗制备
用包被VP5 的ELISA 检测VP5 多抗效价,将多抗样品孔OD450与阴性对照孔比值(P/N)>2.1 时的多抗样品最高稀释度作为VP5 多抗效价。结果(图4)显示,VP5 多抗效价可达1:64 000。
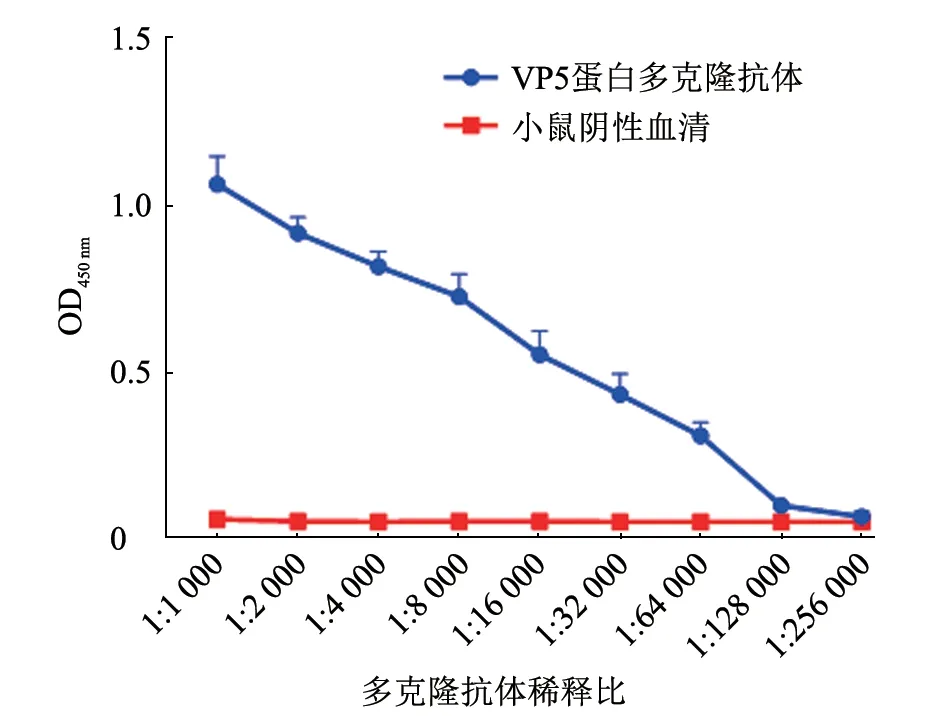
图4 免疫小鼠血清中VP5 多抗效价ELISA 测定结果
2.6 VP5 多抗鉴定
2.6.1 IFA 检测 检测结果(图5)显示,重组真核表达载体pCAGGS-HLJ0504-VP5 转染组的DF-1细胞呈现特异性的红色荧光,而pCAGGS 空载体对照组细胞没有荧光,说明所制备的VP5 多抗能够通过IFA 特异性识别IBDV 的VP5 蛋白。
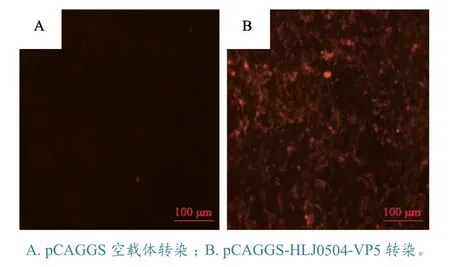
图5 IBDV VP5 多抗的IFA 鉴定结果
2.6.2 Western Blot 检测 检测结果(图6)显示,重组真核表达载体pCAGGS-HLJ0504-VP5 转染组可见约17 kDa 的条带,而pCAGGS 空载体对照组无该条带,且两组样品均可检测到细胞β-actin,说明所制备的VP5 多抗能够通过Western Blot 特异性识别IBDV 的VP5 蛋白。
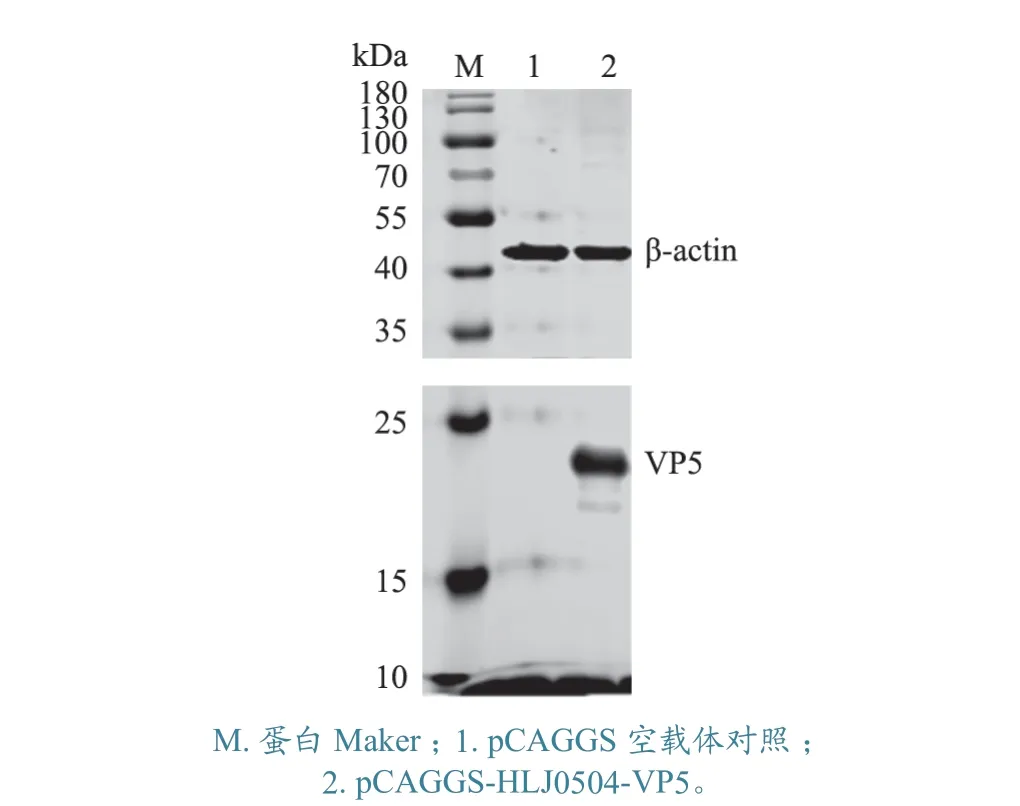
图6 IBDV VP5 多抗的Western Blot 鉴定结果
2.7 VP5 多抗初步应用
2.7.1 IFA 检测 对分别感染rHLJ0504-HT 株和rHLJ0504-HT-KOVP5 株的DF-1 细胞用VP5 多抗进行IFA 检测。结果(图7)显示,rHLJ0504-HT感染组呈现特异性的红色荧光,而不表达VP5 的rHLJ0504-HT-KOVP5 感染组以及空白细胞对照组没有荧光,说明本研究所制备的VP5 多抗可用于通过IFA 鉴别IBDV 及其VP5基因缺失毒株。
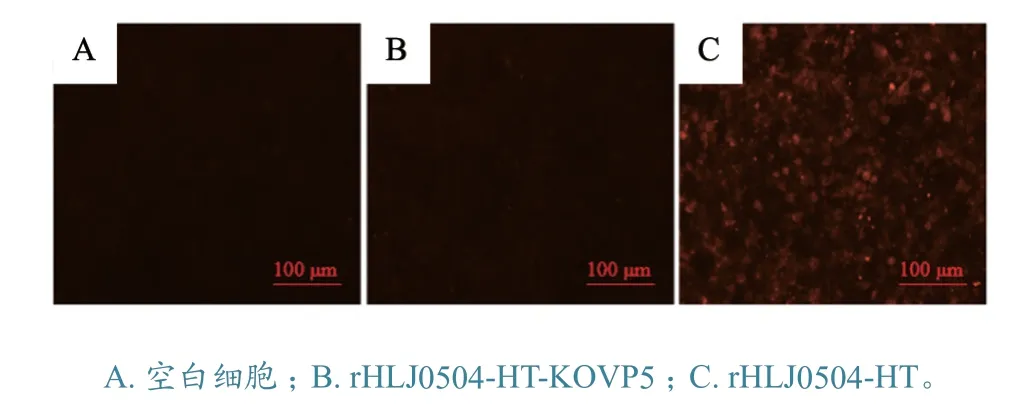
图7 VP5 多抗对IBDV 不同毒株的IFA 检测结果
2.7.2 Western Blot 检测 对分别感染rHLJ0504-HT 株和rHLJ0504-HT-KOVP5 株的DF-1 细胞进行Western Blot 检测。如图8 所示:基于β-actin 抗体的Western Blot 结果显示,2 个IBDV 感染组和空白细胞对照组均能检测到约43 kDa 的β-actin,说明3 个组均有细胞样品。基于IBDV VP1 单抗的Western Blot 结果显示,2 个IBDV 感染组均能检测到约97 kDa 的VP1 蛋白,说明2 个感染组均成功感染了IBDV。基于VP5 多抗的Western Blot 结果显示,rHLJ0504-HT 感染组可检测到约17 kDa 的VP5 条带,而不表达VP5 的rHLJ0504-HT-KOVP5 感染组以及空白细胞对照组无VP5 条带,说明本研究所制备的VP5 多抗可用于通过Western Blot 鉴别IBDV 及其VP5基因缺失毒株。
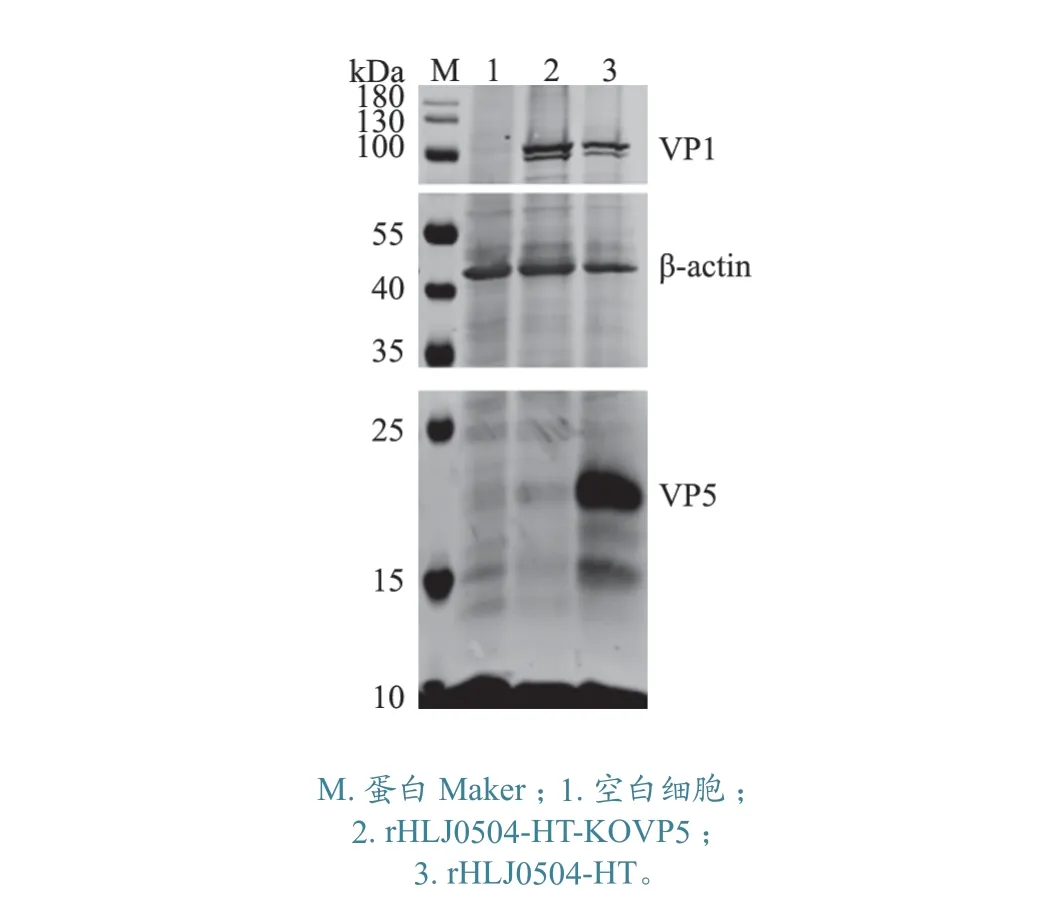
图8 VP5 多抗对IBDV 不同毒株的Western Blot 检测结果
3 讨论
IBDV VP5 虽然是一个非结构蛋白,但它在IBDV 的生命过程中发挥着重要作用,其分子机制尚需要进一步被揭示。IBDV 不同毒力毒株由于使用不同的起始密码子而编码出的VP5 蛋白长度不同,这是否影响病毒的生物学功能,也需要更深入地探索。另外,VP5基因是IBDV 唯一可以缺失的基因,因而IBDV 反向遗传研究系统的建立也使得IBDVVP5基因缺失毒株的拯救成为可能[9,13]。与亲本毒株相比,VP5缺失毒株虽然复制有延迟,但其致病力也显著下降,所以非结构蛋白VP5 的缺失是IBDV 新型疫苗研究的一个重要思路[9-12]。VP5缺失毒株不会诱导机体产生VP5 抗体,如果这种疫苗与VP5 抗体ELISA 检测试剂盒相配合,将能够实现疫苗免疫与野毒感染的鉴别检测,具有重要意义。
正是基于以上考虑,本试验开展了vvIBDV 优势流行毒株VP5 蛋白表达及VP5 多抗制备的研究。本研究利用大肠杆菌BL21 表达系统表达并纯化了融合了His 标签的vvIBDV 优势流行毒株的VP5蛋白。本研究最初曾尝试使用pGEX 表达系统表达IBDV VP5 蛋白,但获得的可溶性VP5 蛋白量很低。后经过摸索,最终应用pCold 表达系统成功表达了VP5 蛋白,试验过程中对诱导温度、诱导剂浓度、诱导时间等表达条件对重组蛋白表达量的影响进行了探索,发现采用20 ℃、IPTG 终浓度为1 mmol/L 的条件诱导22 h 后,所获得的蛋白表达量最高。对菌体超声波裂解物的SDS-PAGE 分析表明,VP5蛋白大部分表达于超声破碎的菌体上清,在菌体沉淀中表达量极低,说明重组VP5 蛋白大部分以可溶性状态表达,仅有少量蛋白以包涵体形式存在。包涵体是外源基因在原核细胞中表达时形成的一种由膜包裹的高密度、不溶性蛋白质颗粒。当蛋白表达速度过快时,没有足够的时间进行折叠,二硫键不能正确配对,从而导致过多的蛋白间非特异性结合,进而造成蛋白质无法达到足够的溶解度,而以包涵体形式存在。包涵体蛋白不可溶,不利于后期的蛋白纯化和应用。重组蛋白的可溶性表达有利于蛋白天然构象的维持,而且也利于后续的纯化和高通量制备。应用镍柱,使用50 mmol/L 咪唑作为洗杂液最大程度洗脱杂质,再经200 mmol/L咪唑洗脱的重组VP5 蛋白纯度可达90%以上。用BALB/c 小鼠制备的鼠源VP5 多抗的ELISA 效价可达1:64 000,说明本试验应用pCold-I 表达系统表达的重组VP5 蛋白具有良好的免疫原性,免疫BALB/c 小鼠后产生了高滴度抗体。IFA 和Western Blot 结果显示,本研究制备的VP5 多抗不仅可特异性地识别VP5 蛋白,而且可对IBDV 及其VP5缺失毒株进行鉴别检测。
综上,本研究建立了一种基于原核表达系统的IBDV VP5 蛋白可溶性表达和制备的方法,并制备了特异性良好的鼠源VP5 多抗;制备的VP5 蛋白可用于进一步研制IBDV VP5 抗体ELISA 检测方法;制备的VP5 多抗为IBDV 基因功能和新型疫苗研究提供了物质基础。

