氧化钙塑料试剂瓶膨胀破裂原因的探究实验
王燕 凌一洲
江苏省教育科学十四五规划课题“高中化学循证教学实践研究”(编号:D/2021/02/113)研究成果。
摘要: 对氧化钙塑料试剂瓶膨胀破裂的原因开展实验探究。实验一在量筒中加入无水乙醇分别浸没氧化钙和氢氧化钙两种固体粉末,可测得粉末的体积,从而计算它们的真密度。结果表明,氧化钙吸水变成氢氧化钙后,真密度从3.45g/cm3变为2.33g/cm3,质量是原来的1.32倍,相当于真体积膨胀至原体积的1.95倍。实验二让10cm3氧化钙粉末充分吸收水蒸气3天,再放回到量筒中重新测量体积,发现粉末堆积体积增大至22cm3。因此,试剂瓶破裂的原因是氧化钙受潮吸水后体积大幅膨胀。
关键词: 氧化钙; 氢氧化钙; 真密度; 视密度; 实验探究
文章编号: 10056629(2024)04008004
中图分类号: G633.8
文献标识码: B
人教版九年级《化学》教材上册有一道习题:“有位化学教师取用生石灰时,发现装满生石灰的塑料试剂瓶已经膨胀破裂。你能解释这是为什么吗?[1]”教师参考用书提供的参考答案是:“生石灰在保存过程中吸收空气中的水,发生反应而放热膨胀,导致塑料试剂瓶膨胀破裂。”但是,无论试剂瓶密封或不密封的情况,参考用书的解释从理论上都是站不住脚的[2]:如果试剂瓶不密封,虽然允许空气中的水蒸气进入,但瓶内气体遇热膨胀后便也能够飘散到瓶外,不至于使试剂瓶内部压强过大;如果试剂瓶密封,瓶内的水蒸气含量非常少,不足以反应后产生大量的热,增大气体压强使试剂瓶撑破。因此,本文设计探究实验,带学生探究氧化钙塑料试剂瓶膨胀破裂的真正原因。
1 实验原理
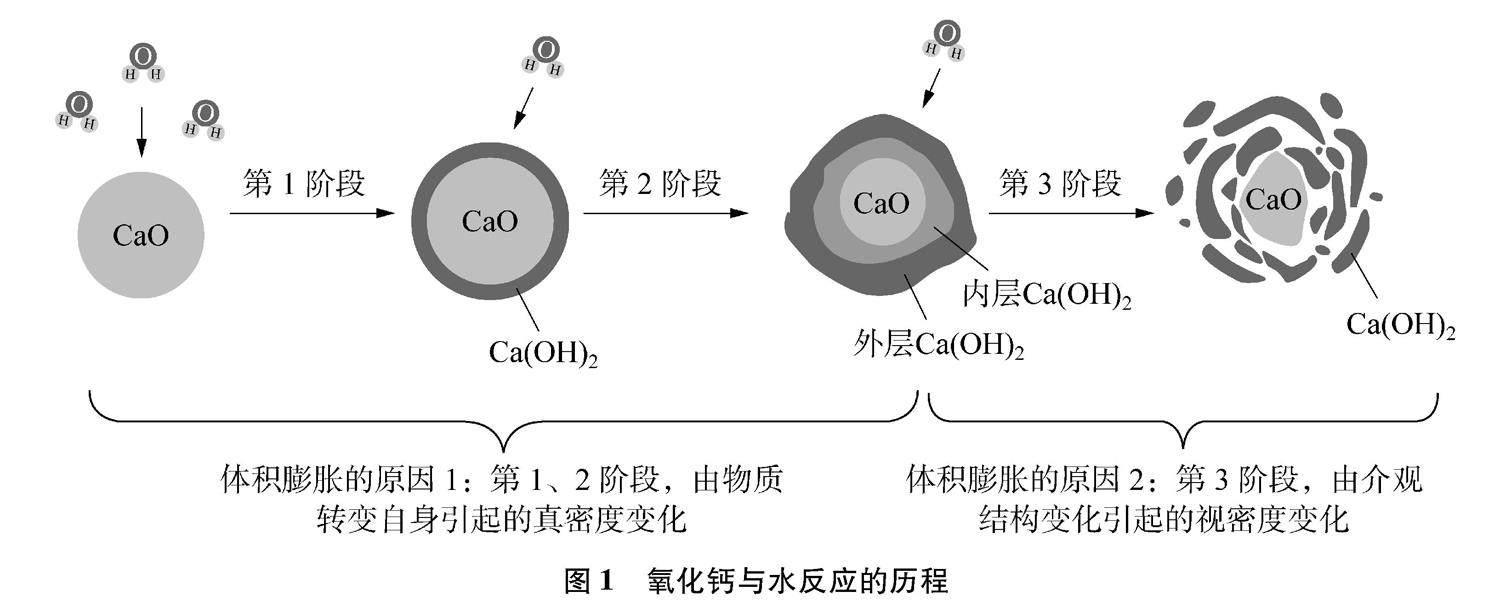
1.1 氧化钙与水反应的历程
氧化钙与水蒸气生成氢氧化钙的反应,方程式为CaO(s)+H2O(g)Ca(OH)2(s),反应过程可以分为3个阶段(见图1)[3]。第1阶段,氧化钙颗粒的外表面与水蒸气接触,迅速在外表面生成致密的氢氧化钙
薄膜,这一阶段反应速率较快。第2阶段,由于受到氢氧化钙薄膜阻隔,外层水蒸气难以与颗粒内核的氧化钙直接反应,而是先溶解“外层Ca(OH)2”形成过饱和溶液,然后通过渗透、扩散不断与内层氧化钙反应形成“内层Ca(OH)2”,此时外层的过饱和溶液会重结晶为固体的“外层Ca(OH)2”。第3阶段,随着“外层Ca(OH)2”厚度的增加,Ca(OH)2会受内部应力和外部扰动,碎裂为鳞片状,变得疏松。
1.2 固体粉末密度的两种表征方式
由于固体粉末结构的特殊性,其密度可用真密度(true density)和视密度(apparent density)等不同方式表征。真密度是指材料在绝对密实的状态下的密度,即去除颗粒间空隙后的密度;视密度又名视相对密度,是指粉料自由填充时的密度,即包括颗粒间空隙的密度[4]。两者的计算公式如下:
ρ真=m/V真
ρ視=m/(V真+V空)
式中:ρ真——真密度,ρ视——视密度,V真——粉末的真体积,V空——空隙体积。
在本研究中,氧化钙转变为氢氧化钙时,密度变化源自于两个方面:(1)物质转变自身;(2)介观结构变化。对于前者,为排除材料孔隙对密度变化的影响,将采用真密度作为比较依据;而对于后者,介观孔隙结构在密度变化过程中扮演着重要角色,因此适合采取视密度作为表征依据[5]。
基于上述讨论可总结出氧化钙塑料试剂瓶膨胀破裂的真正原因:(1)在第1、2阶段,氧化钙变成氢氧化钙,真密度变小,体积膨胀;(2)在第3阶段,氢氧化钙由球壳形状变成鳞片形状,微观层面颗粒之间的空隙增大,宏观层面变蓬松,视密度变小,体积进一步膨胀。
2 解释真密度减小的实验
本实验旨在测量和比较CaO、 Ca(OH)2固体粉末的真密度差异。学生已经在物理课上学习了多种测量固体密度的方法,基本计算公式为:密度ρ=质量m/体积V,质量m可以用电子秤称量,而测量CaO、 Ca(OH)2固体粉末的体积V对学生而言是一个新的问题。测量V的常用方法是把固体浸入量筒的水中,读出浸入前体积V1和浸入后体积V2,其差值即为固体体积:V固体=V2-V1。但是,CaO一旦浸入水中,就会与水发生剧烈反应。因此,学生想到可以用一种不与CaO反应的液体——无水乙醇来浸没固体粉末。
2.1 实验用品
试剂:氧化钙(分析纯)、氢氧化钙(分析纯)、无水乙醇(分析纯)
仪器:分度值0.01g的电子秤、50mL量筒、漏斗、药匙、玻璃棒、滴管
2.2 实验步骤与结果
(1) 在量筒中倒入接近15mL的无水乙醇,然后用滴管逐滴滴加至15.0mL刻度线;
(2) 用电子秤准确称量10.00g CaO固体粉末,通过漏斗倒入量筒中搅拌,并用药匙把粘在量筒内壁的粉末刮落,读出此时量筒示数V2;
(3) 计算V氧化钙=V2-15.0mL, ρ氧化钙=10.00g/V氧化钙;
(4) 把称量的10.00g CaO粉末换成等质量的Ca(OH)2粉末,重复上述步骤,测算得到V氢氧化钙和ρ氢氧化钙。
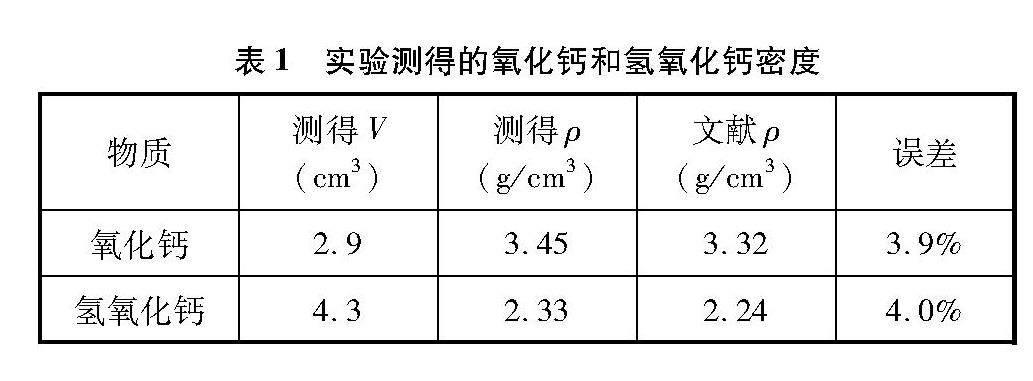
(5) 实验测得结果如表1所示。ρ氧化钙为3.45g/cm3,与文献数据相比偏大3.9%;ρ氢氧化钙为2.33g/cm3,与文献数据相比偏大4.0%。结果显示ρ氢氧化钙是ρ氧化钙的0.68倍,即等质量的氢氧化钙体积是氧化钙的1.48倍。在反应过程中,氢氧化钙质量还会比原先的氧化钙增大74/56=1.32倍(因为结合了水),因此真正膨胀的体积为1.48×1.32=1.95倍,这是使试剂瓶破裂的原因之一。
2.3 几点说明
(1) 分析纯的无水乙醇中只含有极少量(0.5%)的水,可以忽略不计。
(2) 浸液的选取需要满足三个条件:①不与粉体发生化学反应;②能够浸润粉体;③表面张力尽可能小,从而尽可能完整地填充粉体中的孔隙而不形成气泡。除无水乙醇外,还可以用丙醇、丁醇、液态烷、液态酯等。
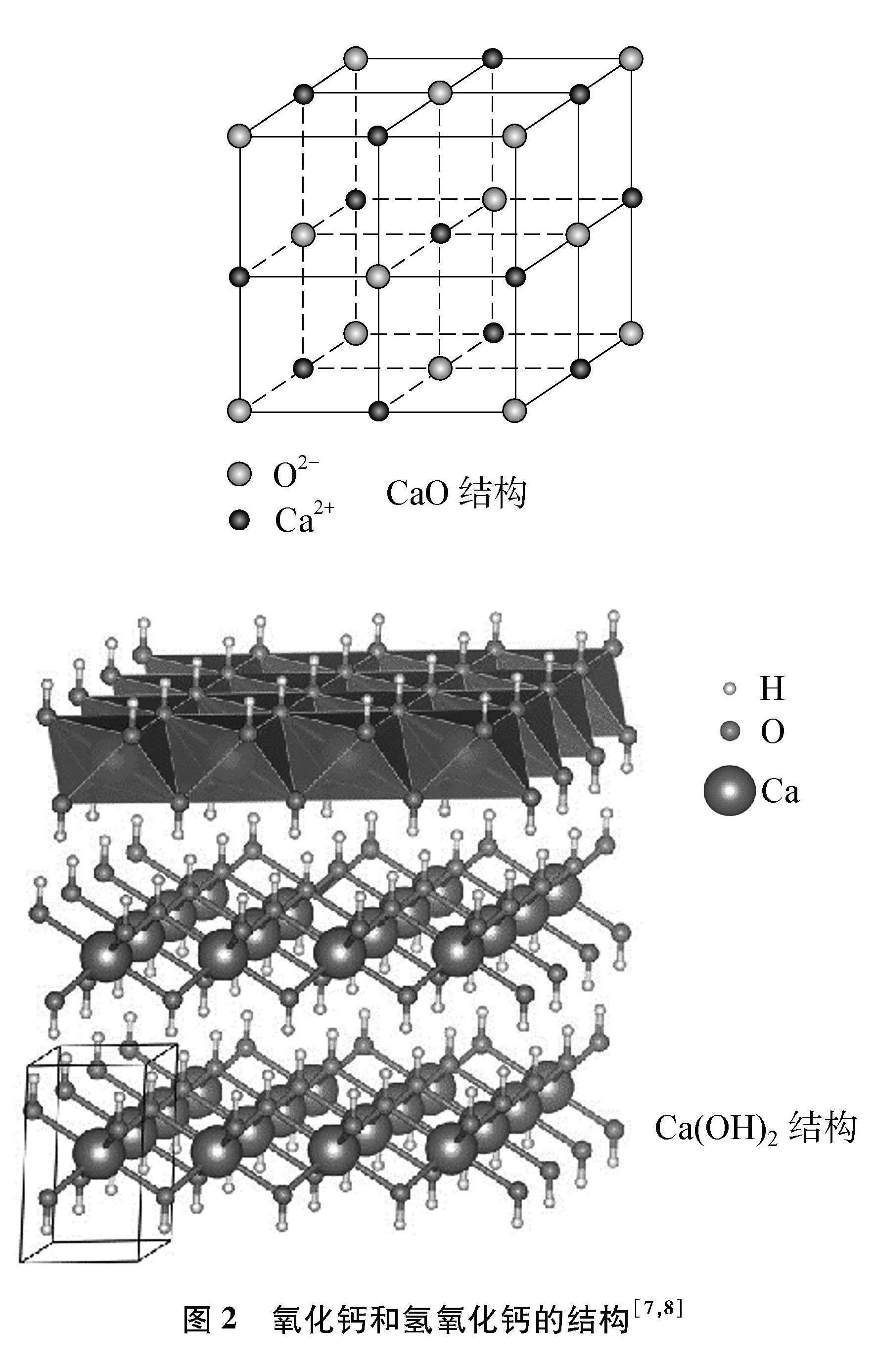
(3) 对于真密度的变化,从晶体结构层面来看(见图2),CaO属NaCl型结构,Ca2+与O2-作面心立方堆积,二者以离子键相结合;而在Ca(OH)2中,OH-与Ca2+形成层状结构,层内通过离子键相结合,而层间主要通过氢键相结合[6],作用力相较于CaO小得多,层间距也使得层状的Ca(OH)2的密度显著小于CaO。
3 解释视密度减小的实验
实际上,试剂瓶中的氢氧化钙密度比理想的真密度更小,因为颗粒之间存在空隙,用视密度来计算更为合适。本实验旨在让学生直观感受到两种密度的差异,认识到视密度更适合试剂瓶中的实际情况。
3.1 实验用品
试剂:氧化钙(分析纯)、无水硫酸铜、蒸馏水
仪器:分度值0.01g的电子秤、50mL量筒、药匙、表面皿、海绵、塑料尺、试管、酒精灯、干燥管
3.2 实验步骤与结果
(1) 用药匙把氧化钙粉末放入50mL量筒中,直到10mL刻度处(V氧化钙=10cm3),注意在此过程中轻轻敲击、震动量筒,使粉末表面平整。
(2) 把10cm3氧化鈣粉末倒入表面皿中,均匀铺开。
(3) 在表面皿上方架2把塑料尺,在塑料尺上方覆盖一块湿润的海绵(注意海绵不能太湿,不要让液态水滴下),静置3天。此时可以看到,随着氧化钙与水蒸气反应生成氢氧化钙,部分粉末发生了结块成团(见图3)。
(4) 把反应后的粉末放回量筒,发现体积超过22mL,说明固体体积膨胀超过了真密度的比例(1.95倍),而实际情况应采用视密度。这是因为氢氧化钙的介观形貌发生了变化,形成鳞片状孔隙结构(已有研究的SEM图像见图4),使得材料体积在原有基础上进一步增加。
(5) 用药匙取少量久置后的粉末放入试管中,用酒精灯加热,把气体通入盛有无水硫酸铜的干燥管,观察到白色粉末变蓝,证明粉末久置后转变为氢氧化钙。
3.3 几点说明
(1) 在把粉末加入量筒时,如有粉末粘在量筒内壁,可用药匙将其刮落。实验完毕的量筒可用稀盐酸清洗。
(2) 若要直观演示视密度比真密度小,教师可以往氢氧化钙粉末中滴加无水乙醇,可以发现固体粉末出现大幅塌陷。然后引导学生联想生活场景:在沙子中倒水,体积不仅没有增大,反而“凹陷”了下去。这些现象说明,视密度囊括了粉末空隙中的空气,因此比真密度小。
4 避免试剂瓶膨胀破裂的方法
(1) 每次取用试剂后盖紧瓶盖,防止水蒸气进入瓶内发生反应。
(2) 盖紧的瓶盖也可能有轻微漏气,可用多层塑料膜覆盖瓶口,用线绳把塑料膜紧紧缠绕在瓶颈,形成“缓冲式保护”,可有效阻隔气体的流通[10]。
(3) 市售氧化钙试剂瓶大多是白色半透明的,可定期用强光手电照射,观察瓶内粉末的高度,如果接近瓶口应及时处理。
(4) 可摇晃试剂瓶,排除一部分瓶内粉末间的空隙,提高粉末的堆积密度[11]。
5 结语
本实验起源于“氧化钙试剂瓶膨胀破裂”的现象,在探究过程中,一方面让学生从宏观层面认识到氧化钙到氢氧化钙真密度的降低,以及视密度的进一步降低,解释了试剂瓶破裂的真正原因。另一方面通过微观探析,让学生理解氧化钙与水反应的三个阶段,加深对反应历程的认识。
本实验无论作为演示实验还是课后拓展实验,都建议教师带领学生从理论探讨中形成假设——由微观层面的CaO和Ca(OH)2的化学键结合强度差异推测真密度的不同,由介观层面的氢氧化钙颗粒形貌推理视密度较小,然后通过设计实验来检验假设,培养学生宏微结合、实验探究的素养。
参考文献:
[1]王晶, 郑长龙主编. 义务教育教科书·化学·九年级上册[M]. 北京: 人民教育出版社, 2012: 148.
[2]缪培. 塑料瓶到底是怎么胀破的[J]. 理科考试研究, 2019, 26(10): 58~59.
[3][9]熊爽, 严金生, 周洲等. 生石灰消化反应条件对氢氧化钙特性影响[J/OL]. 无机盐工业: 114[20231112]. DOI: 10. 19964/j.issn.1006-4990.20230051.
[4]田新娟, 龙亚平, 肖文钊等. 灰分和硫含量对煤的视相对密度测定结果的影响[J]. 煤质技术, 2012, (6): 42~43, 49.
[5]Seville J.P.K., Wu C.Y.. Particle technology and engineering: An engineers guide to particles and powders: Fundamentals and computational approaches [M]. Oxford, English: Butterworth-Heinemann, 2016: 18~22.
[6]吴俊明, 李建强. “分子中原子相互影响”观念的基础、养成、意义和应用[J]. 化学教学, 2015, (6): 3~9.
[7]Zhang H., Zhao H., Chen J., et al.. Defect study of MgOCaO material doped with CeO2 [J]. Advances in Materials Science and Engineering, 2013, (2013): 673786.
[8]Aierken Y., Sahin H., Iyikanat F., et al.. Portlandite crystal: Bulk, bilayer, and monolayer structures [J]. Physical Review B, 2015, 91(24): 245413.
[10]李旭娃. 实验室化学药品的缓冲式保护[J]. 化学教学, 2016, (3): 70~73.
[11]马小强. 利用粉末堆积理论对废树脂热态超压深度减容的探讨[J]. 中国核电, 2021, 14(6): 787~793.

