嫁接对NaCl胁迫下西瓜叶片抗氧化物酶活性及其同工酶的影响
刘香娥 郭世荣 田婧 段九菊 杜长霞
(南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室,江苏南京,210095)
嫁接对NaCl胁迫下西瓜叶片抗氧化物酶活性及其同工酶的影响
刘香娥 郭世荣 田婧 段九菊 杜长霞
(南京农业大学园艺学院,农业部南方蔬菜遗传改良重点开放实验室,江苏南京,210095)
以耐盐性较强的葫芦品种“超丰抗生王”为砧木,以盐敏感型的西瓜品种“秀丽”为接穗,研究了嫁接对盐胁迫下西瓜植株叶片SOD,POD,APX酶活性及其同工酶的影响。研究结果表明,盐胁迫8 d后,嫁接苗株高、茎粗、鲜质量等生长指标受抑制程度均显著低于自根苗,嫁接苗和自根苗SOD,POD,APX活性均降低,但嫁接苗降低程度显著低于自根苗;正常营养液培养8 d后,嫁接植株叶片POD,APX同工酶产生特异条带;盐胁迫8 d后,嫁接苗和自根苗SOD,POD,APX酶谱强度均减弱,但嫁接苗酶谱减弱程度较低。可见,嫁接可调节西瓜植株抗氧化物酶活性及其同工酶基因的表达,缓解盐胁迫对西瓜植株的伤害。
嫁接 NaCl胁迫 小型西瓜 酶活性 同工酶
西瓜为葫芦科一年生草本植物,随着西瓜设施栽培面积的不断扩大和连年种植,由土传病害引起的连作障碍日益严重,尤其是西瓜重茬田间枯萎病大面积发生,已成为西瓜高产优质的主要障碍因子。虽然轮作是防治枯萎病的有效措施,但由于土地面积的限制和专业化生产的需要,合理轮作往往难以实现,加之药剂防治效果差且不利于环境保护,培育抗病品种周期长和种质资源等限制,因此,采用嫁接技术已成为生产上克服连作障碍和防治病害的一项行之有效的方法[1~2]。目前在西瓜嫁接砧木的筛选与利用方面仅限于种内或瓠子和南瓜等少数瓜类植物,研究内容限于抗性、嫁接技术、营养生理、产量和品质效应[1~4]等方面,有关嫁接西瓜植株体内与抗逆性相关的抗氧化物酶及其相应同工酶的报道较少。本文以筛选出的耐盐性较强的葫芦品种为砧木,以盐敏感型的小型西瓜品种为接穗,研究了嫁接对NaCl胁迫下西瓜幼苗叶片抗氧化物酶活性及其同工酶的变化,旨在进一步探讨嫁接提高西瓜植株耐盐性的内在原因,为西瓜嫁接抗逆栽培提供理论依据。
1 材料与方法
1.1 试验材料
供试的西瓜(Citrullus lanatusM.)接穗品种为盐敏感型的小果型品种秀丽(由安徽省农业科学院园艺研究所提供),砧木为耐盐型的葫芦(Lagenaria siceraria Standl)品种超丰抗生王[6](由中国农业科学院郑州果树研究所西甜瓜研究所提供)。
1.2 试验方法
①试材培育 试验于2008年5月在南京农业大学玻璃温室内进行,选取饱满、整齐一致的葫芦砧木种子,温汤浸种15 min后,用自来水浸泡10 h,29±1℃培养箱催芽,露芽后播于装有石英砂的直径12 cm、高12 cm的硬质塑料营养钵中,昼温25~30℃,夜温15~18℃。子叶露出时,播种西瓜接穗。待砧木第1片真叶展开、接穗2片子叶展平时,采用插接法进行嫁接。嫁接苗的培育按照曾义安等[7]的方法进行。
②试验处理 嫁接苗3叶1心时,选生长整齐一致的植株定植于装有1/2Hoagland营养液的栽培槽中,用气泵间歇(40 min/h)式对营养液通气,每5 d更换1次营养液,缓苗5 d后开始处理。试验设4个处理:a.正常营养液栽培自根苗(CK1),b.含50 mmol/L NaCl的营养液栽培自根苗(CK1+NaCl),c.正常营养液栽培嫁接苗(CK2),d.含50 mmol/L NaCl的营养液栽培嫁接苗 (CK2+NaCl)。含 50 mmol/L NaCl的营养液是在营养液中添加分析纯NaCl,使营养液中Na+终浓度为50 mmol/L。每处理36株,试验重复3次。
③测定项目及方法 于处理8 d时,取自上向下第3片完全展开功能叶测定各项生理指标,重复测定 5次,每区每次取样 3株。采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性[8],愈创木酚法测定过氧化物酶(POD)活性[9],抗坏血酸过氧化物酶(APX)活性按照Nakano等[10]的方法测定。
保护酶的同工酶用50 mmol/L pH值7.8磷酸缓冲液(含0.15 mmol/L EDTA,0.3%Triton-x-100T,4%PvPP)提取,冰浴研磨,4℃12 000 r/min,20 min,上清液作同工酶分析用。采用PAGE垂直电泳,电极缓冲液用Tris-Gly缓冲液(pH值8.3)。
SOD分离胶浓度T=7.5%,浓缩胶浓度T=2.5%,采用氮蓝四唑法(NBT)染色[11~12];POD分离胶浓度T=7.5%,浓缩胶浓度T=3.1%,染色采用改良式联苯胺法[12];APX分离胶浓度T=8%,浓缩胶浓度T=4%,染色步骤参照Mittler[13]的方法。
酶带的相对迁移率(Rf)[14]:Rf=样品带迁移的相对距离/溴酚蓝迁移相对距离。
1.3 数据分析
数据用DPS软件进行单因素方差分析,并对平均数用Duncan’s新复极差法进行多重比较。

图1 嫁接对NaCl胁迫下西瓜植株叶片SOD,POD,APX活性的影响
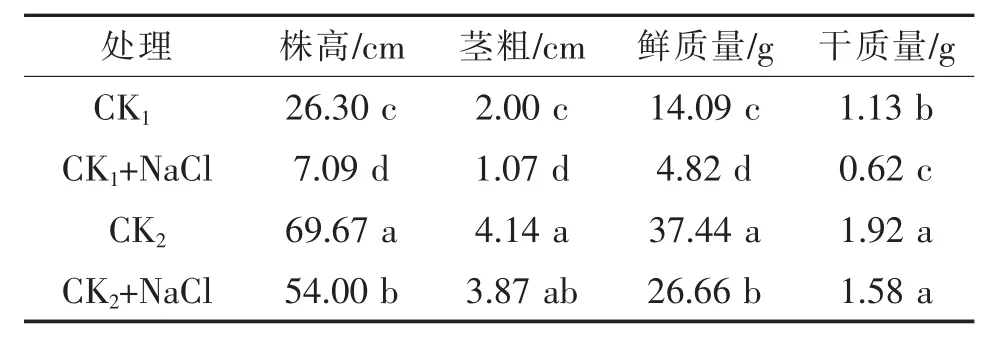
表1 嫁接对NaCl胁迫下西瓜幼苗生长的影响
2 结果与分析
2.1 西瓜自根苗和嫁接苗的生长
表1表明,非盐胁迫条件下,嫁接苗植株株高、茎粗、鲜质量、干质量比自根苗分别提高了164.9%,108.9%,165.7%,70.0%,因此嫁接可显著促进西瓜植株的生长。NaCl胁迫后,自根苗的株高、茎粗、鲜质量、干质量分别比对照降低了73.1%,45.8%,65.8%,45.6%,差异均达显著水平;而嫁接苗的株高、茎粗、鲜质量、干质量分别比对照降低了22.5%,6.44%,28.8%,17.7%,仅株高和鲜质量显著低于嫁接苗对照,其他生长指标差异均不显著。表明NaCl胁迫下,自根苗生长受到严重抑制,而嫁接苗生长受抑制程度较小,因此,嫁接可显著缓解NaCl胁迫对西瓜幼苗植株生长的伤害,提高植株的抗盐性。
2.2 西瓜自根苗和嫁接苗叶片保护酶活性
由图1可知,非盐胁迫条件下,嫁接苗SOD活性比自根苗提高了49.1%,差异达显著水平;盐胁迫下,自根苗和嫁接苗 SOD活性分别降低了49.7%,26.4%,均显著低于对照,但嫁接苗降低幅度显著低于自根苗。
非盐胁迫条件下,嫁接苗POD活性比自根苗提高了50.2%,差异达显著水平;盐胁迫下,自根苗POD活性降低了46.7%,显著低于对照;嫁接苗POD活性降低了16.6%,与对照差异不显著。
非盐胁迫条件下,嫁接苗APX活性比自根苗提高了79.1%,差异达显著水平;盐胁迫下,自根苗POD活性降低了50.6%,显著低于对照;嫁接苗APX活性降低了22.9%,与对照无显著差异。
由以上结果可知,非盐胁迫条件下,嫁接苗叶片中SOD,POD,APX活性均高于自根苗;盐胁迫处理后,各酶活性均呈现不同程度的降低,但嫁接苗中的酶活性降低程度显著低于自根苗,说明嫁接后西瓜植株能维持较强的抗氧化物酶活性。
2.3 西瓜自根苗和嫁接苗叶片同工酶的变化
由图2-SOD可知,嫁接苗和自根苗叶片SOD同工酶有 4条相同带,Rf分别为 0.461,0.643,0.870,0.928。其中,0.461,0.643两条带宽且散,其他两条比较集中,嫁接苗谱带强度较自根苗强。盐胁迫后,谱带强度均减弱,但自根苗减弱程度大(Rf=0.928的谱带极弱)。
由图2-POD可知,自根苗和嫁接苗叶片中POD同工酶有5条相同带,Rf分别为0.447,0.470,0.501,0.577,0.688,盐胁迫后强度均变弱,自根苗变弱程度大。Rf为0.422的带仅在自根苗中出现,盐胁迫后强度变弱;Rf为0.255,0.650是嫁接苗的2条特异带,盐胁迫后强度变弱,且0.255的带下移。
如图2-APX所示,自根苗和嫁接苗叶片中APX同工酶有3条相同带,Rf分别为0.445,0.637,0.930,盐胁迫后各带强度均变弱,但嫁接苗变弱强度较小。Rf为0.280的带是嫁接苗的特异条带,处理后变弱且下移。

图2 嫁接对NaCl胁迫下西瓜植株叶片SOD,POD,APX同工酶的影响
3 结论与讨论
有研究表明,盐胁迫对植物的伤害最终体现在生长受到抑制,生物量积累下降,而嫁接能缓解其抑制程度[15~16]。本研究表明,西瓜嫁接苗的生物积累量显著高于自根苗,这与Martinez-Rodriguez等[17]的报道相一致;盐胁迫严重抑制了自根苗生物量的积累,而嫁接苗生物积累量的下降幅度明显小于自根苗,表明嫁接苗对盐胁迫的适应性强于自根苗,嫁接可缓解盐胁迫对植株的伤害,这与张古文等[18]的报道相一致。
正常条件下,植物依靠自身的自由基清除系统,保持细胞内活性氧的平衡[19],而当植物受到重金属等胁迫时,活性氧平衡受到破坏,其清除系统尤其是抗氧化酶类如SOD,POD,APX则会表现出相应的应激反应,缓解胁迫对植株膜系统造成的伤害,但随胁迫时间延长,这种效应将会减弱[20~21]。 张玉鑫等[22]研究认为,盐胁迫下甜瓜抗氧化物酶活性升高,且耐性强的甜瓜品种酶活性高于耐性弱的品种。但Davenport等[23]研究表明,采用175 mmol/L NaCl胁迫处理向日葵,叶片SOD,POD酶活性对NaCl胁迫的响应具有时间依赖性,短期处理下酶活性上升,但在长期处理下酶活性下降。本试验结果表明,盐胁迫处理后,西瓜自根苗和嫁接苗抗氧化酶活性均降低,但嫁接苗降低幅度显著小于自根苗。抗氧化物酶活性下降,不能有效地清除盐胁迫产生的活性氧自由基,膜脂过氧化作用导致膜结构破坏,是盐胁迫对西瓜幼苗叶片细胞造成伤害的重要原因之一,这与毛桂莲等[24]的研究相一致。另外,许多研究表明,植物在遭受逆境胁迫时,植物能通过提高细胞内防御机制,启动一系列生理生化过程,把胞外信息传递给胞内受体,调节基因表达,使得体内一些酶的同工酶发生变化[25]。抗氧化物酶是对环境条件十分敏感的酶类,其活性和同工酶谱的变化在一定程度上能反映植物抗盐性的强弱[28],SOD,POD,APX为相应基因表达的产物。本试验表明,正常营养液培养下,嫁接苗SOD,POD,APX同工酶活性提高,且酶带强度增强,说明嫁接可能在诱导SOD,POD,APX同工酶基因表达的过程中具有重要作用;盐胁迫下,自根苗和嫁接苗酶活性降低,且同工酶酶带强度降低,酶谱有增减,出现了条带的迁移,这表明在NaCl胁迫下,自根苗和嫁接苗的基因表达可能发生了变化,使得一些同工酶(如POD等)的合成受阻或被降解,活性降低或丧失,使得一些酶带消失;同时嫁接也可能活化了某些基因,或增强了某些基因的表达,或者两者均可,一些同工酶被激活,甚至诱导其他类型相关基因新的多肽合成启动,酶的活性增强,产生新的谱带(嫁接苗产生Rf为0.255,0.306,0.650 POD谱带),这与前人的研究结果相一致[26]。
对不同植物SOD同工酶基本谱型的比较分析表明,不同植物虽然在酶带条数和酶带迁移率上有其特异性,但由于SOD是进化上高度保守的酶,多数植物存在共有带[27]。在本试验中,嫁接没有产生特异带,盐胁迫下也没有产生特异带,表明SOD是进化上比较保守的酶,与前人研究结果相一致[26]。
过氧化物酶(POD)是一种适应性酶,对不良环境的影响十分敏感,如小麦在受精胺[28]等处理时都会引起酶活性的改变和同功酶条带的增加或减少。本试验表明,自根苗和嫁接苗有5条相同带;对照自根苗叶片中POD有1条特异带,对照嫁接苗有2条特异带。盐胁迫下,各处理下谱带强度变弱,嫁接苗条带减弱程度小,且出现了条带的迁移 (Rf= 0.255),表明嫁接可缓解其减弱程度,能够减缓盐胁迫对幼苗的伤害。
逆境胁迫下,植物体内会积累过量的H2O2,它是一种对植物细胞和组织既有一定生理作用又有一定毒害作用的活性氧[29],而APX可以直接清除H2O2。因此,APX活力的大小与H2O2的积累有直接关系。本试验表明,自根苗和嫁接苗APX有3条相同带,嫁接苗中有1条特异带;盐胁迫下,自根苗、嫁接苗各条带强度均减弱,但自根苗的减弱程度较大,这也表明嫁接可以缓解盐胁迫对幼苗的伤害。
从酶活性和同工酶酶谱变化来看,盐胁迫下,SOD,POD,APX酶活性在自根苗中变化较大,在同工酶酶谱上也存在强度的差异,POD出现1条特异带,但SOD,APX未出现谱带的增加或减少,这表明盐胁迫能改变自根苗POD同工酶基因的表达。而在嫁接苗中的变化比较复杂,除酶活性、酶谱强度有变化外,而且POD产生多条特异带,表明嫁接能明显改变同工酶基因的表达,且程度强于盐胁迫,这也许是嫁接缓解植株盐胁迫伤害的原因之一。
本试验结果表明,嫁接可提高西瓜植株的生物量及叶片SOD,POD,APX酶活性,盐胁迫下表现得更为明显;在同工酶酶谱表达上,嫁接苗中的酶谱变化比较复杂,产生较多的特异条带,体现出较强的植株耐盐性。
[1]柳晓燕,叶红,张学荣.西瓜嫁接防病效果试验与嫁接育苗技术[J].中国西瓜甜瓜,2004(4):15-16.
[2]徐胜利,陈小青,陈青云.嫁接西瓜植株的生理特性及其抗枯萎病能力[J].中国农学通报,2004,20(2):149-150.
[3]刘润秋,张红梅,徐敬华.砧木对嫁接西瓜生长及品质的影响[J].上海交通大学学报:农业科学版,2003,21(4):289-294.
[4]吴明珠.当前西瓜甜瓜育种主要动态及今后育种目标研讨[J].中国西瓜甜瓜,2003(3):1-3.
[5]韩志平,郭世荣,焦彦生,等.NaCl胁迫对西瓜幼苗生长和光合气体交换参数的影响[J].西北植物学报,2008,28(4):745-751.
[6]崔聪聪,郭世荣,冯吉庆.盐胁迫对不同西瓜砧木品种幼苗生长及光合作用的影响[J].内蒙古农业大学学报,2007(28)3:134-139.
[7]曾义安,朱月林,黄保健,等.嫁接黄瓜的光合特性及叶片激素含量和可溶性蛋白研究 [J].南京农业大学学报,2005,28(1):16-19.
[8]中国科学院上海植物生理研究所.现代植物生理学实验指南[M].北京:科学出版社,1999.
[9]曾韶西,王以柔,刘鸿先.低温光照下与黄瓜子叶叶绿素降低有关的酶促反应[J].植物生理学报,1991,17(2):177-182.
[10]Nakano Y,Asada K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant Cell Physiology,1981,22:867-880.
[11]姚允聪.低温条件下君迁子幼苗SOD同工酶谱带与活性研究[J].北京农学院学报,1994,9(2):61-62.
[12]万善霞,秦岭,于同泉.水分胁迫对板栗幼苗过氧化物、超氧化物歧化酶活力及同工酶谱的影响[J].北京农学院学报,1997,3(12):24-26.
[13]Mittler R.Detection of ascorbate peroxidase activity innative gels by inhibition of the ascorbate-dependent reduction ofnitrobluetetrazolium[J].AnalyticalBiochemistry,1993,212:540-546.
[14]徐金星,刘忠民,刘翠明.大豆品种接种SMV叶片POD同工酶的研究[J].东北农业大学学报,2000,31(1):20-25.
[15]张云起,刘世琦,王海波.耐盐砧木嫁接对西瓜幼苗抗盐特性的影响[J].上海农业科学,2004,20(3):62-64.
[16]史跃林,刘佩瑛,罗庆熙,等.黑籽南瓜砧对黄瓜抗盐性的影响研究[J].西南农业大学学报,1995,17(13):232-236.
[17]Martinez-Rodrigueza M M,Esta M T,Perez-Alfocea F,et al.The effectiveness of grafting to improve salt tolerance in tomato when an ‘excluder’genotype is used as scion[J]. Enviromental and Experimental Botany,2007,10:1 863.
[18]张古文,朱月林,杨立飞,等.NaCl胁迫对番茄嫁接苗生物量及离子含量的影响[J].西北植物学报,2006,26(10):2 069-2 074.
[19]孙国荣,关旸,阎秀峰.盐胁迫对星星草幼苗保护酶系统的影响[J].草地学报,2001,9(1):34-36.
[20]Gallego S M,Benides M P,Tomaro M L.Effect of heavy metal ion excess on sunflower leaves:evidence for involvement of oxidative stress[J].Palnt Science,1996,121: 151-159.
[21]Lidon F C,Teixeira M G.Oxy radicals production and control in the chloroplast of Mn-treated rice[J].Plant Science,2000,152:7-15.
[22]张玉鑫,康恩祥,马凌之,等.NaCl胁迫对甜瓜幼苗叶片膜脂过氧化和渗透调节物质的影响[J].果树学报,2007,24(2):194-198.
[23]Davenport S B,GallegooOo S M,Benavdes M P,et al.Behaviour of antioxidant defense system in the adaptive response to salt stress inHelianthus annuusL.cells[J].Plant Growth Regulation,2003,40(1):81-88.
[24]毛桂莲,许兴.枸杞耐盐突变体的筛选及生理生化分析[J].西北植物学报,2005,25(2):275-280.
[25]李芸瑛,梁广坚.GB对低温胁迫黄瓜叶绿体及SOD、POD同工酶的影响[J].生物技术,2005,15(3):25-27.
[26]孙静,张万正,亓伟美,等.盐胁迫和6-BA、Ca(N03)2、SA对小麦POD的影响[J].山东农业大学学报:自然科学版,2006,37(4):517-520.
[27]孙黎,肖璐,阎平.藜科12种盐生植物SOD活性及其同工酶的初步研究[J].石河子大学学报:自然科学版,2004,22(6):500-503.
[28]马俊莹,周壑,程炳嵩.精胺对离体小麦叶片过氧化物酶活性影响[J].东北农业大学学报,1996,27(2):176-180.
[29]Lombardi L,Sebastiani L.Copper toxicity in Prunus cerasifera:growth and antioxidant enzymes responses of in vitro grown plants[J].Plant Sci,2005,168:797-802.
Effects of Grafting on the Isozymes and Activities of Antioxidant Enzymes of Watermelon Leaves under NaCl Stress
LIU Xiang’e,GUO Shirong,TIAN Jing,DUAN Jiuju,DU Changxia
(College of Horticulture,Nanjing Agricultural University/Key Laboratory of Southern Vegetable Crop Genetic
Improvement,Ministry of Agriculture,Nanjing 210095)
The effects of NaCl stress on the isozymes and activities of SOD,POD,APX of the watermelon leaves of grafted scion-root plants and scion-root plants of mini-watermelon were studied with"Chaofengkangshengwang",a salt-tolerant variety,as the rootstock and"Xiuli",a salt-sensitive cultivar,as the scion.The results showed that under NaCl stress,the SOD,POD,APX activities in the leaves of the grafted plants were inhibited less than those in the leaves of scion-root plants.Grafting induced specific bands,significantly expressed.The results showed that grafting could regulate isozyme gene,grafted plants performed better in salt tolerance than the scion-root plants.Grafting could adjust the isozymes and activity of antioxidant enzymes of watermelon,and reduce the effect of NaCl stress on watermelon.
Grafting;NaCl stress;Mini watermelon;Isozymes;Activities of enzymes
10.3865/j.issn.1001-3547(x).2009.02.006
农业部行业公益性项目(nyhyzx07-007);国家重点基础研究发展计划资助(2009CB119000);江苏省自然科学基金(BK2006140);江苏省农业三项工程项目(SX(2008)026);国家科技支撑计划(2006BAD07B04)资助
刘香娥(1983-),女,硕士研究生,主要从事蔬菜作物逆境生理研究。
郭世荣,通信作者,E-mail:srguo@njau.edu.cn
2009-01-21

