黄鳝I型hepcidin抗菌肽基因的诱导表达分析
李 伟,孙文秀 (长江大学生命科学学院,湖北 荆州 434025)
黄鳝I型hepcidin抗菌肽基因的诱导表达分析
李 伟,孙文秀 (长江大学生命科学学院,湖北 荆州 434025)
采用RT-PCR的方法对健康黄鳝(Monopterusalbus)不同组织 I 型抗菌肽hepcidin基因的表达情况及受脂多糖(LPS)注射、嗜水气单胞菌感染后该基因的表达情况进行了分析。结果表明:在正常黄鳝各组织中,该基因在肝脏中表达量最高,其次是肾脏,在心脏、皮肤、脑、血液、小肠、脾脏和胃中的表达量较低,而在肌肉中没有检测到该基因的转录本;LPS注射24 h后,各组织里的hepcidin基因表达量都有明显升高;当受到病原菌感染后,在所检测的肝脏、肾脏、皮肤、脑、心脏和脾脏等6个组织中该基因的转录本都在感染后24 h后急剧上升。这些结果表明黄鳝的I型抗菌肽hepcidin基因可能在黄鳝抵抗外界病原物侵染过程中起着重要作用。
黄鳝(Monopterusalbus); 抗菌肽hepcidin基因; RT-PCR; 诱导表达分析
抗菌肽(antimicrobial peptides,AMPs)分布十分广泛,是生物体天然免疫系统的重要成员,对真菌、大多数革兰氏阴性或阳性菌、原生动物均有抑制作用,有些抗菌肽还具有抗寄生虫、病毒和肿瘤的作用[1]。富含半胱氨酸的抗菌肽是抗菌肽大家族中重要的成员,最早发现于昆虫脂肪体和甲壳动物的血淋巴中。抗菌肽是富含半胱氨酸抗菌肽家族的成员,是由hepcidin基因编码产生的,机体在细菌、真菌、病原体等致炎物质作用下以及在贫血、缺氧、铁代谢紊乱等状态下均能影响其表达水平,是机体天然免疫的重要效应因子[2]。近年来的研究还表明hepcidin基因在铁转运调控方面有十分重要的作用,当机体缺铁时,hepcidin基因表达水平下降,铁负荷过重时hepcidin基因表达水平升高,对肠道铁吸收起负调控作用[3]。迄今为止,越来越多的hepcidin基因被从人、鼠及其他高等脊椎动物中发现。hepcidin基因主要表达于肝脏组织,后来的研究发现hepcidin在肾脏等多个免疫相关组织中也有表达的报道,可能与小鼠[4]、 大西洋鲑[5]、 金眼石鮨[6]、 牙鲆[7]的天然免疫系统有重要关系。序列分析结果表明,目前已经发现的hepcidin基因主要有I、II、III型,每种hepcidin分子都有不同的表达动态[5]。当受到外界病原物感染或注射脂多糖(LPS)后,抗菌肽基因的表达量成倍增加[6,8]。同时,采用化学合成的方法对hepcidin小肽的活性进行的鉴定发现,它具有非常广的抗菌活性,能够在一定程度上抑制细菌和酵母的生长[8],这些结果表明hepcidin可能在鱼体抵抗外源病原物侵染过程中起着重要作用。目前,尚无黄鳝hepcidin基因研究的报道。笔者报道了黄鳝I型抗菌肽hepcidin在健康组织和注射LPS后、及病原菌感染后的表达情况,以期为黄鳝养殖和了解其机体的免疫机制积累一些资料。
1 材料与方法
1.1 材料
Taq DNA polymerase、DNA 分子量标准DL2000、M-MLV反转录酶购买于大连宝生物技术有限公司。脂多糖为Sigma公司产品。病原菌菌株(Aeromonashydrophila)由作者保存。其他生化试剂为分析纯,国内试剂公司生产。受试黄鳝购于湖北省荆州市老南门水产品市场,健康无病,体质量75~110 g。
1.2 方法
(1)受试黄鳝的处理与分组 随机将黄鳝分组(每组至少3条),采用腹腔注射的方法,一组注射100 μL LPS(10 μg/mL),对照组注射100 μL NaCl (0.9%)。注射24 h后,取各组织冻存于-80 ℃用于总RNA的提取。病原菌感染采用腹腔注射的方法,一组注射100 μL 病原细菌(Aeromonashydrophila),病原菌浓度为2.6×106cfu/mL。对照组则注射100 μL NaCl (0.9%)。分别在注射后0、24、48、72 h取各组织冻存于-80 ℃用于总RNA的提取。
(2)总RNA的提取 将黄鳝各组织取出后迅速冻存于液氮中,各组织总RNA的提取采用Trizol (Invitrogen)一步法提取,方法按照说明书进行。分别取2 μg的肝脏、肾脏、小肠、心脏、皮肤、脑、血液、脾脏、胃和肌肉的总RNA 进行反转录反应。cDNA 合成采用 M-MLV反转录酶 (TaKaRa )进行。合成的 cDNA 冻存于-20 ℃ 下备用。
(3)引物设计和PCR扩增 利用 M-MLV Reverse Transcriptas(TaKaRa)按照文献[9]的方法进行cDNA 合成。根据作者自行克隆的黄鳝抗菌肽hepcidin基因序列(GenBank序列号FJ594996)设计了1对特异性引物 hepN1(5’-ctcgcctttatctgcattctgg-3’) 和 hepC1(5’-cgcagcccttgtagttct-3’) 来扩增健康黄鳝各组织中和LPS注射及病原菌感染后各组织中的hepcidin基因。PCR反应 25 μL 体系为:2 μL 的模板,1 μL的10 μmol/L 的引物,0.2 μL 的 25 mmol/L 的 dNTP 混合物,1 U的 Taq DNA 聚合酶。PCR反应条件如下:94 ℃预变性4 min,94 ℃30 s,53 ℃30 s,72 ℃ 30 s,共进行 35个循环,最后72 ℃延伸 10 min。 β-actin 作为 PCR的内参。设计的1对β-actin 的特异性引物为 actinN1(5’-ggctactcct tcaccaccacag -3’ )和 actinC1 ( 5’-gtctcatggattccgcaggtca-3’ )。取等体积的hepcidin和actin扩增产物进行 1.5%的琼脂糖电泳检测。利用Gel-Pro Analyzer进行图象分析,用SPSS进行数据计算。
2 结果与分析
2.1 黄鳝I型抗菌肽hepcidin基因在不同健康组织内的表达分析
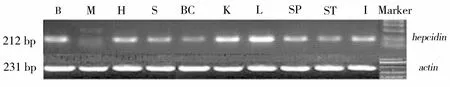
B:脑;M:肌肉;H:心脏;S:皮肤;BC:血细胞;K:肾脏;L:肝脏;SP:脾脏;ST:胃;I:肠图1 黄鳝hepcidin基因表达的组织特异性分析Figure 1 Tissue-specific expression analysis of rice field eel hepcidin
用RT-PCR的方法对健康黄鳝10个组织I型hepcidin基因表达的情况进行了分析,结果表明:在所检测的10个组织中,都有hepcidin基因转录本的存在,该基因在肝脏中表达量最高,其次是肾脏,在心脏、皮肤、脑、血液、小肠、脾脏和胃中的表达量较低,而在肌肉中没有检测到该基因的转录本(图1)。
2.2 注射脂多糖LPS对各组织I型抗菌肽hepcidin基因表达的影响
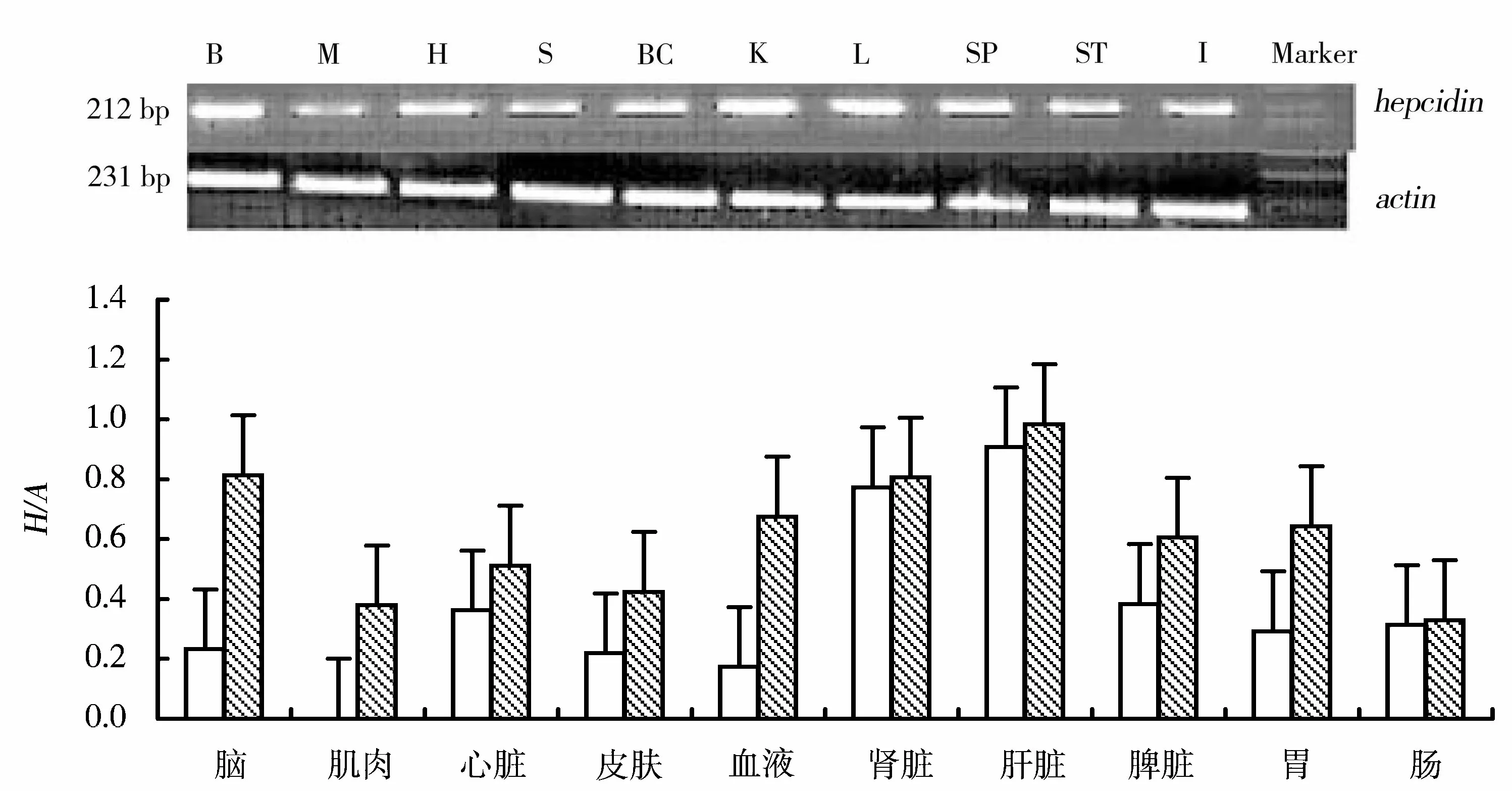
H/A表示hepcidin表达量相对于actin基因的表达量B:脑;M:肌肉;H:心脏;S:皮肤;BC:血细胞;K:肾脏;L:肝脏;SP:脾脏;ST:胃;I:肠图2 LPS注射对hepcidin基因表达的影响Figure 2 Expression analysis of hepcidin after LPS injection
如图2所示,当注射了100 μL的脂多糖24 h以后,黄鳝各组织里I型抗菌肽hepcidin基因的表达都有了比较明显的升高,尤其是肌肉、脑和血液中增加幅度较高;而肝脏、肾脏和肠的表达量虽有增加但幅度却不大。
2.3 病原菌感染对各组织组织I型抗菌肽hepcidin基因表达的影响

图3 RT-PCR 分析病原菌感染对抗菌肽hepcidin的诱导表达Figure 3 Expression analysis of hepcidin from various tissues infected by A.hydrophila
当黄鳝注射了病原细菌以后,通过RT-PCR的方法对感染后0、24、48、72 h的脑、肝脏、心脏、皮肤、肾脏和脾脏里I型抗菌肽hepcidin的表达进行了分析,结果表明:病原菌的感染使得各组织里hepcidin转录本大量增加。从感染后24 h,检测到的6个组织该基因的转录本既有明显增加;脑、心脏和皮肤的表达量在感染后48 h增加剧烈,而肝脏和肾脏的变化则没有脑和皮肤中明显(图3)。
3 讨论
Douglas 等[5]报道了hepcidin-like (TypeⅠ,TypeⅡ,TypeⅢ)在美洲拟鲽(Limandnamericanus)不同组织中的表达情况,证明TypeⅠ在肝脏中有大量表达,在胃中表达量则很少,且任何组织中都检测不到TypeⅡ的表达;TypeⅢ在食道、胃、肝脏中都有一定的表达。Krause 等[10]也报道hepcidin基因在人的肝脏、心脏与脑中有大量表达。Pigeon 等[4]报道hepcidin基因在老鼠肝脏中被检测到大量表达,而在胃、小肠、肺、心脏、胸腺中只有微弱的表达;用人的hepcidincDNA作为引物分析人的组织和细胞系中hepcidin的表达,发现在成人和婴儿的肝脏中hepcidin基因有大量表达,而在成人心脏、婴儿心脏以及脊髓中表达量很少。Chen 等[11]报道hepcidin在真鲷(Chrysophrysmajor)头肾、肾脏、小肠、肝脏、鳃和胃中有很高的表达量,在性腺、心脏、脾脏中也有大量的表达,在脑、肌肉、皮肤中表达量较少,在血细胞中检测不到它的表达。本研究通过RT-PCR检测了健康黄鳝10个组织hepcidin基因的表达情况发现,黄鳝I型抗菌肽hepcidin基因在肝脏中表达量最高,在心脏、皮肤、脑、血液、小肠、脾脏和胃中的表达量较低,而在肌肉中没有检测到该基因的转录本,这个结果同大菱鲆(Scophthalmusmaximus)[9]、许氏平鮋(Sebastesschlegelii)[12]等的报道相似。同多数已知的I型抗菌肽hepcidin一样,黄鳝的抗菌肽hepcidin在血液中也只是微量的表达。
Chen等[11]用大肠杆菌(E.coliDH5α)感染真鲷24 h后,脾脏、鳃、肝脏、和小肠中hepcidin的表达量都显著增高。Shike等[6]的研究发现病原菌Steptococcusniae感染金眼石鮨,肝脏中的表达量升高了数千倍,而在其他组织中则有一定程度的诱导作用。也有研究发现,病原菌Aeromonassalmonnicida感染也可以引起金眼石鮨肝脏内hepcidin基因剧烈增加[8]。大菱鲆在受到病原细菌鳗弧菌Listonellaanguillarum感染后,肝脏和脾脏里hepcidin基因表达量显著升高;而感染的大菱鲆胚胎细胞系的结果也表明细菌的感染具有明显的诱导作用[9]。对猪注射LPS以后,肝脏中的hepcidin基因在注射后6 h就可以显著地增加[13]。罗非鱼(Oreochromismossambicus)当注射入10 μg/μL脂多糖LPS后,I 型抗菌肽hepcidin的表达量要远比其他2种类型升高得多[14]。对斑点叉尾鮰(Ictaluruspunctatus)的研究发现,人工感染病原细菌Edwardsiellaictaluri可以显著地影响hepcidin基因在肝脏里的表达量,感染4 h后肝脏中hepcidin基因的表达量上升4倍,而当感染后48 h后,表达量则增加到22倍[15]。本研究也发现,用LPS感染黄鳝24 h后,各组织里hepcidin基因的表达量都有不同程度的变化。尤其是肌肉、脑和血液中增加幅度较高;而在肝脏、肾脏和肠中的表达量虽有增加但幅度却不大。同样的,给黄鳝注射重要的嗜水汽单胞菌也表现出对hepcidin基因明显的诱导作用。病原菌的感染使得各组织里hepcidin转录本大量增加。从感染后24 h,检测到的6个组织该基因的转录本即明显增加;脑、心脏和皮肤的表达量在感染后48 h增加剧烈。这些结果表明,黄鳝的hepcidin基因可能在其抵抗外界病原物感染过程中起着重要的作用。当然对于黄鳝抗菌肽hepcidin基因在离子代谢过程中的作用需要进一步深入研究,对其采用脂多糖和病原菌诱导表达为进一步了解其功能积累了基础资料。
[1]Hancock R E,Lehrer R.Cationic peptides:a new source of antibiotics[J].Trends Biotechnol,1998,16:82~88.
[2]Christian H P,Erika V V,Alan J W,etal.Hepdcidin,a Urinary Antimicrobial peptides Synthesized in the Liver[J].The Journal of Biological Chemistry,2001,16:7806~7810.
[3]Gael N,Lydie V,Myriam B,etal.hepcidin,a new iron regulatory peptide[J].Blood cells,moleculars and diseases,2002,29:327~335.
[4]Pigeon C,Ilyin G,Courseland B,etal.A new mouse liver-specific gene,encoding a protein homologous to human antimicrobial peptidehepcidin,is over expressed during iron overload[J].J Biol Chem,2001,276:9~11.
[5]Douglas S E,Gallant J W,Ryan S L,etal.Identification and expression analysis ofhepcidin-like antimicrobial peptides in bony fish[J].Dev Comp Immunol 2003,27:589~601..
[6]Shike H,lauth X,Westerman M E,etal.Basshepcidinis a novel antimicrobial peptide induced by bacterial challenge[J].Eur J Biochem,2002,269:2232~2237.
[7]Hirono I,Hwang J Y,Ono Y,etal.Two different types ofhepcidins from Japanese flounderParalichthysolivaceus[J].FEBS J,2005,272:5257~5264.
[8]Lauth X,Babon J J,Stannards J A,etal.Basshepcidinsynthesis,solution structure,antimicrobial activities and synergism,andinvivohepatic response to bacterial infections[J].J Biol Chem,2005,280:9272~9282.
[9]Chen S L,Li W,Meng L,etal.Molecular cloning and expression analysis of ahepcidinantimicrobial peptide gene from turbot (Scophthalmusmaximus)[J].Fish Shellfish Immunol,2007,22:172~181.
[10]Krause A,Neitz S,Magert H J,etal.LEAP-1,a novel highly disulfide-bonded human peptide,exhibits antimicrobial activity[J].FEBS Lett,2000,480:147~150.
[11]Chen S L,Xu M Y,Ji X S,etal.Cloning,Characterization,and expression analysis ofhepcidingene from red sea bream (Chrysophrysmajor)[J].Antimicrob Agents Chemother,2005,49:1608~1612.
[12]Kim Y O,Park E M,Nam B H,etal.Identification and molecular characterization of twohepcidingenes from black rockfish (Sebastesschlegelii)[J].Mol Cell Biochem,2008,315:131~136.
[13]Fu Y M,Li S P,Wu Y F.Identification and expression analysis ofhepcidin-like cDNAs from pigeon (Columbalivia)[J].Mol Cell Biochem,2007,305:191~197.
[14]Huang P,Chen J,Kuo C.Three differenthepcidins from tilapia,Oreochromismossambicus:Analysis of their expressions and biological functions[J].Molecular Immunology,2007,44:1922~1934.
[15]Hu X,Camus A C,Aono S,etal.Channel catfishhepcidinexpression in infection and anemia [J].Comparative Immunology,Microbiology and Infectious Diseases,2007,30:55~69.
Q786
A
1673-1409(2009)02-S052-04
10.3969/j.issn.1673-1409(S).2009.02.015
2009-03-02
李 伟(1976-),男,山东邹城人,理学博士,讲师,研究方向为鱼类分子育种.

