益气养阴活血利水法对兔视网膜脱离后视网膜组织中IL-1β表达的影响
彭清华 ,刘 娉 ,2,彭 俊 ,姚小磊
(1.湖南中医药大学第一附属医院中医眼科学重点学科,湖南 长沙 410007;2.湖南旺旺医院眼科,湖南 长沙 421016;3.南华大学医学院,湖南 衡阳 421001)
益气养阴活血利水法对兔视网膜脱离后视网膜组织中IL-1β表达的影响
彭清华1,刘 娉1,2,彭 俊3,姚小磊1
(1.湖南中医药大学第一附属医院中医眼科学重点学科,湖南 长沙 410007;2.湖南旺旺医院眼科,湖南 长沙 421016;3.南华大学医学院,湖南 衡阳 421001)
目的 研究益气养阴活血利水之复明片对兔实验性视网膜脱离后视网膜组织中IL-1β表达的影响。方法 将72只兔随机分为正常对照组(A组)、模型组(B组)、西药组(C组)、复明片组(D组),每组18只。B、C、D组制作视网膜脱离模型。造模后第1天下午开始给药,A组与B组均予温开水灌胃,C组予西药混合溶液灌胃,D组予复明片混悬液灌胃,5 mL/kg,1次/d。并于造模后7、14、21 d采用S-P免疫组化法检测视网膜组织白介素-1β(Interleukin-1β,IL-1β)的表达。结果 IL-1β在模型组和西药组的神经上皮层阳性表达,在复明片组的神经上皮层弱阳性表达,差异具有统计学意义(P<0.05,P<0.01)。结论 益气养阴活血利水之复明片能抑制视网膜组织中IL-1β的表达。
复明片;益气养阴活血利水法;视网膜脱离模型;白介素-1β;兔;黄芪;生地;茯苓
视网膜脱离(retinal detachment,RD)是指视网膜色素上皮与神经上皮之间的分离,是严重的致盲眼病,可导致眼球萎缩。在众多致盲因素中占第5位,14岁以下儿童占第4位。随着基础研究和手术技巧的日臻完善,特别是玻璃体手术的开展、激光在眼科的应用和玻璃体后脱离研究的深入,RD术后的解剖复位率已明显提高,复位率达90%以上,但术后视功能恢复仍不理想。前期研究发现,益气养阴活血利水法能促进视网膜脱离术后患者视网膜的复位,提高其术后视功能[1]。为了探讨其作用机制,本实验观察了益气养阴活血利水之复明片对兔实验性视网膜脱离后视网膜组织中白介素-1β(Interleukin-1β,IL-1β)表达的影响,现将实验方法及结果报道如下。
1 材料与方法
1.1 材料
1.1.1 动物 成年健康有色家兔72只,体质量2.0~2.5 kg,雌雄各半,由湖南中医药大学实验动物中心提供。动物合格证号:医动字第20-003号。随机分为正常对照组(A 组)、模型组(B 组)、西药对照组(C 组)、复明片组(D组),每组18只。
1.1.2 药物 复明片:由黄芪、生地、茯苓、车前仁、地龙等益气养阴活血利水中药按现代制剂制备工艺制成,0.3 g/片,选用同一批号药物,批号:040208。由湖南中医药大学第一附属医院药剂科提供。使用时去掉糖衣,研成粉末,温开水混合,配制成浓度为10%的混悬液。三磷酸腺苷二钠片(Adenosine Disodium Triphosphate Tablets,ATP):20 mg/片,福建古田药业有限公司生产,批号:050827-1;维生素B1(VitB1):10 mg/片,湖北华中药业有限公司生产,批号:20050801;维脑路通:60 mg/片,山西晋新药业集团有限公司生产,批号:050811。使用时研成粉末,温开水混合,配制成每升水含VitB1276 mg、ATP 1 102 mg、维脑路通734 mg的溶液。透明质酸酶:上海第一生化药研所生产,批号:20050901。
1.1.3 试剂 IL-1测试盒:武汉博士德生物工程有限公司生产;DAB显色试剂盒:武汉博士德生物工程有限公司生产;S-P免疫组化染色超敏试剂盒:武汉博士德生物工程有限公司生产。
1.2 方法
1.2.1 兔眼视网膜脱离模型建立 B、C、D组制作视网膜脱离模型。模型的建立依照彭清华等提出的方法[2],并加以改进。术前3 d用0.25%氯霉素眼药水和1%阿托品眼药水交替滴眼,3次/d,手术当日生理盐水冲洗结膜囊,术前滴1%丁卡因眼药水2~3次。造模时术眼(均取右眼)采用10%新福林和1%阿托品散瞳。3%戊巴比妥耳缘静脉注射(1 mL/kg)麻醉后,将兔固定于手术台上,庆大霉素+生理盐水混合液冲洗结膜囊,常规消毒铺巾、开睑。点丁卡因表面麻醉,下方筋膜下注入2%利多卡因0.2 mL形成泡状隆起,沿角膜缘环行剪开鼻侧球结膜和筋膜,向后稍分离,暴露赤道部巩膜,距角巩缘后5 mm睫状体平坦部用25GB-D针头垂直眼球壁刺穿巩膜,在眼底接触镜和显微镜直视下观察到伸入玻璃体内的针尖,将10 IU/mL透明质酸酶溶液0.1 mL缓慢注入到玻璃体的中央偏后部,拔针后压迫注射点3 min。15 min后再由原穿刺口将自制视网膜下腔注射针头缓慢探进,反复抽吸0.1 mL液化的玻璃体,在眼底接触镜和显微镜直视观察下小心地把针尖引向后极部,避开视网膜血管,在颞侧距视乳头1个视盘直径(Papilla Disc,PD)放射状视网膜处刺穿视网膜,进入视网膜下腔,助手缓慢推动注射器,注入液化的玻璃体液0.1 mL,可见视网膜被分离,脱离的视网膜呈大片灰白色隆起,范围约1/2个PD大小,退出针头,角膜缘处放出房水以降低眼内压。术后铺平球结膜,结膜囊涂0.5%四环素眼膏,结膜下注射庆大霉素加地塞米松0.1 mL,肌内注射庆大霉素0.8万u,以防感染,术后1周氯霉素眼药水点眼,4次/d,并一直给1%阿托品眼液散瞳。
1.2.2 给药方法 造模后第1天下午开始给药,A组(正常对照组)与B组(模型对照组)均予温开水灌胃,5 mL/kg,1 次/d;C 组(西药对照组)予西药(VitB1、ATP、维脑路通)混合溶液灌胃,5 mL/kg,1次/d;D组(复明片治疗组)予复明片混悬液灌胃,5 mL/kg,1次/d。持续用药21 d。
1.3 观察指标及检测方法
实验开始后于造模后的7、14、21 d,依实验安排相应各小组取对应兔6只眼,用3%戊巴比妥耳缘静脉注射(1 mL/kg)麻醉兔,摘除眼球,生理盐水冲洗干净。在冰生理盐水中,沿角巩缘剪开眼球达360°,弃角膜、晶体、玻璃体,保留视网膜连同脉络膜巩膜组织。取相应各小组取对应兔6只眼,将已经4%多聚甲醛固定12 h的眼球壁修片,切取脱离部位视网膜(正常组切取相应部位),再置于新的4%多聚甲醛固定液继续固定,梯度酒精脱水,石蜡包埋,切片,1组切片经常规HE染色,另3组切片采用S-P免疫组化法检测视网膜组织白介素-1β(Interleukin-1β,IL-1β)的表达,DAB 显色,苏木素复染,阴性对照则省去滴加IL-1一抗的步骤。封片后镜检,显微摄影。
视网膜组织中IL-1β测定采用深圳晶美生物技术有限公司提供的双抗夹心法酶联免疫吸附测定 (enzymelinked immunosor-bent assay,ELISA法)检测 IL-1β试剂盒检测(具体操作严格按试剂盒说明书进行)。显色后在450 nm处ELISA读数仪测A值,绘制标准曲线,计算标本中 IL-1β 浓度(pg/mL)。
1.4 统计学分析
采用SPSS for Windows 8.0统计软件,行多元方差及相关分析。
2 结果
2.1 各组视网膜组织中IL-1表达情况
2.1.1 造模后7 d各组视网膜组织中IL-1表达情况 正常组:视网膜组织切片IL-1在神经上皮层呈阴性表达;模型组:IL-1在神经上皮层高表达,着染深,阳性部位面积大;西药组:IL-1在神经上皮层高表达,阳性部位面积较模型组小;复明片治疗组:IL-1在神经上皮层高表达,阳性部位面积较对照组小(图1)。

图1 各组兔视网膜组织中IL-1表达的HE 染色光镜图(×40)
2.1.2 造模后14 d各组视网膜组织中IL-1表达情况 正常组:视网膜组织切片IL-1在神经上皮层呈阴性表达;模型组:IL-1在神经上皮层强阳性表达,阳性部位面积较术后7 d时局限;西药组:IL-1在神经上皮层强阳性表达,阳性部位面积较模型组小;复明片治疗组:IL-1在神经上皮层阳性表达,阳性部位面积较对照组小,已复位部位低表达(图2)。
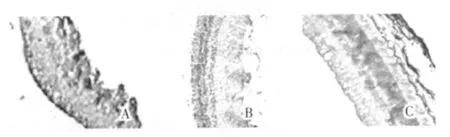
图2 各组兔视网膜组织中IL-1表达的HE 染色光镜图(×40)
2.1.3 造模后21 d各组视网膜组织中IL-1表达情况 正常组:视网膜组织切片IL-1在神经上皮层呈阴性表达;模型组:IL-1在神经上皮层阳性表达,阳性部位面积较术后14 d时局限,缩小;西药组:IL-1在神经上皮层阳性表达,阳性部位面积较模型组小,已复位部位低表达;复明片组:IL-1在神经上皮层弱阳性表达,阳性部位面积较对照组小,已复位部位低表达(图 3)。

图3 各组兔视网膜组织中IL-1表达的HE 染色光镜图(×40)
2.2 造模后各组视网膜组织中IL-1β定量检测
造模后7 d,模型组、西药组、复明片组视网膜组织中IL-1β浓度均明显高于正常组,差异均有统计学意义(P<0.01);造模后14 d,模型组、西药组、复明片组视网膜组织中IL-1β浓度较7 d时下降,但仍高于正常组,差异有统计学意义(P<0.01);造模后 21 d,模型组、西药组、复明片组视网膜组织中IL-1β浓度较14 d时继续下降,但仍高于正常组,差异有统计学意义(P<0.05或0.01)。模型组、西药组、复明片组3组间相比,造模后7、14、21 d,差异均有统计学意义(P<0.05或0.01)。说明复明片组能下调兔视网膜组织中IL-1β浓度,结果见表1。
表1 各组视网膜组织中IL-1β浓度比较(±s,pg/mL)

表1 各组视网膜组织中IL-1β浓度比较(±s,pg/mL)
注:与正常组比较△P<0.05,△△P<0.01;与复明片组比较 *P<0.05,**P<0.01。
分组 眼数(n) 7 d 14 d 21 d A 正常组 6 30.2±11.8 30.2±11.8 30.2±11.8 B 模型组 6 152.4±23.3△△** 121.5±20.2△△** 75.1±13.6△△**C 西药组 6 115.7±17.6△△** 82.3±15.4△△** 52.4±14.1△△*D 复明片组 6 78.1±14.8△△ 55.8±12.3△△ 38.3±10.9△
3 讨论
3.1 视网膜脱离动物模型的评价
视网膜脱离是指视网膜神经上皮层和RPE细胞层的分离,是视网膜和玻璃体的变性相互作用影响的结果,故视网膜裂孔与玻璃体液化、脱离和对视网膜的病理性粘连是RD的3个必备条件。玻璃体呈凝胶状态占眼球3/4容积,主要由直径约8~16 μm呈随机交叉形松散网状结构的Ⅱ型胶原纤维作为支架和结合水分填充其中的透明质酸(Hyaluronic Acid,HA)组成。HA是一种黏多糖物质,能维持玻璃体的黏滞状态,其水化作用和带负电荷的特性使胶原纤维呈双螺旋排列,使凝胶和液体聚合在一起。玻璃体视网膜界面(Vitreoretinal Interface,VRI)由玻璃体后皮质(Posterior Vitreous Cortex,PVC)与视网膜内界膜(Internal Limiting Membrane,ILM)组成。PVC厚约100 μm,主要由Ⅱ型胶原纤维构成,视盘区无PVC,黄斑区PVC较细薄。ILM为视网膜Müller细胞的基底膜,厚约1~2 μm,主要由Ⅳ型胶原与糖蛋白构成。正常玻璃体通过胶原纤维嵌入ILM,使两者紧密结合。视网膜赤道部和后极部PVC胶原纤维与ILM平行,而在玻璃体基底部PVC胶原纤维垂直插入ILM,故玻璃体视网膜粘连最为紧密的部分在玻璃体基底部、视盘周围、大血管附近及黄斑部。VRI的黏附作用主要由糖蛋白包括纤维连接蛋白(Fibronection,FN)、层粘连蛋白(Laminin,LN)及其他糖耦合物介导。其中FN主要与HA和Ⅱ型胶原相关联,LN则与Ⅳ型胶原相关。随着生理或病理条件改变,如年龄增长、高度近视、增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)、手术、创伤、玻璃体炎症、年龄相关性黄斑变性(Age-related Macular Degeneration,AMD)等,可促使胶原纤维和HA变性,HA解析出其中的水分,即凝胶液化形成液化腔,进而多个液化腔不断融合,达到黄斑前玻璃体后界膜时,后界膜破裂,液化腔内液体涌入视网膜玻璃体间隙使之分离,即产生玻璃体后脱离(Posterior Vitreous Detachment,PVD)。一般来讲PVD的形成取决于下述3个过程:玻璃体液化、玻璃体凝缩和VRI粘连的减弱。玻璃体液化、脱离既减弱了对视网膜神经上皮层贴附于色素上皮层的支撑力,又使液化了的玻璃体自裂孔灌注于神经上皮层下,促进RD的形成与维持[3]。如果能形成完全性PVD则源于玻璃体对视网膜的牵引减小,形成RD的机会则减小,而如前文中所述,VRI粘连最为紧密的部分在玻璃体基底部、视盘周围、大血管附近及黄斑部,一般这些部位的粘连松解并不完全,形成牵拉力则促进RD的发生。
已经有多种药物和酶类制剂被用于实验中以期能造成完全性PVD,其中包括胶原酶、硫酸软骨素酶、纤溶酶和透明质酸酶等,它们或因为效果不完全或造成视网膜损害而尚未应用于临床[4-5]。孟自军等[6]认为基质金属蛋白酶-3(Matrix Metalloproteinase-3,MMP-3)能特异性水解FN、LN及蛋白聚糖,同时对Ⅱ、Ⅳ、Ⅸ型胶原有较弱的降解作用,并通过实验研究发现10 ng剂量能在短时间内安全有效地造成PVD,且有较弱的促玻璃体液化作用。硫酸软骨素(Chondroitin Sulfate)酶(CA)亦能在较短的时间内液化玻璃体,并对VRI粘连有一定的破坏作用,诱导PVD的产生[7]。眼内存在纤溶酶原时,注入组织型纤溶酶原激活剂(Tissue Plasminogen Activator,T-PA)可以激活眼内的纤溶酶原转化成纤溶酶以分解FN和LN,并激活胶原酶与FN的降解产物一起趋化多形核白细胞,使其释放弹性蛋白酶,分解Ⅳ型胶原[8];此外,t-PA还可水解细胞外基质(Extra Cellular Matrix,ECM)以促成玻璃体液化[9]。猪眼注入t-PA50 μg,在破坏血-眼屏障后可诱导PVD的发生。玻璃体腔内注入1 U纤溶酶后可降解FN、LN,且对视网膜结构和功能没有任何不良影响,第1天开始即有PVD发生,第3天时效果更佳,并随注入的增加,效果增强[10]。纤溶酶联合透明质酸酶或SF6则较单独采用纤溶酶更能迅速有效的诱发完全性PVD,且对视网膜无明显的毒性作用。分散酶亦能诱导出PVD,但0.025 U及以上剂量能导致晶状体和视网膜损伤。透明质酸酶联合C2F6玻璃体腔注药诱导完全性PVD的发生,亦无眼内毒性。10 IU/0.1 mL和20 IU/0.1 mL的透明质酸酶玻璃体腔注射后第5周亦可形成PVD,并且安全有效[11]。尿激酶1 000 U联合透明质酸酶20 U兔眼玻璃体腔内注射亦能诱导完全性PVD,且无眼内毒性[12]。Dispase是一种从多粘芽孢杆菌提取的中性蛋白酶,对于FN和IV型胶原有特异性溶解作用,从而松解VRI粘连安全、有效地诱导出PVD,但大剂量时有一定毒性作用[13]。
视网膜脱离动物模型可以建立在猴、猫、兔、狗等动物上,就是将RPE细胞层与神经上皮层分离。其中Labrador Retrievers模型是一种轴性近视、白内障、玻璃体异常和视网膜裂孔为特征的遗传性疾病的狗,有人认为其与人自发性的视网膜巨大裂孔相似。人为RD造模方法亦多样,依注入视网膜下的物质种类不同有生理盐水、血液、透明质酸钠、液化玻璃体等。70年代曾使用透明质酸酶液化玻璃体后,反复抽吸接近视网膜的玻璃体造成裂孔和RD。牟国营等[14]采用透明质酸酶3 000 U注入兔眼视网膜表面,抽取局部玻璃体0.2 mL再缓慢注入,反复3~5次,最后抽取0.3 mL快速冲击视网膜,借助高速液流冲破视网膜形成视网膜裂孔。孙晓东[15]则提出在兔眼视网膜下直接注射透明质酸钠的方法建立动物模型。刘铁城等[16]取猫眼行晶体囊外摘除、玻璃体切除术,3周后持尖端直径约50~70 μm的玻璃微穿刺针,刺入神经视网膜和RPE细胞层之间,将Healon缓慢注入到视网膜下腔,造成局部RD。张自峰等[17]通过剪除兔眼部分玻璃体,在显微镜和接触镜直视下将连有1 mL注射器的玻璃微管,自扁平部对兔视网膜下注血,造成出血性RD。王建洲等[18]则采用剪除部分玻璃体用间接检眼镜简捷方法,结合顶压定位裂孔,将连有1 mL注射器的玻璃微管,自扁平部对兔视网膜下注生理盐水0.5 mL,并尽量抽出裂孔附近的部分玻璃体,人为的造成玻璃体液化腔的方法造模。亦可以将这些方法分为内路法和外路法,如彭清华等RD复位动物模型的建立中所述。
本实验参照彭清华等的造模方法,并加以改进,用透明质酸酶液化玻璃并取少许注入视网膜下,并通过液化的玻璃体在不行晶状体及玻璃体切除的情况下延长RD时间以观察RD后的增殖情况,同时玻璃体液化更接近临床实际。
3.2 复明片对视网膜组织中白介素-1β(IL-1β)的影响
IL-1β是重要的免疫和炎性反应调节物,也是炎性致病机制的决定因子,是最具多效性的细胞因子之一,且几乎对所有的体内细胞发生作用,其少量的受体与配基的结合足够诱发一个完全的反应[19]。马志中等研究表明IL-1β表达的高峰出现在RD后第7天,然后维持在较低的表达状态,IL-1β抗体可以阻止PCNA的表达,抑制RD后的增殖反应[20]。本实验结果显示:与模型组、西药组对比,造模后7、14、21 d,复明片组IL-1β在神经上皮层阳性表达部位面积较小;视网膜组织中IL-1β浓度定量检测亦显示,造模后7、14、21 d,复明片组视网膜组织中IL-1β浓度均明显低于模型组、西药组,差异均有统计学意义(P<0.01)。说明益气养阴活血利水之复明片组能下调视网膜脱离后视网膜组织中IL-1β浓度,抑制视网膜脱离后视网膜组织中IL-1β表达,进而抑制细胞增殖,阻止视网膜脱离后PVR的形成和发展,促进视功能的恢复。
[1]彭清华,范艳华,段国平,等.益气养阴活血利水法治疗视网膜脱离术后的临床研究[J].湖南中医药大学学报,2009,29(1):47-49.
[2]彭清华,朱志容,陈 吉,等.视网膜脱离复位动物模型的建立[J].中国中医眼科杂志,2005,15(2):77-79.
[3]李凤鸣.中华眼科学[M].北京:人民卫生出版社,2004:2 182.
[4]Hesse L,Kroll P. Enzymatically induced posterior vitreous detachment in proliferative diabetic vitreoretinopathy[J].Klin Monatsbl Augenheilkd,1999,214(2):84-89.
[5]Unal M,Peyman G A.The efficacy of plasminogen-urokinase combination in inducing posterior vitreous detachment[J].Retina,2000,20(1):69-75.
[6]孟自军,曾水清.基质金属蛋白酶-3对兔眼玻璃体及玻璃体视网膜界面的影响[J].中华眼底病杂志,2004,20(2):111-114.
[7]孟自军,曾水清.联合应用软骨素酶和基质金属蛋白酶3诱导产生玻璃体后脱离的实验研究[J].中华眼科杂志,2004,40(9):625-631.
[8]Verstraeten T C,Chapman C,Hartzer M,et al.Pharmacologic induction of posterior vitreous detachment in the rabbit[J].Arch Ophthalmol,1993,111(6):849-854.
[9]Le Mer Y,Korobelnik J F,Morel C,et al.TPA-assisted vitrectomy for proliferative diabetic retinopathy:Resultsof a double-masked,multicenter trial[J].Retina,1999,19(5):378-382.
[10]秦 波,姜德咏,郭小健,等.兔眼玻璃体腔内注射纤维蛋白溶酶诱导产生玻璃体后脱离[J].眼科研究,2003,21(2):163-165.
[11]颜 华,王 辉.透明质酸酶诱导玻璃体后脱离的实验研究[J].眼外伤职业眼病杂志,2004,26(1):1-3.
[12]刘 刚,鄢秀菊,陈宗贤,等.尿激酶联合透明质酸酶诱导兔眼玻璃体后脱离的实验研究[J].国际眼科杂志,2005,5(6):1 164-1 167.
[13]汪枫桦,张 皙,孙晓东,等.Dispase诱发兔眼玻璃体后脱离的效果和安全性评价[J].眼科研究,2003,21(2):121-124.
[14]牟国营,崔长霞,国纪林.实验性视网膜脱离模型的建立[J].山东大学基础医学院学报,2002,16(6):360-361.
[15]孙晓东,陈荣家.视网膜脱离模型的实验研究[J].眼视光学杂志,2000,2(3):153-155.
[16]刘铁城,马志中,刘百臣,等.利用微穿刺技术建立猫实验性视网膜脱离及复位模型[J].解放军医学杂志,2003,28(3):262-263.
[17]张自峰,王雨生,惠延年,等.出血性视网膜脱离模型的建立[J].中华眼底病杂志,2003,19(3):175-178.
[18]王建洲,惠延年,王雨生,等.一种简易的兔视网膜脱离模型[J].眼科新进展,2004,24(5):352-354.
[19]O'Neill LA.Towards an understanding of the signal transduction pathways for interleukin 1 [J].Biochim Biophys Acta,1995,1266(1):31-44.
[20]卢 华,马志中,刘 敬,等.视网膜脱离大鼠视网膜核增殖抗原表达与白细胞介素-1β的关系 [J].中国康复理论与实践,2004,10(5):276-278.
Effects of Yiqi Huoxue Yangyin Lishui therapy on expression of IL-1β in retinal tissue after retinal detachment in rabbits
PENG Qing-hua,LIU Ping,PENG Jun,YAO Xiao-lei
(Key Discipline of TCM Ophthalmology,First Affiliated Hospital,TCM University of Hunan,Changsha,Hunan 410007,China)
ObjectiveTo investigate the effects of Fuming tablets(FMT)with the functions of qi-benefitting,yin-nourishing,blood-invigorating and diuresis on the expression of IL-1β in the retinal tissue after detachment of the retina of rabbits.Methods72 rabbits were divided randomly into normal control group(group A),model group(group B),western medicine group(group C)and FMT group(group D),18 rabbits per group.In group B,C and D the rabbits were made the retinal detachment models and then given medicine after modeling 1 day.In group A and B,they were administrated with warm water,in group C with western medicine solution,and in group D with FMT suspension,5 mL/kg,once a day.Then the expression ofInterleuk in-1β(IL-1β)was detected with s-p method after modeling 7th day,14th day and 21st day.ResultsThere were the positive expressions of IL-1β in the neurosensory in model group and medicine control group and weak positive in FMT group.Conclusions FMT can decrease the expression of IL-1β in the retinal tissue.
Fuming tablets;Yiqi Huoxue Yangyin Lishui therapy;retinal detachment model;interleukin-1β(IL-1β);rabbits;Radix astragal;Rhizome of rehmannia;Poria cocos
R285.5
A
10.3969/j.issn.1674-070X.2010.11.006.018.05
2010-08-01
湖南省自然科学基金资助项目(06JJ50056);湖南省教育厅科研基金资助项目(10A094,98B078,06A052);国家中医药管理局中医眼科学重点学科建设项目;湖南省中医五官科学重点学科建设项目。
彭清华(1964-),男,湖南宁乡人,医学博士,教授、主任医师、博士生导师,主要从事中西医结合防治眼底病、青光眼和眼表疾病的研究。E-mail:pqhz_520@163.com。
(本文编辑 彭芝配)

