Lewis肺癌细胞通过TLR9对CD4+CD25+Treg细胞影响的研究
李 欣 付海英 张佳伦 李 一 (吉林大学白求恩医学院免疫学教研室,长春 130021)
Lewis肺癌细胞通过TLR9对CD4+CD25+Treg细胞影响的研究
李 欣①付海英 张佳伦 李 一 (吉林大学白求恩医学院免疫学教研室,长春 130021)
①长春中医药大学微生物与免疫学教研室,长春130021
目的:本研究以Lewis肺癌细胞为研究对象,探讨肿瘤细胞通过TLRs对CD4+CD25+Treg细胞的影响。方法:我们采用流式细胞术检测了Lewis肺癌细胞与脾淋巴细胞共培养系统中CD4+CD25+Treg细胞数量变化;通过RT-PCR方法检测了共培养对Foxp3和TLR1-9mRNA表达的影响;采用TLR9受体阻断剂氯喹阻断Lewis肺癌TLR9的表达。结果:与对照组相比,共培养组CD4+CD25+Treg细胞数量及Foxp3mRNA表达均明显增高(P<0.05);Lewis肺癌细胞与淋巴细胞共培养后可影响多种TLRs表达,其中TLR9mRNA表达与对照组相比明显增高(P<0.05),阻断Lewis肺癌细胞TLR9可明显降低CD4+CD25+Treg细胞数量及Foxp3mRNA表达(P<0.05)。结论:Lewis肺癌细胞可通过TLR9促进CD4+CD25+Treg细胞产生及功能增强,参与诱导肿瘤的免疫耐受,从而促进肿瘤的发生和发展。
CD4+CD25+Treg细胞;Foxp3;TLRs;肿瘤免疫
免疫系统的功能之一免疫监视在清除肿瘤细胞方面发挥着重要作用,但不断上升的临床肿瘤发生率使人们对免疫监视功能的存在、效应及影响因素开始重新审视。肿瘤细胞可通过某些机制诱导肿瘤细胞的耐受,逃避免疫监视而在机体内生长、转移。其中CD4+CD25+Treg细胞在肿瘤免疫中作用尤为引人关注[1,2],是影响体内抗肿瘤效果的主要因素,对其深入研究有助于揭开人体肿瘤免疫之谜。CD4+CD25+Treg细胞可通过细胞接触依赖机制或抑制性细胞因子依赖机制主动抑制自身反应性T细胞的活化,由CD4+CD25+Treg细胞介导的对自身反应性细胞的调节是自身免疫耐受建立的重要机制之一。由于肿瘤抗原是自身抗原量或质的改变,因此,推测CD4+CD25+Treg细胞在维持自身耐受的同时,也可能在肿瘤耐受中发挥作用。
Toll样受体(Toll-like receptors,TLRs)是一种重要的模式识别受体,作为天然免疫的重要组成部分及连接获得性免疫与天然免疫的“桥梁”,主要通过识别病原相关分子模式来启动免疫应答。目前研究发现抗原提呈细胞(Antigen present cell,APC)上TLR9表达增强,可诱导CD4+CD25+Treg细胞的产生及功能增强。有研究报道肿瘤细胞也可以表达多种TLRs[3],在肿瘤发生发展过程中发挥作用。我们推测表达在肿瘤细胞表面的TLRs是否与APC上TLRs作用相似,可通过影响CD4+CD25+Treg细胞功能,在肿瘤耐受、逃避免疫监视中发挥作用。因此,本研究以Lewis肺癌细胞为研究对象,探讨肿瘤细胞通过TLRs对CD4+CD25+Treg细胞的影响,为肿瘤免疫逃逸机制提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 近交系C57BL/6小鼠,体重18~22克,4~6周龄,由吉林大学实验动物中心提供。
1.1.2 细胞 小鼠Lewis肺癌细胞株,由教研室传代保存。
1.1.3 试剂 IMDM干粉培养基购自Gibco公司;新生小牛血清购自杭州四季清公司;小鼠PE-anti-CD25+及FITC-anti-CD4+抗体购于BD公司;PE-anti-TLR9抗体购于Imagnix公司;Trizol试剂购自Gibco公司;AMV逆转录酶、RNasin与Ex Tag DNA聚合酶均购自TaKaRa公司;氯喹(CQ)购自上海中西制药有限公司。
1.2 方法
1.2.1 Lewis肺癌细胞与淋巴细胞共培养体系的建立 将5×105个Lewis肺癌细胞与1×106个小鼠脾淋巴细胞共培养于6孔板,共培养48小时后用于检测,脾淋巴细胞单独培养作为对照。
1.2.2 共培养后CD4+CD25+Treg细胞含量的测定
取共培养及阻断TLR9后共培养上清1×106个细胞(100μl体积),加入 PE-anti-CD4+和 FITC-anti-CD25+抗体,用流式细胞仪检测脾脏CD4+CD25+Treg细胞数量,以CD4+CD25+T细胞占CD4+T细胞百分比反映CD4+CD25+Treg细胞含量。
1.2.3 TLR9受体阻断剂氯喹(CQ)阻断后TLR9含量的测定 Lewis肺癌细胞贴壁4小时后加100μg/m lCQ,每孔 1 ml,继续培养1小时;将上清吸弃,Hanks液洗两遍,将CQ除去;流式检测阻断 1、2、24小时后TLR9含量。
1.2.4 共培养后Foxp3和TLRsmRNA表达的检测
用Trizol试剂提取共培养后淋巴细胞总RNA,并进行逆转录反应。cDNA的逆转录采用TaKaRa的AMV RTase,按说明书进行操作。通过预实验确定PCR反应条件和最适循环数,以保证PCR产物量与起始cDNA量呈线性相关,引物序列见表1。选取βactin为内参照,取5μl PCR产物用1.5%的普通琼脂糖凝胶电泳后,凝胶电泳成像系统观测成像情况。
2 结果
2.1 Lewis肺癌细胞与淋巴细胞共培养对CD4+CD25+Treg细胞数量和功能影响 为了探讨肿瘤免疫微环境中肿瘤细胞与免疫细胞相互作用对CD4+CD25+Treg细胞数量和功能的影响,我们采用FACS检测了Lewis肺癌细胞与淋巴细胞共培养后CD4+CD25+Treg细胞数量变化;转录因子Foxp3特异性高表达于CD4+CD25+Treg细胞,可作为CD4+CD25+Treg细胞较特异的标志,而且还与CD4+CD25+Treg细胞分化及功能密切相关,因此常作为CD4+CD25+Treg细胞功能指标之一,为进一步研究肿瘤细胞对CD4+CD25+Treg细胞功能影响,我们采用RT-PCR方法检测了共培养后收集的淋巴细胞的Foxp3 mRNA表达水平。结果显示:Lewis肺癌细胞与淋巴细胞共培养后,可明显提高CD4+CD25+Treg细胞数量,共培养组与对照组CD4+CD25+Treg细胞含量分别为10.8±1.45、3.8±1.69,差异具有显著性P<0.05,见图1;共培养后Foxp3 mRNA表达水平明显提高,共培养组与对照组Foxp3 mRNA表达水平分别为0.35±0.10、0.23±0.15,差异具有显著性P<0.05,见图2。结果提示肿瘤细胞可能通过某种机制影响CD4+CD25+Treg细胞。

表1 引物序列Tab.1 Primer sequences
2.2 Lewis肺癌细胞与淋巴细胞共培养后TLRs表达变化 已有研究发现肿瘤细胞可表达TLRs,可能参与肿瘤的免疫逃逸,为探讨TLRs在肿瘤免疫中的作用,我们采用RT-PCR方法检测了Lewis肺癌细胞与淋巴细胞共培养,TLRs表达变化。结果显示Lewis肺癌细胞与淋巴细胞共培养48小时后,TLR4、TLR5有所增高,TLR9增高明显,TLR7、8不表达,其他TLRs变化不明显,见图3。结果表明TLRs在肿瘤细胞与淋巴细胞共培养后表达不同,推测其可能在CD4+CD25+Treg细胞的诱导中发挥作用。
2.3 Lewis肺癌细胞表达的TLR9对CD4+CD25+Treg数量和功能影响
2.3.1 TLR9受体阻断剂氯喹(CQ)阻断效果检测为了研究Lewis肺癌细胞TLR9功能,我们选择氯喹(CQ)作为其阻断剂,首先验证CQ阻断效果,采用流式细胞术检测CQ阻断后TLR9表达变化,结果显示100μg/ml CQ阻断后可明显降低TLR9蛋白表达,并随时间延长阻断效果越明显,见图4。结果提示100 μg/ml CQ可作为TLR9阻断剂进行下一步实验。
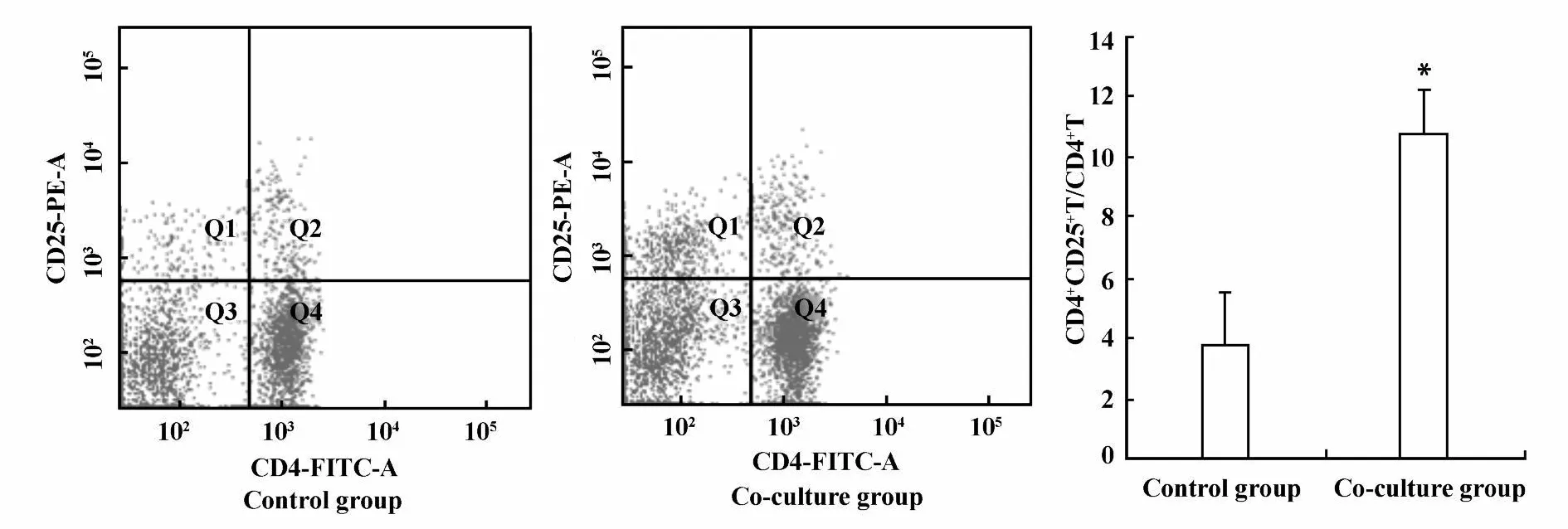
图1 Lewis肺癌细胞与淋巴细胞共培养后Treg细胞数量变化Fig.1 The changes of CD4+CD25+T cells number after Lewis lung cancer cells co-cu lture with lymphocyte
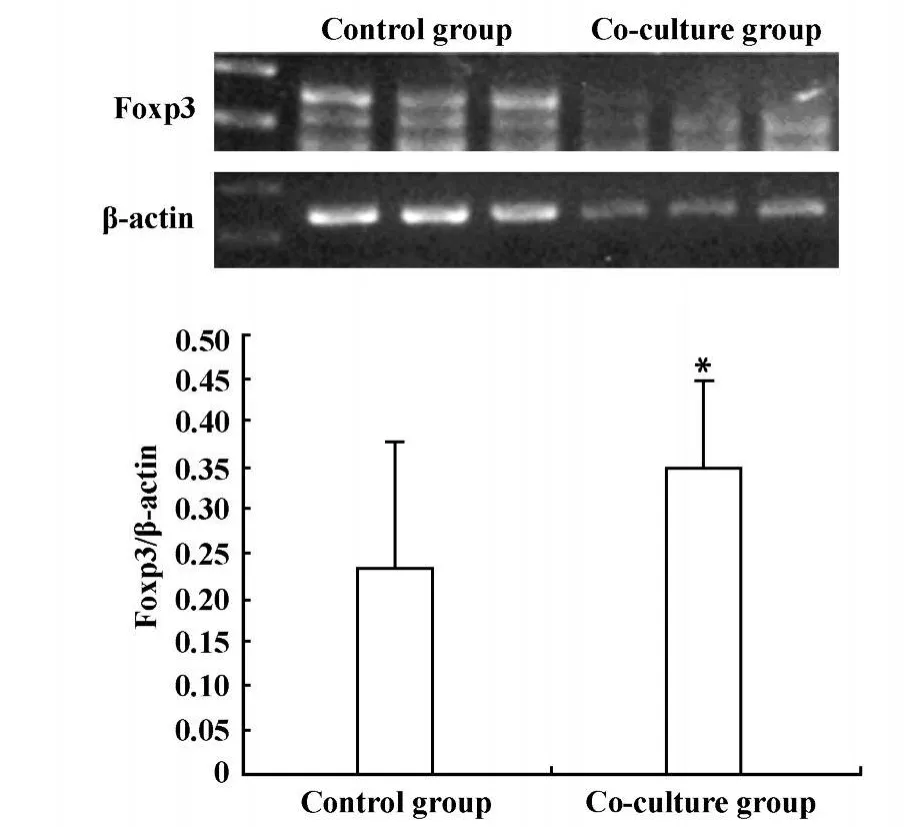
图2 Lewis肺癌细胞与淋巴细胞共培养后Foxp3m RNA变化Fig.2 The expressionsof Foxp3mRNA after Lewis lung cancer cells co-culture with lymphocyte

图3 Lewis肺癌细胞与淋巴细胞共培养后TLRsmRNA变化Fig.3 The expressions of TLRsmRNA after Lewis lung cancer cells co-culture with lymphocyte

图4 CQ阻断后TLR9表达Fig.4 The expressions of TLR9 after CQ blocking
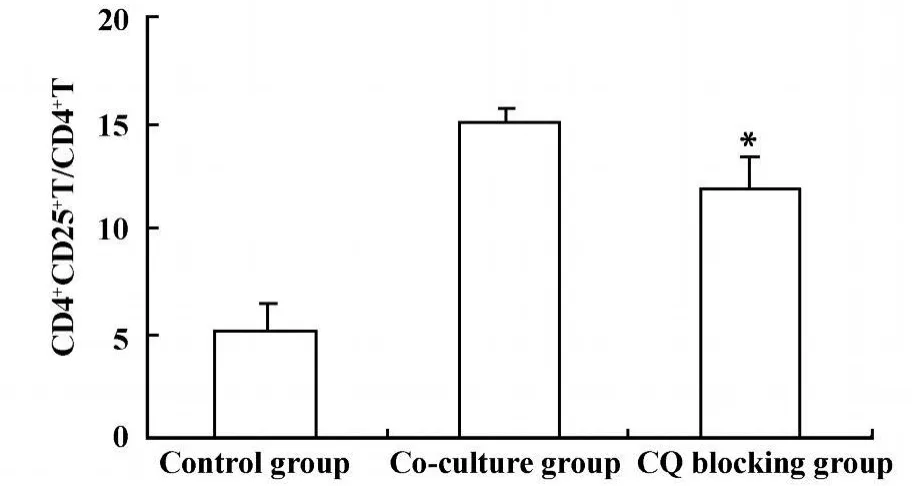
图5 CQ阻断后TLR9后 CD4+CD25+Treg细胞数量变化Fig.5 The comparison the CD4+CD25+Treg cells frequency after CQ b locking
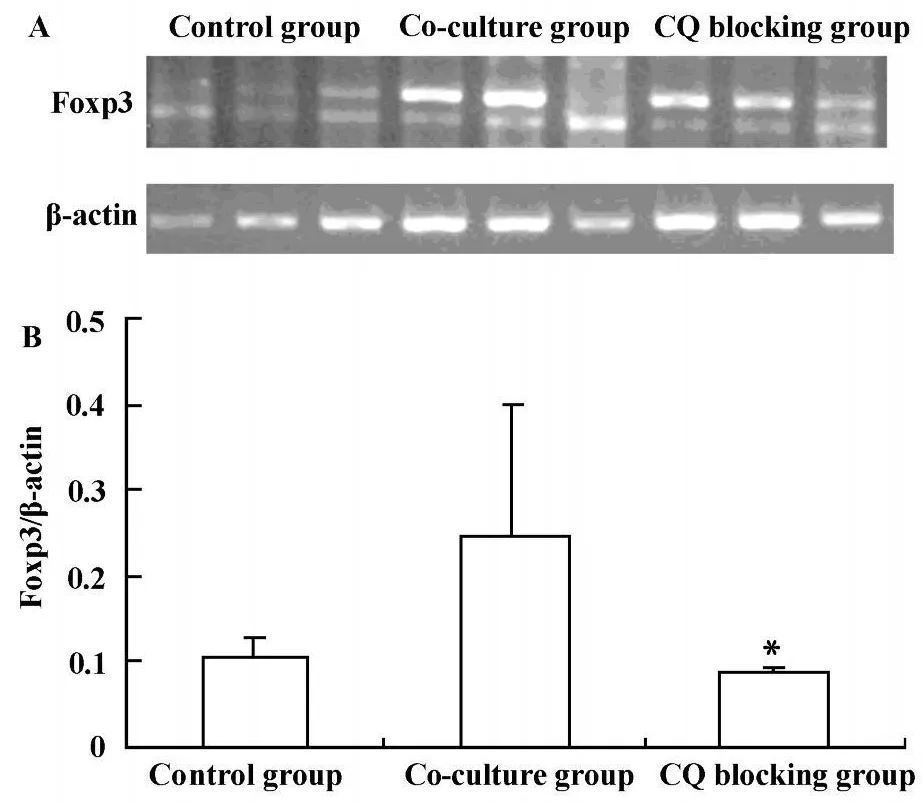
图6 CQ阻断后TLR9后Foxp3 mRNA变化Fig.6 The expressions of Foxp3mRNA after CQ blocking
2.3.2 氯喹(CQ)阻断TLR9后Lewis肺癌细胞对CD4+CD25+Treg数量和功能的影响 为了进一步探讨Lewis肺癌细胞TLR9对CD4+CD25+Treg细胞的影响,我们采用 FACS检测CQ阻断 TLR9后,CD4+CD25+Treg细胞数量变化,采用RT-PCR方法检测CQ阻断TLR9后Foxp3mRNA的变化,间接反映CD4+CD25+Treg细胞功能变化。结果显示CQ阻断TLR9后可降低CD4+CD25+Treg细胞数量,共培养组、CQ阻断组及对照组CD4+CD25+Treg细胞数量分别为 15%±0.78%、12%±1.46%、5.1%±1.41%,差异具有显著性(P<0.05),见图5;CQ阻断TLR9后可明显降低Foxp3mRNA表达,共培养组、CQ阻断组及对照组Foxp3 mRNA表达分别为0.247±0.158、0.084±0.008、0.103 ±0.029,差异具有显著性(P<0.05),见图6。结果提示肿瘤细胞可能通过TLR9诱导CD4+CD25+Treg细胞,参与维持肿瘤免疫耐受,从而促进肿瘤的发生和发展。
3 讨论
自1995年Sakaguchi等人首先提出CD4+CD25+调节性T细胞(Regulatory T cells,Treg)之后,引起了免疫学界越来越多的关注,先后对其进行了广泛的研究[4]。CD4+CD25+Treg细胞主要在机体免疫系统中发挥负向调节作用,既能抑制不恰当的免疫应答,又能限定免疫应答的范围、程度及作用时间,对效应细胞的增殖、免疫活性的发挥起抑制作用。由于肿瘤抗原是自身抗原量或质的改变,因此,CD4+CD25+Treg细胞在维持自身耐受的同时,也可能抑制肿瘤免疫应答的发生。有研究报道卵巢癌、肺癌、乳腺癌、胰腺癌、结肠癌等多种肿瘤患者的外周血及肿瘤局部Treg细胞比例增加[5-7],在肿瘤动物模型中亦发现在肿瘤外周及肿瘤局部Treg细胞比例增加,功能增强[8],因此,由肿瘤细胞所引起的CD4+CD25+Treg细胞产生及功能增强可能是肿瘤逃避免疫监视机制之一。
肿瘤局部免疫微环境中,可见大量的免疫细胞聚集,这些聚集在肿瘤局部的免疫细胞一方面在肿瘤清除的免疫监视中发挥重要作用;另一方面,有些免疫细胞如调节性T细胞很可能在肿瘤的免疫逃逸中发挥作用,但其具体机制还不清楚。因此,本文我们以Lewis肺癌细胞与淋巴细胞共培养系统为研究对象,探讨了肿瘤细胞对CD4+CD25+Treg细胞的影响及其可能机制。结果显示,虽然Lewis肺癌细胞与淋巴细胞共培养体系中,脾淋巴细胞可对Lewis肺癌细胞有自然杀伤作用,但本研究发现Lewis肺癌细胞可促进CD4+CD25+Treg数量增加,功能增强,提示肿瘤细胞可能通过某种机制影响CD4+CD25+Treg细胞,参与诱导肿瘤免疫耐受,从而逃避免疫系统的攻击。
Toll样受体(Toll-like receptors,TLRs)作为一类重要模式识别受体(Pattern recognition receptor,PRR),主要表达于免疫细胞尤其是巨噬细胞和树突状细胞上。其功能主要是识别存在于细菌、真菌、病毒和原虫等病原微生物中的病原相关分子模式(Pathogen associated molecular patterns,PAMPs),在免疫系统对病原微生物的识别和启动免疫应答过程中发挥了重要的作用。有研究发现抗原提呈细胞(Antigen presenting cells,APC)上TLR9表达增强,可诱导CD4+CD25+Treg细胞的产生及功能增强[3,9]。因此,TLRs不但参与免疫应答的启动,还可以通过影响CD4+CD25+Treg细胞参与免疫应答的负调节。
近年来,在人们对免疫系统中的TLRs研究的过程中,还发现了肿瘤细胞也可以表达多种TLRs,在肿瘤发生发展过程中发挥着重要的作用。有研究报道人乳腺癌Cama-1[10]和黑色素瘤Me260[11]表达的TLR3可以促进肿瘤细胞的凋亡,小鼠结肠癌MC26[12]表达的TLR4可以促进肿瘤的耐受,鼠乳腺癌D2F2表达的TLR5在早期促进肿瘤生长,而晚期抑制肿瘤生长。所以,肿瘤细胞的TLRs的表达可能在一定程度上参与了肿瘤的发生发展。因此,我们首先研究了Lewis肺癌细胞与淋巴细胞共培养后TLRs表达变化。研究发现Lewis肺癌细胞与淋巴细胞共培养后TLR9表达升高明显。肿瘤细胞表达TLR9是否与APC表达TLR9具有相同影响CD4+CD25+Treg细胞的功能呢?为此,我们利用氯喹(CQ)阻断 Lewis肺癌细胞 TLR9后,观察 CD4+CD25+Treg细胞的数量和功能。结果显示阻断Lewis肺癌细胞TLR9,可降低CD4+CD25+Treg细胞数量和功能,提示肿瘤细胞可能通过TLR9直接或间接诱导CD4+CD25+Treg细胞的产生和功能增强,参与肿瘤免疫耐受的诱导与维持。
综上,我们研究发现在体外Lewis肺癌细胞可促进CD4+CD25+Treg细胞数量增加,功能增强;Lewis肺癌细胞可表达多种TLRs,并参与促进CD4+CD25+Treg细胞的产生及功能增强,从而在肿瘤免疫耐受中发挥重要作用。本研究初步探讨了TLRs在肿瘤发生发展中的作用,为以通过TLRs调控CD4+CD25+Treg细胞为靶点的肿瘤免疫治疗提供了新的思路。
1 Nizar S,Copier J,Meyer Betal.T-regulatory cellmodulation:the future of cancer immunotherapy?[J].Br JCancer,2009;100(11):1697-1703.
2 BeyerM,Schultze J L.Regulatory T cells:major players in the tumormicroenvironment[J].Curr Pharm Des,2009;15(16):1879-1892.
3 Moseman E A,Liang X,Daw son A Jetal.Human plasmacytoid dendritic cells activated by CpG oligodeoxynucleotides induce the generation of CD4+CD25+regulatory T cells[J].J Immunol,2004;173(7):4433-4442.
4 Sakaguchi S,Sakaguchi N,Asano Metal.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25):breakdown ofa singlemechanism of self-tolerance causesvarious autoimmune diseases[J].J Immunol,1995;155:1151-1164.
5 Liyanage UK,Moore T T,JooH Getal.Prevalenceof regulatory T cells is increased in peripheral blood and tumor microenvironment of patientswith pancreas orbreast adenocarcinoma[J].J Immunol,2002;169(5):2756-2761.
6 Wolf AM,Wolf D,Steurer Metal.Increase of regulatory T cells in the peripheralblood of cancer patients[J].Clin Cancer Res,2003;9(2):606-612.
7 崔永生,李 欣,于春雷etal.肺癌和乳腺癌患者外周血中CD4+CD25+T细胞及 foxp3mRNA的变化特点及临床意义[J].吉林大学学报医学版,2006;32(5):843-846.
8 李 欣,崔永生,王 炎etal.CD4+CD25+调节性T细胞在Lewis肺癌移植鼠中的检测及临床意义[J].现代肿瘤医学,2007;15(4):454-457.
9 Mellor A L,Baban B,Chandler P Retal.Cutting edge:CpG oligonucleotides induce splenic CD19 dendritic cells to acquire potent indoleamine 2,3-dioxygenase-dependent T cell regulatory functions via IFN type 1 signaling[J].J Immunol,2005;175:5601-5605.
10 Bruno S,Isabelle C,Marie-Clotilde Retal.TLR3 can directly trigger apoptosis in human cancer cells[J].J Immunol,2006;176:4894-4901.
11 Bruno S,Serge L,Sampsa Metal.Toll-like receptor 3 expressed by melanoma cellsas a target for therapy[J].Clin Cancer Res,2007;13(15):4565-4574.
12 Lucia S,Anna R,Dario Betal.Antitumor activity of the TLR-5 ligand flagellin in mousemodels of cancer[J].J Immunol,2006;176:6624-6630.
[收稿2009-07-18 修回2009-09-09]
(编辑 张晓舟)
Lew is lung cancer cells affect CD4+CD25+Treg cells via TLR9
LIXin,FUHai-Ying,ZHANGJia-Lun,LIYi.DepartmentofImmunology,BethuneMedicalCollege,JilinUniversity,Changchun130021,China
Objective:To explore the influence of tumor cells on CD4+CD25+Treg cells via TLRs.Methods:The numbers changes of CD4+CD25+Treg cells in the co-culture system of Lewis lung cancer cells and splenic lymphocyteswere detected by flow cytometry;The expression of Foxp3 and TLR1-9mRNA after co-cu lturewere detected by RT-PCR;TLR9 expression on Lewis lung cancer cellswas blocked by TLR9 receptor antagonist chloroquine.Results:Compared with control group,the number of CD4+CD25+Treg cells and Foxp3mRNA expression were significantly increased in the co-culturegroup(P<0.05).The expression of a variety of TLRswere affected by the co-culture of lymphocyteswith Lewis lung cancer cells,and TLR9mRNA expression was significantly increased comparedwith thatof the control group(P<0.05);Blocking TLR9 of Lewis lung cancer cells significantly reduce CD4+CD25+Treg cells and Foxp3 mRNA(P<0.05).Conclusion:Lewis lung cancer cells could increase both number and function of CD4+CD25+Treg cells through inducing TLR9 expression in immunocells.Thismightbe one ofmechanisms of tumor-induced immune tolerance,and by which to contribute to the occurrence and p rogression of tumors.
CD4+CD25+Treg cells;Foxp3;TLRs;Tumor immunity
R392
A
1000-484X(2010)02-0124-05
李 欣(1979年-),女,在读博士,主要从事肿瘤免疫耐受研究;
及指导教师:李 一(1961年-),女,教授,博士生导师,主要从事自身免疫耐受研究。

