人喉癌长春新碱耐药细胞株的建立及其生物学特性①
尹万忠 王 苹 祝 威 (吉林大学第一医院耳鼻咽喉-头颈外科,长春 130021)
人喉癌长春新碱耐药细胞株的建立及其生物学特性①
尹万忠 王 苹 祝 威 (吉林大学第一医院耳鼻咽喉-头颈外科,长春 130021)
目的:建立人喉癌长春新碱多药耐药细胞系。方法:以药物浓度梯度递增法诱导筛选人喉癌Hep-2的多药耐药细胞株Hep-2/v,比较两组细胞的形态和倍增时间;MTT法确定细胞的IC50及其耐药指数;流式细胞仪检测两组细胞的细胞周期分布以及细胞内的罗丹明聚集情况;实时定量RT-PCR法检测MDR1基因的mRNA表达,Western blot法检测相应的蛋白表达情况。结果:建成的Hep-2/v耐药细胞株,其耐药性能稳定,耐药指数为45,并与顺铂及5-氟尿嘧啶有不同程度的交叉耐药性;Hep-2/v的体外群体细胞倍增时间较亲代细胞延长13.58小时;细胞周期分析结果显示其G0/G1期细胞升高,而S期细胞则明显降低(P<0.05);罗丹明染色显示,Hep-2细胞内的罗丹明较Hep-2/v明显升高(P<0.01);Hep-2/v细胞MDR1表达在基因及蛋白水平明显高于Hep-2细胞(P<0.01)。结论:Hep-2/v细胞株具有明确及稳定的多药耐药性,是研究多药耐药机制及筛选逆转剂的良好模型。
喉肿瘤;长春新碱;多药耐药
肿瘤的多药耐药性(Multidrug resistance,MDR)是指肿瘤细胞对一种抗肿瘤药物产生耐药性的同时,对结构和作用机理完全不同的其它多种抗肿瘤药物产生交叉耐药性,多药耐药性已成为化疗失败的重要原因之一,因此逆转MDR成为肿瘤研究中的重要课题。而建立多药耐药细胞系是研究肿瘤多药耐药性的基础。本实验采用长春新碱,以药物浓度梯度递增法诱导建立人喉癌多药耐药细胞系,以进一步研究肿瘤的多药耐药性及逆转治疗。
1 材料与方法
1.1 材料
1.1.1 细胞株 人喉癌Hep-2细胞系由中国医学科学院提供。
1.1.2 试剂 长春新碱(VCR)、顺铂(DDP)、二甲基四氮唑蓝(MTT)、二甲基亚砜(DMSO)、碘化丙啶(PI)及Rhodmine123购自Sigma公司;5-氟尿嘧啶(5-Fu)购自Lic公司;RPMI1640培养基、小牛血清及胰蛋白酶购自Invitrogen公司;MDR1抗体购自Chem icon公司;PVDF膜购自Millipore公司;实时荧光定量PCR试剂盒购自CapitalBio公司,实验中所有引物均在Invitrogen公司合成。
1.2 方法
1.2.1 细胞培养 人喉癌Hep-2细胞加入培养液为含10%小牛血清、青霉素和链霉素各100 U/m l的RPM I1640培养液中,置 37℃、5%CO2、饱和湿度的培养箱中培养。0.25%的胰蛋白酶消化传代。
1.2.2 细胞多药耐药性的诱导 筛选药物为VCR,以喉癌Hep-2细胞为亲本细胞,采用药物浓度梯度递增法诱导筛选耐药细胞。首先用MTT法测定VCR对喉癌亲本细胞的半数抑制浓度(IC50)为0.04 μmol/L。首次加药浓度为0.02μmol/L VCR,待细胞稳定生长并传代后,逐步提高药物的浓度,历时12个月后,细胞可在0.96μmol/L浓度中稳定生长。MTT法测定IC50为1.8μmol/L,诱导筛选的耐药细胞株命名为Hep-2/v。
1.2.3 MTT法测定药物的敏感性 选取对数生长期Hep-2及Hep-2/v细胞,调整密度为5×104m l-1,接种于96孔板,每孔100μl,再分别加入长春新碱、顺铂及5-氟尿嘧啶3种化疗药物,每孔总体积200 μl,每组细胞设5个倍比浓度梯度,一个空白对照,各种药物浓度作3个平行孔,培育72小时后,每孔加入5mg/ml的MTT 20μl,继续培养4小时,每孔加200 μl DMSO,以490 nm检测波长,测定各孔的光密度值(A 值),计算IC50和RI:按抑制率=(1-加药组A值/细胞对照组A值)×100%计算每一种浓度的抑制率,并根据直线回归法计算各种抗癌药物的半数抑制浓度(IC50)及耐药指数(RI),RI=IC50(耐药细胞)/IC50(亲本细胞)。
1.2.4 生长曲线的绘制、倍增时间测定及细胞形态学观察 取对数生长期细胞,调整密度为 5×104m l-1,取2m l细胞悬液接种至24孔培养板,置于37℃、5%CO2孵箱内培养。每日取3孔细胞计数,计算均值,连续观察7日,绘制生长曲线,按Patterson公式[1]计算群体倍增时间(Doub ling time,TD),TD=T×log 2/(logNt-logNo),No:初始细胞数,Nt:终末细胞数,T:Nt-No时间。倒置显微镜下观察耐药细胞和亲本细胞的形态学变化。
1.2.5 流式细胞术检测细胞周期及细胞内罗丹明的蓄积变化 取含1×106m l-1细胞的单细胞悬液,800 r/min离心5分钟后弃去培养基,加入300μl含5%新生牛血清的PBS和700μl无水乙醇,-20℃放置24小时,离心去上清,1m l PBS清洗离心,去上清后加入1mg/m l的RNaseA 100μl,37℃水浴30分钟,加入100μg/ml的碘化丙啶(PI)300μl,暗处放置20分钟后以流式细胞术进行细胞周期分析。
取1 ml含2×106个细胞的单细胞悬液,加入5 mmol/L的罗丹明2.5μl,37℃保温30分钟,800 r/min离心5分钟,弃去培养液,以新鲜培养液洗去细胞外的罗丹明染料,37℃保温10分钟,再以新鲜培养基洗涤一次,细胞重悬于预冷的培养基,在流式细胞仪上检测细胞内的罗丹明蓄积。
1.2.6 Hep-2和Hep-2/v MDR1基因的mRNA及蛋白表达 RT-PCR法检测MDR1的表达:用TRIzol提取Hep-2和Hep-2/v细胞的总RNA,紫外光分光光度计定量RNA浓度。反转录过程用Oligo(dT)15法:总RNA 2μg,5×1stBuffer 4μl,DNTPs 1 μl,Oligo(dT)15 2μl,0.1mol/L DTT 2μl,RNase Inhibitor 0.5 μl,M-MLV 1μl加入 DEPC 水至20μl。反转录条件为25℃10分钟,37℃1小时,4℃终止。MDR1引物 :Forward 5′-GCACTAAAGTAGGAGACAAAGGAA-3′,Reverse 5′-TGACTCTGCCATTCTGAAACAC-3′。Actin 引物 :Forward 5′-CATGTACGTTGCTATCCAGGC-3′,Reverse 5′-CTCCTTAATGTCACGCACGAT-3′。PCR 反应体系包括:cDNA 1μl,引物1.2μl,2×PCR Buffer for EvaGreen 10μl,20×EvaGreen染料0.6μl,Cap Taq酶0.3μl,Nuclease-Free H2O to 20 μl。反应条件为95℃5分钟,95℃15秒,60℃15秒,72℃20秒,76℃3秒,共40个循环。以人Actin为内参。PCR反应的特异性通过产物熔解曲线进行确认,mRNA的相对含量根据公式 Fold change=2-Δ(ΔCt)计算 。
Western blot检测MDR1:用蛋白裂解液于冰上裂解Hep-2和Hep-2/v 30分钟,4℃12 000×g离心40分钟,取上清-80℃储存备用,上清用 Bradford法测定蛋白浓度,样品95℃变性5分钟后,每孔上样60 μg,SDS-PAGE(5%stacking gel,8%separating gel)电泳80伏2小时转膜于PVDF膜上,用4%脱脂奶粉/TBST室温下封闭抗原1.5小时。一抗用4%脱脂奶粉/TBST稀释后4℃孵育PVDF膜过夜(MDR1 1∶400,Mouse anti Human,Chemicon international INC)。TBST洗膜三次,每次10分钟,然后加入二抗,室温下摇床孵育1小时,再次TBST洗膜三次,每次10分钟。ECL曝光显影。图像分析仪定量分析表达蛋白的光密度。
1.3 统计学分析 用SPSS11.0统计学软件进行多组比较方差分析。计量资料用±s表示,两样本均数比较采用t检验,计数资料比较采用 χ2检验。
2 结果
2.1 多药耐药的检测结果 Hep-2和Hep-2/v细胞的多药耐药情况,见表1。
2.2 细胞倍增时间测定及细胞形态学观察 耐药细胞及亲本细胞的倍增时间为(28.75±1.12)小时和(42.33±1.76)小时,耐药细胞的生长较亲本细胞减慢,细胞倍增时间延长13.58小时,两者相比差异显著(P<0.05)。光镜下耐药细胞及亲本细胞均贴壁生长,Hep-2/v细胞胞体变大变圆,细胞内的颗粒增多,细胞常呈分片聚集,贴壁能力较亲本细胞减弱。见图1。
2.3 细胞周期及细胞内罗丹明的蓄积变化 流式细胞术分析细胞周期结果显示Hep-2/v细胞较Hep-2细胞G0/G1期细胞升高(P<0.05);而S期细胞则明显降低(P<0.05)。见表2。流式细胞仪检测Hep-2和Hep-2/v细胞罗丹明的阳性百分比为(95.97±0.56)%及(12.40±0.44)%。Hep-2细胞的罗丹明阳性率远高于Hep-2/v细胞(P<0.01)。
2.4 Hep-2和Hep-2/v MDR1基因的mRNA及蛋白表达变化 RT-PCR结果用2-△△CT方法分析,Hep-2/v细胞MDR1/Actin mRNA的相对表达量是Hep-2细胞的(9.61±6.14)倍(P<0.01)。
Western blot结果表明MDR1/P-gp在Hep-2/v细胞内的表达比Hep-2细胞明显增高(P<0.01)。见图2。

表1 Hep-2和Hep-2/v细胞对不同化疗药物的耐药指数(n=3)Tab.1 RI of Hep-2 and Hep-2/v cells in different drugs(n=3)
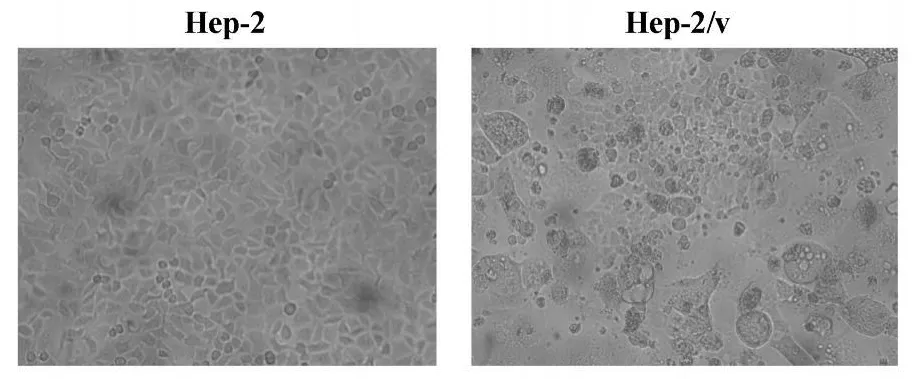
图1 Hep-2及Hep-2/v细胞的形态学观察Fig.1 Themorphologica l of Hep-2 and Hep-2/v cells

表2 Hep-2和Hep-2/v的细胞周期分布(n=3)Tab.2 The cell cycle distribution of Hep-2 and Hep-2/v cells(n=3)

图2 Hep-2及Hep-2/v细胞的MDR1/P-gp的蛋白表达Fig.2 The expression of MDR1/P-gp protein in Hep-2 and Hep-2/v cells
3 讨论
喉癌在头颈部是最常见的恶性肿瘤之一,目前仍是以手术为主的综合治疗,而化疗作为综合治疗的重要手段,可以抑制肿瘤细胞的微转移和杀伤残存的癌细胞,降低手术后局部复发或远处转移的风险,但由于多药耐药的产生,化疗的疗效欠佳,因此研究喉癌的多药耐药及逆转机制是临床面临的主要问题,而在体外建立多药耐药细胞系是研究肿瘤产生多药耐药性的重要手段[2,3]。目前国内外建立肿瘤MDR细胞系的方法通常是采用药物浓度递增持续法和大剂量间歇诱导法[4],而采用药物浓度递增法建立的耐药细胞系的主要优点是耐药性稳定、可靠。本研究以长春新碱为诱导剂,采用药物浓度递增法历时12个月诱导建立了喉癌多药耐药细胞系Hep-2/v,Hep-2/v细胞对VCR的耐药性为Hep-2细胞的45倍,而且经MTT检测该细胞系对5-Fu、DDP等结构及作用机制不同的抗癌药也产生了不同程度的耐药性,说明Hep-2/v具有MDR特性,是研究喉癌耐药性及筛选逆转剂的理想模型。
长春新碱的抗肿瘤作用主要是抑制微管蛋白的聚合而影响纺锤体微管的形成,使有丝分裂停止于中期,并且本研究的细胞周期分布分析结果中亦显示Hep-2/v细胞与Hep-2细胞相比G0/G1期细胞的比例升高,S期细胞比例降低,这可能是耐药细胞株生长速度变慢的原因,这种现象在其它的耐药细胞研究中也有发生[5]。另外本研究通过对Hep-2及Hep-2/v细胞生长曲线的绘制并计算倍增时间发现Hep-2/v倍增时间较亲本细胞延长了13.58小时,Hep-2/v细胞生长增殖速度明显减慢。而肿瘤的倍增时间越长,对化疗药物的敏感性亦降低[6]。
喉癌细胞的耐药机制非常复杂,癌基因、抑癌基因、细胞凋亡抑制基因及一些细胞因子等都可能参与耐药的形成,而药物外排机制占相当大的比率,它是由MDR1基因编码的一种能量依赖性药物排除泵,与抗癌药物结合后再结合ATP由ATP供能将细胞内的药物泵到细胞外,使药物浓度不断降低,从而产生耐药性[7,8]。本研究通过流式细胞仪检测Hep-2和Hep-2/v细胞罗丹明的蓄积情况,显示Hep-2细胞的罗丹明阳性率远高于Hep-2/v细胞,表明Hep-2/v细胞的耐药机制确实是由于MDR1基因编码的P-gp蛋白所致。另外本研究利用RT-PCR及Westernblot分别在基因及蛋白质水平检测Hep-2和Hep-2/v细胞中MDR1/P-gp的表达情况,结果再次证实Hep-2和Hep-2/v两者间MDR1/P-gp表达的显著差异。因此我们认为对喉癌多药耐药的逆转研究可放在抑制或阻断MDR1/P-gp的表达上。
1 张立阳,赵玉沛,吴元德etal.胰腺癌阿霉素耐药细胞1990/ADM的建立及其耐药机制研究[J].中国普外基础与临床杂志,2005;12(1):46-50.
2 Hong L,Zhao Y,Wang Jetal.Reversal ofmultidrug resistance of adriamycin-resistantgastric adenocarcinoma cells through the up-regulation of DARPP-32[J].JDig Dis Sci,2008;53(1):101-107.
3 Kwak M K,LeeH J,Hur Ketal.Expression of Kruppel-like factor 5 in human gastric carcinomas[J].Cancer Res Clin Oncol,2008;134(2):163-167.
4 GiovanniCarloCesana,Fabrizio Romano,Gaia Piacentinietal.Low-dose interleukin-2 administered pre-operatively topatients with gastric cancer activates peripheraland perit-umoral lymphocytesbut doesnot affect prognosis[J].Annals Surgical Oncology,2007;14(4):1295-1304.
5 李 莉,董 频,万 夷etal.人喉癌紫杉醇耐药细胞株的建立及其生物学特性[J].临床耳鼻咽喉头颈外科杂志,2007;21(9):843-846.
6 Maeno Y,Nakazawa Z,Yamamoto Netal.Osteopontin participa-tes in Th1-mediated host resistance against nonlethalmalaria parasite plasmodium chabaudi infection in mice[J].Infect Immun,2006;74(4):2423-2427.
7 WartenbergM,Cronczynska S,Bekhite M Metal.Reguation of themultidrug resistance transporter P-glycoprotein inmulticellular prostate tumor spheroids by hypertherm ia and reactive oxygen species[J].Int JCancer,2005;113(2):229-240.
8 Wartenberg M,Donmez F,Ling F Cetal.Tumor-induced angiogenesis studied confrontation culturesmulticellular tumor spheroids and embryoid bodiesgrown from pluripotent embryonic stem cells[J].FASEB J,2001;15(6):995-1005.
[收稿2009-11-21]
(编辑 张晓舟)
Establishment of a multid rug resistance cell line from human laryngeal cancer cells and itsbiologic features
YINWan-Zhong,WANGPing,ZHUWei.DepartmentofOtorhinol-AryngologyandHead-NeckSurgery,FirstHospital,JilinUniversity,Changchun130021,China
Objective:To estab lish amu ltidrug resistance cell line from human laryngeal cancer cells by VCR.Methods:Human laryngeal cancercells(Hep-2)wereexposed in stepwise escalating concentration of VCR until the resistant cell(Hep-2/v)linewas developed.The IC50 and the resistance folds ofmu ltidrug resistancewere detected with MTT assay.The differences of cell cycle distribution and Rhodamine accumu lation between Hep-2 and Hep-2/v cellswere studied through flow cytometry.TheMDR1 genewere detected through real-time quantitative RT-PCR,and the corresponding proteinwas detected through western blot.Results:Hep-2/v cellswas established,which had stable resistance to VCR and a resistance index of 45;Hep-2/v cells exhibited cross resistance tomany other chemotherapeutic agents and its doubling timewas prolonged;The numberof cells in G0/G1phase was increased while in S phase decreased(P<0.05);Rhodamine accumu lation in Hep-2 cellswasmuchmore than Hep-2/v cells(P<0.01);The expression ofMDR1 were increased than that of Hep-2 cells(P<0.01).Conclusion:Hep-2/v cell line shows the typicalmultidrug resistance phenotype.It can be served as amodel for the study ofMDR.
Laryngealneoplasms;Vincristine;Multidrug resistance
R739.65
A
1000-484X(2010)02-0129-04
①本文受教育部博士点基金课题资助(20060183040)
尹万忠(1970年-),男,在读博士,副教授,主要从事喉癌多药耐药研究,E-mail:yinwanzhong88@hotmail.com;
及指导教师:祝 威(1955年-),女,教授,博士生导师,耳鼻咽喉-头颈外科主任,主要从事头颈肿瘤的临床及基础研究,E-mail:zhuwei3000@yahoo.com.cn。
·中医中药与免疫·

