冬凌草甲素胆盐/磷脂-混合胶束的制备及其性质研究
陆国庆, 张轩邈, 郑新川, 朱仝飞, 何凤慈
(1.第三军医大学科研部,重庆400038;2.四川大学华西药学院,四川成都610041;3.第三军医大学西南医院生物医学综合实验研究中心,重庆400038;4.成都军区总医院临床药学科,四川成都610083)
冬凌草甲素(Oridonin,ORI)最早是从冬凌草中分离出的一种贝壳杉烯二萜类(ent-kaurene diterpenoid)天然有机化合物,白色棱柱状晶体,味极苦,极微溶于水和油脂中,可溶于甲醇等有机溶剂[1]。ORI细胞毒性较强,药理学实验表明具有较强的抗癌活性,可有效抑制多种肿瘤细胞增殖,包括肝癌、前列腺癌、乳腺癌、子宫颈癌、非小细胞肺癌、急性粒细胞白血病、多形性恶性脑胶质瘤细胞等[2-5]。但由于ORI特殊的理化性质,造成常规制剂溶解性差,毒副作用大,机体吸收差,制约了药物疗效的发挥,其应用受到限制。目前还没有理想的药物传递系统。
胆盐/磷脂混合胶束(Bile Salt-Phosphatidylcholine-Mixed Micelles,BS/PC-MM)系统不仅可显著提高难溶性药物的溶解能力,还可增强药物疗效,减少辅料对机体的不良反应,是一种生物相容性药物传递系统。国外学者已成功应用于多烯紫杉醇、替尼泊苷、地西泮类等药物的增溶[6-10]。本研究利用BS/PC-MM,以期提高ORI的溶解性能,并获得纳米粒径药物传递系统。
1 仪器与材料
1.1 仪器
高效液相色谱仪(Agilent1200,Agilent公司);旋转蒸发仪(Büchi公司):V-800 蒸发器,V-500 真空装置,B-490水浴装置,B-740冷凝器;纳米粒度及电位分析仪(英国 Malvern Zeta Sizer-Nano ZS90);透射电子显微镜(荷兰PHILIPS公司,TECNAI 10);艾科普高端超纯水系统(ACD-6000-U);低温高速离心机(Eppendorf,5417R);电子天平(Sartorius,BS223S,max 220 g,d=0.001 g;Sartorius BP61S,max 61 g,d=0.1 mg);pH计(METTLER TOLEDO);超声清洗仪(KQ-50B,昆山市超声仪器有限公司)。
1.2 材料
冬凌草甲素(Oridonin,ORI)(>98.07%,西安旭煌生物科技有限公司,081216);大豆磷脂(Soya Phosphatidylcholine,SPC)(PC>90%,上海太伟药业有限公司,20080320);脱氧胆酸钠(sodium deoxycholate,SDC)(>90%,北京奥博星生物技术责任有限公司,20090114);甲醇为色谱纯,无水乙醇为分析纯,水为超纯水(pH 7.2)。
2 实验方法
2.1 共沉淀法制备冬凌草甲素胆盐/磷脂混合胶束、空白混合胶束 结合参考文献方法[6-10],称取处方量的ORI、脱氧胆酸钠、大豆磷脂,加入适量无水乙醇,超声溶解至澄清,于40℃水浴旋转蒸发,除尽有机溶剂,加入适量水化介质,旋转水化、洗脱,转移至离心管中,13 000 r/min离心5 min,弃沉淀,取上清液,即得 ORI-BS/PC-MM,空白胶束同法制备。
2.2 ORI含量测定方法建立
2.2.1 色谱条件[11-12]色谱柱:(ECLIPSE XDBC18色谱柱4.6 mm ×150 mm ×5 μm),流动相:甲醇-水(60∶40),检测波长为240 nm,柱温:35℃,流速:1 mL/min,进样量:20 μL。
2.2.2 标准曲线 精密称取ORI原料药102.3 mg,置于250 mL量瓶,甲醇溶解并定容,得409.2 mg/L贮备液;分别精密吸取适量贮备液至10 mL量瓶,甲醇定容成 2.05、4.09、8.18、16.37、40.92、81.84、204.60 mg/L溶液,按照2.2.1项色谱条件进样,以ORI峰面积A对浓度C进行线性回归,得线性回归方程。
2.2.3 精密度 取ORI溶液高、中、低3个浓度组,按照2.2.1项色谱条件连续进样5次(日内精密度),连续测定5 d(日间精密度)。
2.2.4 回收率 精密量取ORI贮备液0.1、0.4、2.0 mL,分别加入相应比例的空白胶束溶液(磷脂比例0.4,辅料总浓度2.5%),甲醇定容至10 mL,按照2.2.1项色谱条件进样,测定回收率。
2.2.5 稳定性 精密吸取 ORI-BS/PC-MM(磷脂比例0.4,辅料总浓度2.5%,ORI 5 mg/mL)0.1 mL,甲醇定容至 10 mL,室温放置,于 0、2、4、6、24 h取样,按照2.2.1项色谱条件进样,计算变异系数V。
2.2.6 含量测定 精密吸取 ORI-BS/PC-MM 适量,甲醇定容至10 mL,混匀后0.22 μm有机滤膜过滤,按照2.2.1色谱条件进样,按照所得峰面积A推算ORI浓度C。
2.3 ORI-BS/PC-MM 制备的单因素考察[6-10]拟定不同的考察因素,投入过量ORI原料药,称取处方量的脱氧胆酸钠、大豆磷脂,加入适量无水乙醇,超声溶解至澄清,于40℃水浴旋转蒸发,除尽有机溶剂,加入适量水化介质,旋转水化、洗脱,转移至离心管中,13 000 r/min离心5 min,弃沉淀,取上清液,即得 ORI-BS/PC-MM。按照 2.2.6项方法测定ORI浓度,计算其溶解度和载药量(ORI/(脱氧胆酸钠+大豆磷脂)%)。
2.3.1 不同磷脂比例(大豆磷脂占辅料的摩尔比)固定辅料总浓度为2.5%,25℃超纯水水化,考察不同磷脂比例分别为 0、0.1、0.2、0.3、0.4、0.5、0.6情况下,ORI的溶解度差异。
2.3.2 不同辅料总浓度(大豆磷脂与脱氧胆酸钠在100 mL溶液中所占的质量百分比) 固定磷脂比例为0.3,25℃超纯水水化,考察不同辅料总浓度1%、3%、5%、7%、10%情况下,ORI的溶解度及载药量的差异。
2.3.3 不同pH值水化介质 固定辅料总浓度2.5%,磷脂比例0.3,25℃离子强度为0.1 mol/kg PBS作为水化介质,制备混合胶束,考察不同pH值水化介质(pH2.0、pH5.8、pH6.4、pH7.4、pH8.0)情况下,ORI的溶解度差异。
2.3.4 不同离子强度 固定辅料总浓度2.5%,磷脂比例0.3,25℃ NaCl溶液水化,制备混合胶束,考察离子强度分别为 0.05、0.15、0.30、0.6、0.92、1.85、3.70 mol/kg的NaCl溶液作为水化介质,ORI的溶解度差异。
2.3.5 不同水化温度 固定辅料总浓度2.5%,磷脂比例0.3,超纯水水化,制备混合胶束,考察水化温度分别为10℃、25℃、37℃、45℃、60℃时,ORI的溶解度差异。
2.4 稀释稳定性 根据ORI的前期临床试用剂量(75 mg/d),参考临床静脉输液配制方法,将含ORI 75 mg的载药胶束5 mL稀释至100 mL 0.9%NaCl溶液及500 mL 5%葡萄糖溶液中,HPLC考察不同磷脂比例(0、0.1、0.2、0.3、0.4、0.5、0.6)情况下,混合胶束的稀释稳定性(0 h、24 h、48 h、72 h、100 h)。
2.5 胶束粒径及Zeta电位测定 固定辅料总浓度2.5%,磷脂比例0.3,ORI浓度为1 mg/mL,制备载药、空白胶束,水化后13 000 r/min离心5 min,取上清液,稀释至ORI浓度为0.5 mg/mL,测定平均粒径及Zeta电位。
2.6 胶束形态测定 固定辅料总浓度2.5%,磷脂比例0.3,ORI浓度为1 mg/mL,制备载药胶束,水化后13 000 r/min离心5 min,取上清液,稀释至ORI浓度为0.5 mg/mL,将稀释好的胶束溶液滴加至铜网上,用2%磷钨酸钠液复染,在透射电镜下观察并进行照相。
3 结果
3.1 标准曲线的制定 由实验可知,ORI的浓度C与峰面积A之间具有良好的线性关系,标准曲线方程为 A=25.661C -14.008,r=0.999 9(n=7),线性范围(2.05~204.60)mg/L;以S/N≥10确定定量限,本实验最低线性范围2.05 mg/L时,S/N>10;日内高、中、低3个浓度组 RSD分别为0.26%、0.52%、2.33%,日间高、中、低3个浓度组RSD分别为0.49%、2.18%、1.55%;高、中、低3个浓度组平均回收率分别为97.69%、98.21%、104.12%;变异系数V≤1.62%,表明样品溶液室温放置24 h内稳定。
3.2 ORI-BS/PC-MM 制备的单因素考察结果
3.2.1 不同磷脂比例 随着大豆磷脂比例(0~0.6)的不断增加,可以导致ORI溶解度的逐渐下降,溶解度范围为(11.25±0.35)mg/mL~(4.66±0.41)mg/mL。见图1。

图1 磷脂比例对ORI在胶束中溶解度的影响(n=3,±s)
3.2.2 不同辅料总浓度 不断增加辅料总浓度(1% ~10%),ORI溶解度逐渐增加,溶解度范围为(3.77±0.40)~(19.74±0.96)mg/mL;载药量逐渐下降,载药量范围为(37.73±3.97)% ~(19.74±0.96)%。见图2。

图2 不同辅料总浓度对ORI在胶束中溶解度及载药量的影响(n=3,±s)
3.2.3 不同pH值水化介质 水化介质pH值在6.4~8.0范围内时,ORI具有较好的溶解性能,pH值为7.4的PBS中,ORI溶解度为(9.84±0.25)mg/mL,见图3。因此,采用pH为7.2的超纯水作为水化介质即可取得较好的溶解效果。
3.2.4 不同离子强度 随着水化介质离子强度的增加,ORI的溶解度逐渐下降,其中离子强度0.05 mol/kg组溶解度为(8.86±0.43)mg/mL,离子强度3.70 mol/kg组溶解度为(2.46±0.34)mg/mL,见图4。因此,采用离子强度为0的超纯水作为水化介质即可取得较好的溶解效果。

图3 pH值对ORI在胶束中溶解度的影响(n=3,±s)

图4 离子强度对ORI在胶束中溶解度的影响(n=3,±s)
3.2.5 不同水化温度 10℃、25℃及37℃均可取得较好溶解效果,溶解度分别为(8.24±0.35)mg/mL,(9.11±0.19)mg/mL,(8.74±0.42)mg/mL,见图5。因此,采用室温水化介质即可。

图5 水化温度对ORI在胶束中溶解度的影响(n=3,±s)
3.3 稀释稳定性 结果显示:稀释至100mL 0.9%NaCl组中ORI最低浓度组为(93.4±0.3)%(磷脂比例为0.2);稀释至500 mL 5%葡萄糖组中ORI最低浓度组为(94.7±1.9)%(磷脂比例为0.4)。两组稀释情况显示RSD(%)<5.00%,说明不同时间点的药物含量变化情况较小,不同磷脂比例的ORIBS/PC-MM均具有较好的抗稀释能力。稀释至100 mL 0.9%NaCl组见表1,稀释至500mL 5%葡萄糖组见表2。
表1 不同磷脂比例情况下混合胶束的稀释稳定性(n=3,±s)
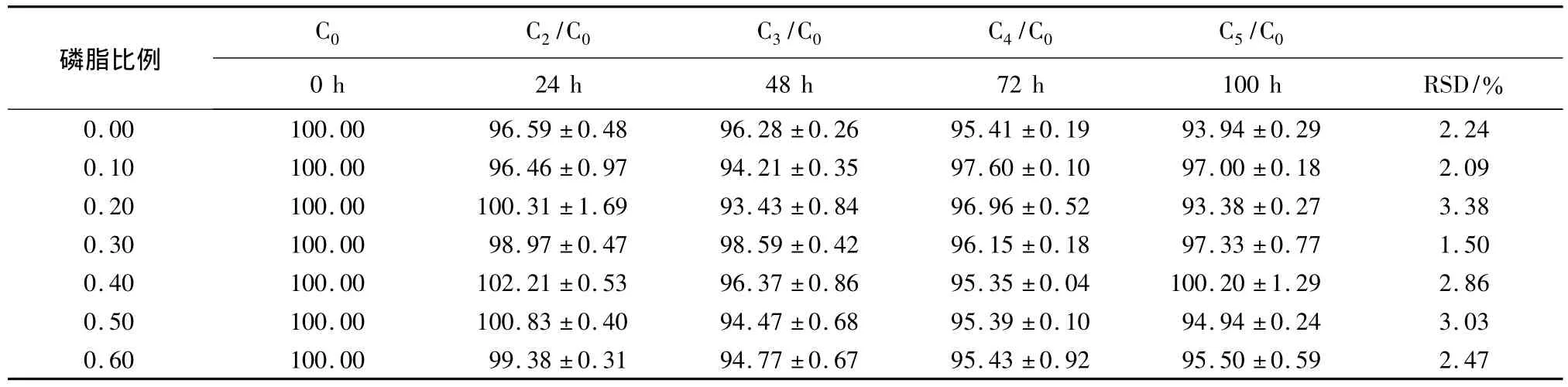
表1 不同磷脂比例情况下混合胶束的稀释稳定性(n=3,±s)
0.00 100.00 96.59±0.48 96.28±0.26 95.41±0.19 93.94±0.29 2.24 0.10 100.00 96.46±0.97 94.21±0.35 97.60±0.10 97.00±0.18 2.09 0.20 100.00 100.31±1.69 93.43±0.84 96.96±0.52 93.38±0.27 3.38 0.30 100.00 98.97±0.47 98.59±0.42 96.15±0.18 97.33±0.77 1.50 0.40 100.00 102.21±0.53 96.37±0.86 95.35±0.04 100.20±1.29 2.86 0.50 100.00 100.83±0.40 94.47±0.68 95.39±0.10 94.94±0.24 3.03 0.60 100.00 99.38±0.31 94.77±0.67 95.43±0.92 95.50±0.59 2.47
表2 不同磷脂比例情况下混合胶束的稀释稳定性(n=3,±s)

表2 不同磷脂比例情况下混合胶束的稀释稳定性(n=3,±s)
0.00 100.00 98.87±0.70 97.90±0.71 97.50±0.66 95.60±1.09 1.64 0.10 100.00 99.19±0.05 97.86±1.28 97.07±1.22 96.33±0.38 1.50 0.20 100.00 99.51±0.73 97.98±0.25 96.25±0.28 95.73±0.47 1.90 0.30 100.00 99.17±0.28 98.46±0.15 95.63±0.75 95.08±0.77 2.19 0.40 100.00 99.00±0.68 98.94±0.93 96.56±0.26 94.71±1.28 2.16 0.50 100.00 98.02±0.63 98.31±0.86 95.93±0.92 95.13±0.10 1.95 0.60 100.00 98.78±1.46 99.24±0.84 95.78±1.07 96.74±1.23 1.78
3.4 胶束粒径、Zeta电位测定结果 载药、空白胶束的粒径、Zeta电位测定结果见表3。
表3 混合胶束的平均粒径、Zeta电位(n=3,±s)

表3 混合胶束的平均粒径、Zeta电位(n=3,±s)
ORI-BS/PC-MM 10.92±2.90 - (48.75±2.37)BS/PC-MM 8.88±0.90 -(49.53±1.69)
3.5 透射电镜测定胶束形态 透射电镜测定ORIBS/PC-MM粒径为10 nm左右,粒径分布均一,与激光粒度仪测定结果符合,胶束表面形态为类圆形实体。见图6。
4 讨论
通过上述实验发现,影响ORI溶解性能的主要因素包括胆盐、磷脂的性质和药物本身理化性质,磷脂比例、辅料总浓度、水化介质的pH值,离子强度,水化温度等。选用纯度较高的脱氧胆酸钠、注射用大豆磷脂可以取得较好的增溶效果。ORI与胆盐、磷脂的疏水部分具有较好的相容性;但是,固定辅料总浓度情况下,提高磷脂比例,ORI的溶解度是逐渐降低的,与多数文献报道提高磷脂比例,增溶效果增加不一致。Hammand[8]报道,甾体类药物泼尼松龙、雌二醇在BS/PC-MM中也表现出类似趋势,这可能是由于上述药物结构类似、具有一定的两亲性,在混合胶束中增加磷脂比例,胶束的疏水内核与亲水外壳之间的栅栏层增加,导致部分药物定向插于其中,溶解稳定性下降所致。另外随着磷脂含量的增加,也可能导致磷脂与胆盐的结合率下降,导致剩余的磷脂在水溶液中析出,从而导致药物析出。

图6 ORI-BS/PC-MM透射电镜照片
随着辅料总浓度的不断增加,ORI的溶解度也不断增加,但是载药量却呈现下降趋势。原因是当辅料总浓度增加到一定程度以后,可能导致混合胶束数量趋于饱和,系统难以在水溶液中进一步溶解。
ORI与混合胶束通过分子间作用力结合,水化介质的pH值过高或过低都可以影响溶解效果,可能与分子间作用力在高电荷情况下不稳定,容易导致ORI析出有关;水化温度过高或者加入过多盐类,可能导致胶束的亲水段水化程度降低,且在高的水化温度和离子强度作用下,可能影响胶束的表面电荷分布,提高混合胶束的临界胶束浓度(critical micelle concentration,CMC),导致用于增溶的胶束数量减少,从而降低ORI的溶解度。
本研究解决了难溶性药物ORI的溶解性问题,能够满足临床用药浓度要求,并获得纳米粒径药物;且其制备方法简单易行,所需实验条件温和。有望开发成为ORI的新型药物传递系统。
[1]Osawa K,Yasuda H,Maruyama T,et al.Antibacterial trichorabdal diterpenes from Rabdosia trichocarpa[J].Phytochemistry,1994,36(5):1287-1291.
[2]Ikezoe T,Chen S S,Tong X J,et al.Oridonin induces growth inhibition and apoptosis of a variety of human cancer cells[J].Int J Oncol,2003,23(4):1187-1193.
[3]Chen S,Gao J,Halicka H D,et al.The cytostatic and cytotoxic effects of oridonin(Rubescenin),a diterpenoid from Rabdosia rubescens,on tumor cells of different lineage[J].Int J Oncol,2005,26(3):579-588.
[4]Huang J,Wu L,Tashiro S,et al.Reactive oxygen species mediate oridonin-induced HepG2 apoptosis through p53,MAPK,and mitochondrial signaling pathways[J].J Pharmacol Sci,2008,107(4):370-379.
[5]Zhang J F,Liu J J,Liu P Q,et al.Oridonin inhibits cell growth by induction of apoptosis on human hepatocelluar carcinoma BEL-7402 cells[J].Hepatol Res,2006,35(2):104-110.
[6]Alkan-Onyuksel H,Ramakrishnan S,Chai H B,et al.A Mixed micellar formulation suitable for the parenteral administration of taxol[J].Pharm Res,1994,11(2):206-212.
[7]Alkan-Onyuksel H,Son K.Mixed Micelles as Proliposomes for the Solubilization of Teniposide[J].Pharm Res,1992,9(12):1556-1562.
[8]Hammad M A,Müller B W.Increasing drug solubility by means of bile salt-phosphatidylcholine-based mixed micelles[J].Eur J Pharm Biopharm,1998,46(3):361-367.
[9]Hammad M A,Müller B W.Solubility and stability of tetrazepam in mixed micelles[J].Eur J Pharm Sci,1998,7(1):49-55.
[10]Hammad M A,Müller B W.Solubility and stability of clonazepam in mixed micelles[J].Int J Pharm,1998,169(1):55-64.
[11]Gao L,Zhang D R,Chen M,et al.Preparation and Characterization of an Oridonin Nanosuspension for Solubility and Dissolution Velocity Enhancement[J].Drug Dev Ind Pharm,2007,33(12):1332-1339.
[12]Zhang D R,Tan T W,Gao L.Preparation of oridonin-loaded solid lipid nanoparticles and studies on them in vitro and in vivo[J].Nanotechnology,2006,17(23):5821-5828.