不同生长时期罗汉果高效液相指纹图谱研究
卢凤来,刘金磊,黄永林,李典鹏*
(广西壮族自治区-中国科学院广西植物研究所,广西 桂林 541006)
不同生长时期罗汉果高效液相指纹图谱研究
卢凤来,刘金磊,黄永林,李典鹏*
(广西壮族自治区-中国科学院广西植物研究所,广西 桂林 541006)
探索罗汉果药材的质量变化规律,确定罗汉果的关键生长期与采收期,指导罗汉果GAP生产,同时为罗汉果药材建立一种更合理的质量控制方法。采用高效液相色谱法建立不同生长时期青皮果与长滩果的特征性化学成分指纹图谱,通过聚类分析以及对11个指标性成分的鉴定及峰面积变化分析,研究罗汉果生长过程中的质量变化情况。结果表明不同栽培品种罗汉果在生长过程中具有相似的化学成分变化规律,不同生长时期化学成分特征不同。中药化学成分色谱指纹图谱技术是一种全方位多角度控制中药质量方法,可以更有效地指导中药材规范化种植。
罗汉果;色谱指纹图谱;高效液相色谱法;聚类分析
罗汉果(Siraitia grosvenorii)从1977年以来一直被《中华人民共和国药典》收录,为药食两用植物,具有清热润肺、凉血、润肠通便的功效,在治疗百日咳、慢性气管炎、感冒、便秘、胃肠小疾等方面疗效显著[1],广泛应用于医药、饮料和调味品当中。其化学成分复杂,含有多种皂苷成分[2-7],尚含有黄酮甙[8]和少量的甘露醇,鲜罗汉果中还富含丰富的VC[9],且不同生长时期罗汉果果实中黄酮类化合物含量不同[10];苷类成分也不一致,成熟罗汉果富含罗汉果甜苷,主要为罗汉果苷Ⅳ、Ⅴ(mogrosideⅣ、Ⅴ),味极甜;未成熟的罗汉果主要含有罗汉果苦苷A(mogrosideⅡE),味苦。李典鹏等利用薄层层析以及高效液相色谱法研究了不同生长时期罗汉果中苷类成分的变化[11],并对罗汉果及罗汉果花化学成分进行了深入研究,从中分离得到多个苷类成分及黄酮类成分[12-13]。
指纹图谱技术作为一种多组分复杂样品的有效质量控制方法,能够反映出待测样品的整体性、特征性,目前已被广泛用于中草药及其各种制剂的质量控制[14-15]。但至今未发现有关不同生长时期罗汉果指纹图谱研究的报道。本研究通过RP-HPLC法建立不同生长时期罗汉果的指纹图谱,旨在将化学成分色谱指纹图谱技术运用于生产实践,利用多个单体作参照物,对罗汉果生长过程中化学成分的变化规律作全面地了解,以确定罗汉果生长的关键时期与最佳的采收期,指导罗汉果GAP生产
管理,并为罗汉果的相关药效研究以及新药的研发提供全面的信息基础和科学依据,促进罗汉果产业快速健康地发展。
1 材料与方法
1.1 材料
罗汉果盛花期,于广西植物所罗汉果药材地里给长滩、青皮果挂牌点花。点花5d后,相继采摘不同日龄的果实适量,采集后分别冷冻干燥,过40目筛,然后装在封口袋于干燥瓶内保存备用。样品的具体来源见表1。
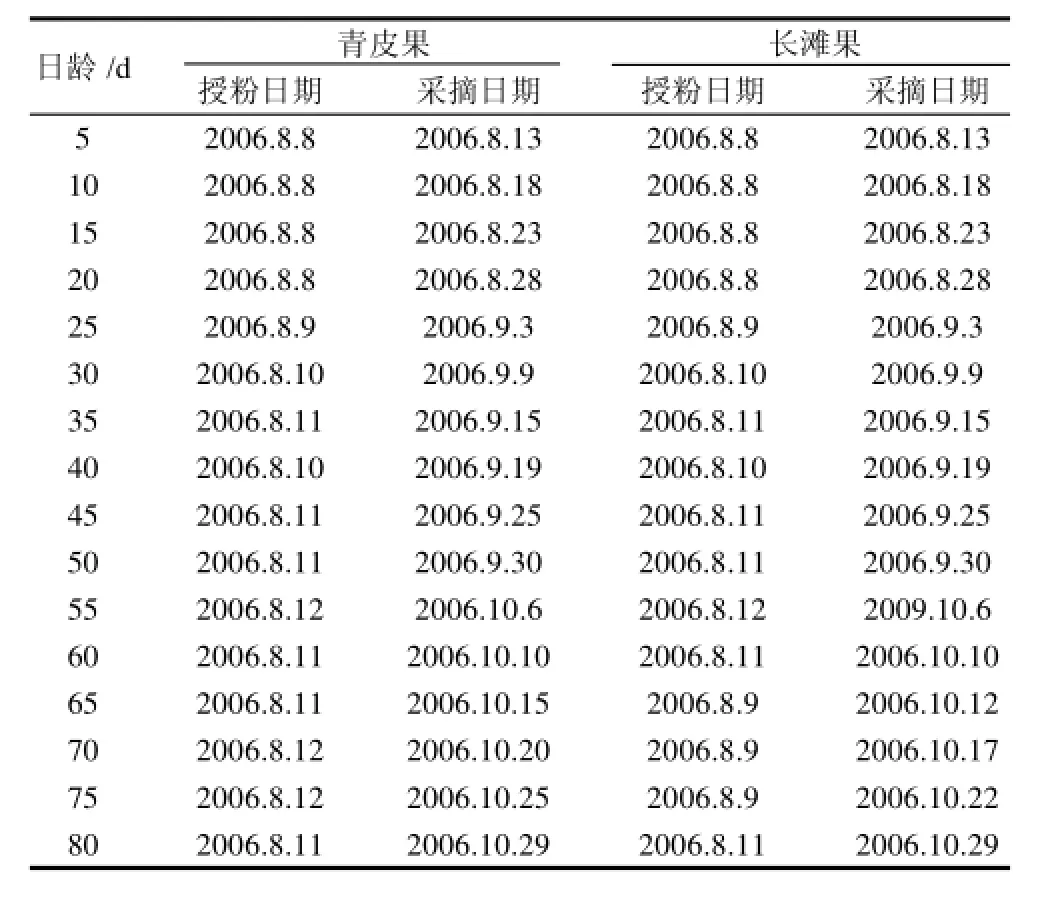
表1 不同生长时期青皮果与长滩果的来源Table 1 Origin of tested samples at different growth stages
1.2 对照品
LHG1:罗汉果黄Ⅰ(3-O-β-D-glucopyranosyl kaempferol 7-O-[β-D-glucopyranosyl-(1-2)-α-L-rhamnopyranoside],LHG2:山奈酚-3,7-O-α-L-吡喃鼠李糖双糖甙(kaempferol-3,7-α-L-dirhamnopyranoside),LHG3:3-O-β-D-吡喃鼠李糖基-山奈酚-7-O[β-D-吡喃葡萄糖基(1-2)-α-L-吡喃鼠李糖甙](3-O-α-L-rhamnopyranosyl kaempferol 7-O[β-D-glucopyranosyl (1-2)-α-L- rhamnopyranoside]),LHG4:3-O-β-D-吡喃葡萄糖基-山奈酚-7-O-α-L-吡喃鼠李糖甙(3-O-β-D-glucopyranosyl kaempferol 7-O-α-L-rhamnopyranoside)及LHG5:11-氧化罗汉果苷Ⅴ(11-oxomogrosideⅤ);LHG6:罗汉果苷Ⅴ(mogroside Ⅴ);LHG7:罗汉果苷ⅣA(mogrosideⅣA); LHG8:罗汉果苷Ⅲ(mogrosideⅢ);LHG9:11-氧化罗汉果苷Ⅲ(11-oxomogroside Ⅲ);LHG10:罗汉果苷ⅡE(mogroside ⅡE);LHG11:11-氧化罗汉果苷ⅡE(11-oxomogroside ⅡE)为本实验小组自制,所有的化合物均经光谱学确定结构。
1.3 仪器与设备
1100分析型高效液相色谱仪(包括二极管阵列多波长DVD检测器、四元梯度泵、在线真空脱气机、7725i手动进样器、HP化学工作站) 美国Agilent公司;超声波清洗器; B3500S-MT超声波清洗器 必能信超声(上海)有限公司;分析纯甲醇、乙醇、磷酸 广东汕头市西陇化工厂;色谱纯乙腈 美国TEDIA公司;重蒸蒸馏水 自制。
1.4 方法
1.4.1 供试品溶液的制备
取罗汉果药材粉末0.5μg,精密称量,置100mL具塞锥形瓶中,精密加入甲醇25mL,摇匀,称量,超声处理1μh,冷却,再称量,用甲醇补足减失的质量,摇匀,以0.45μm的微孔滤膜滤过,滤液作为供试品溶液。
1.4.2 对照品溶液的制备
称取LHG1、LHG2、LHG3、LHG4、LHG5、LHG6、LHG7、LHG8、LHG9、LHG10、LHG11适量,用甲醇溶解到5mL的容量瓶中,超声使其充分溶解,并用甲醇定容至刻度,以0.45μm的微孔滤膜滤过,滤液作为对照品溶液。
1.4.3 色谱条件
色谱柱:ZORBAX SB-C18柱(4.6mm×150mm,5μm);柱温:20℃;流动相:0.05%磷酸(A)-乙腈(B)(梯度洗脱:0~8min,3%~13.5% B;8~35min,13.5%~35% B;35~45min:35% B);检测时间:45min;流速:0.8mL/min;检测波长:203nm;进样量:10μL。
1.5 数据软件
中药色谱指纹图谱相似度评价系统A版。
2 结果与分析
2.1 方法学考察
选择了青皮果45d样品考察分析方法的可靠性,对仪器精密度、方法重现性以及样品稳定性作了相应考察。取同一供试品溶液,连续进样5次,考察精密度;另取供试品5份,分别按供试品溶液的制备方法制备供试品溶液,检测指纹图谱,考察重现性;再取同一供试品分别在2、8、14、20、30、48h,检测指纹图谱考察稳定性。结果显示其主要色谱峰的相对保留时间和峰面积RSD分别小于3%和5%,符合指纹图谱技术要求。说明仪器精密度、供试品溶液稳定性及方法重现性良好。
2.2 青皮果与长滩果指纹图谱的比较
按1.4.2节供试品溶液的制备方法,制备不同生长时期青皮果和长滩果的供试液,分别进样进行检测,得到不同生长时期青皮果和长滩果的指纹图谱(图1、2)。结果发现不同生长时期罗汉果液相色谱可分离出多个成分,在观察众多样品色谱图的基础上,根据是否为共有峰,同时在不同时期的样品中其相对峰面积是否有变化,能否构成“指纹”为依据从中选取20个可以构成指纹图谱的稳定的特征峰(图3B)。青皮果和长滩果均具有这些特征峰,但峰面积的大小随生长时期有很大变化,有些峰仅在生长周期的某个阶段出现。这说明这些色谱峰对应的化合物为罗汉果的共有化学成分,选取它们为特征峰具有代表性。同时也提示罗汉果的化学成分是随着生长而积累并转化的。比较两个品种各个时段的指纹图谱可以发现,长滩果比青皮果具有多一些未知的小峰,说明长滩果化学成分较复杂。在同样的日龄内两个品种,其色谱峰的强度不尽相同,也就是说它们化学成分的含量也不一致。
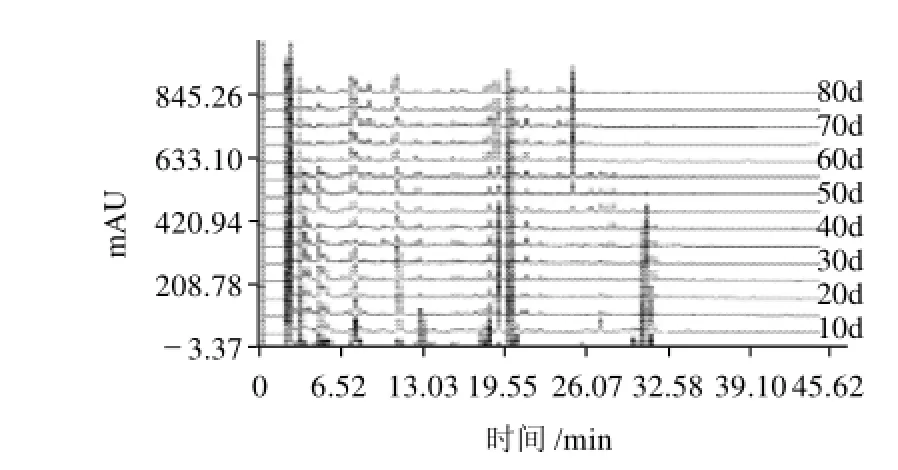
图1 不同生长时期青皮果HPLC指纹图谱Fig.1 Fingerprints of Qingpiguo variety of Siraitia grosvenorii at different growth stages
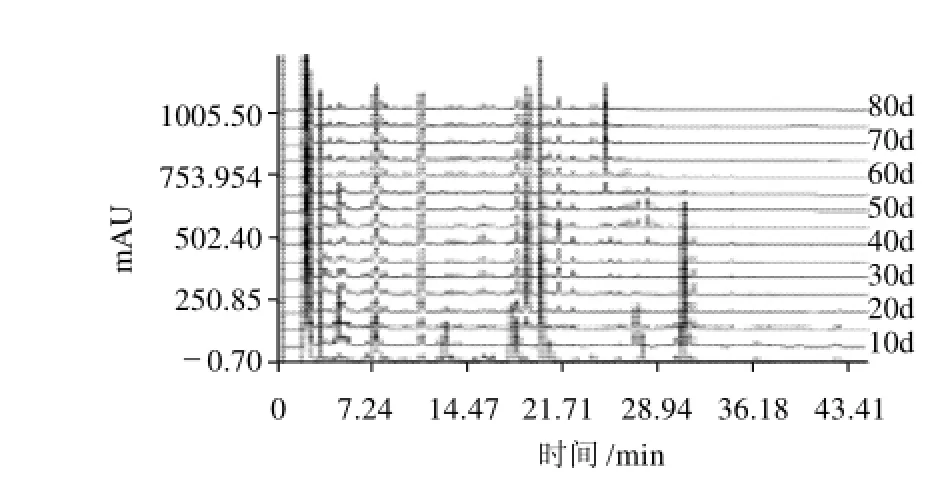
图2 不同生长时期长滩果HPLC指纹图谱Fig.2 Fingerprints of Changtanguo variety of Siraitia grosvenorii at different growth stages
2.3 指纹图谱主要色谱峰的鉴定
在上述的色谱条件下,分别测定样品与11种对照品的指纹图谱,比较样品图谱与对照品图谱,发现样品指纹图谱中4、6、7、9、13、14、15、17、18、19、20号峰的保留时间及紫外光谱分别与此11种对照品吻合,故样品指纹图谱中4、6、7、9、13、14、15、17、18、19、20号特征峰分别鉴定为LHG1、LHG2、LHG3、LHG4、LHG5、LHG6、LHG7、LHG8、LHG9、LHG10、LHG11(图3)。
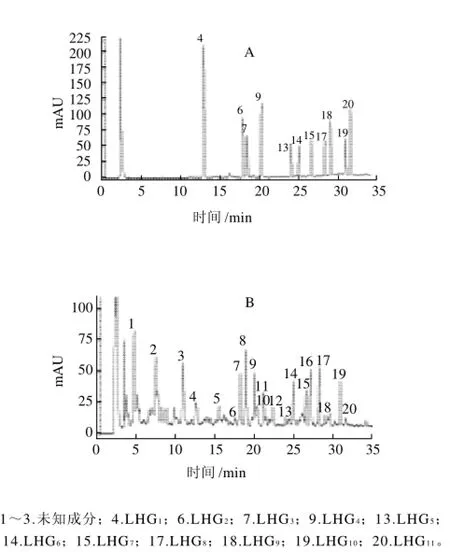
图3 对照品(A)和青皮45d HPLC指纹图谱(B)Fig.3 Fingerprints of reference substance and Qingpiguo variety of Siraitia grosvenorii at the 45thday of growth period
2.4 指标性成分的变化分析
从不同时期罗汉果的11个指标性成分的峰面积来看,这些成分在罗汉果的生长过程有明显的变化规律。罗汉果的苷类成分有明显的变化规律。45d以前其主要苷类成分是LHG10、LHG11,且10d时两者含量最高,而LHG6、LHG8和LHG9含量均比较低,在40d以前看不到LHG7峰出现。45~55d是各个苷类都存在,且含量相对均匀的时期。55d以后则以LHG6为主要成分。除LHG6外,所有的苷类呈相似的变化规律,即先增长后降低。其黄酮类化合物在罗汉果的早期,尤其是5d时百分含量最大,随后逐渐下降,5~10d变化最显著,下降幅度最大,此后缓慢下降,或者保持在一个相对稳定的范围之内。除LHG3的峰面积还比较高以外,其他峰的峰面积都比较小。见表2、3。
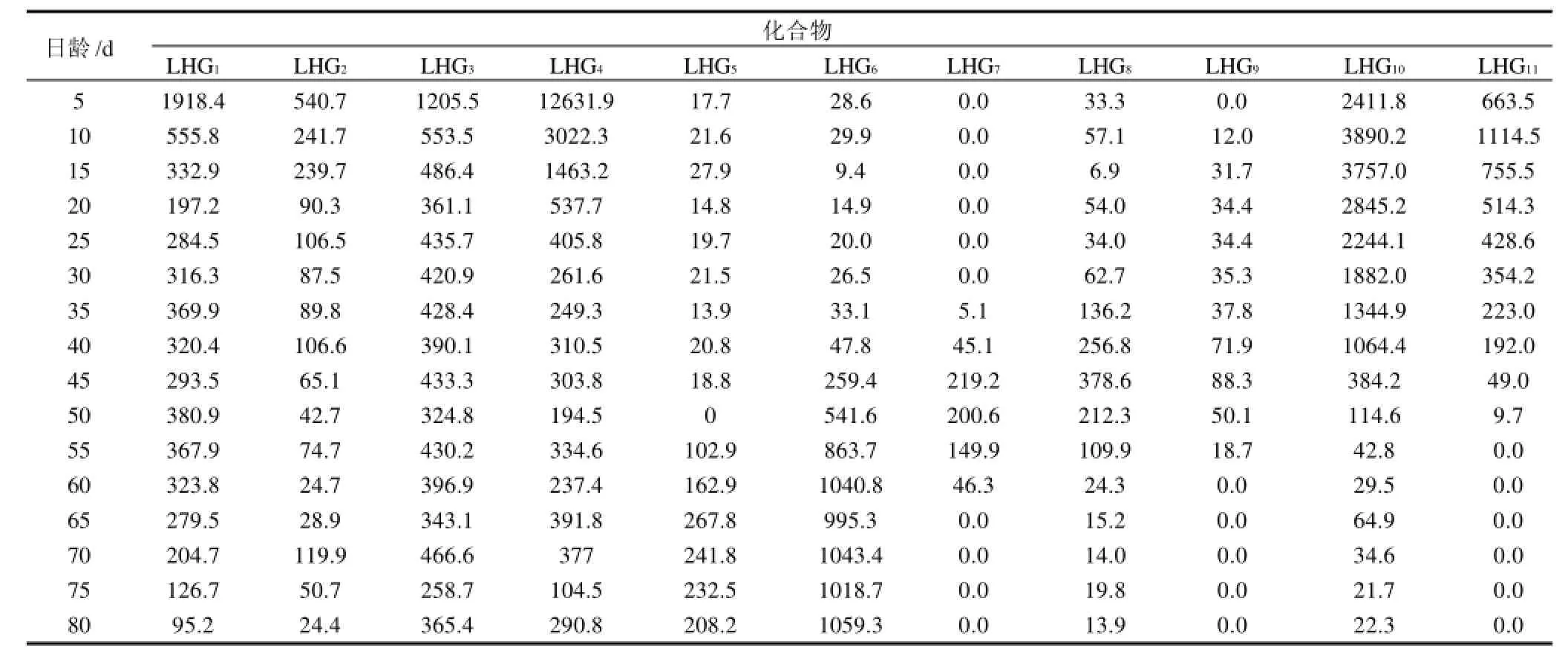
表2 不同生长时期青皮果的11个指标性化合物峰面积变化Table 2 Peak areas of 11 reference compounds in Qingpiguo variety of Siraitia grosvenorii at different growth stages

表3 不同生长时期长滩果的10个指标性化合物峰面积变化Table 3 Peak areas of 11 reference compounds in Changtanguo variety of Siraitia grosvenorii at different growth stages
2.5 指纹图谱聚类分析
对青皮果和长滩果不同时期的各16个样品作指纹图谱分析,获得20个共有色谱峰,以各个峰的峰面积作参量,得到16×20阶原始数据,由SPSS软件利用欧氏距离作为样品的测度作聚类分析。结果显示两个品种聚类结果大致相同(图4),均将不同生长时期的罗汉果分为五类,第一类为5d,第二类为10~15d,第三类为20~40d,第四类为45~55d,大于等于60d为第五类。这说明不同栽培品种的罗汉果具有相似的生长规律。同时也说明5、10、20、45、60d左右为罗汉果生长的重要时期,是罗汉果化学成分产生和转化的关键时期。
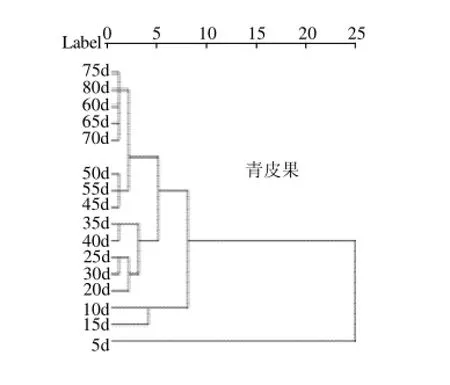

图4 不同生长时期青皮果与长滩果指纹图谱聚类分析图Fig.4 Clustering analysis for fingerprints of both varieties of Siraitia grosvenorii at different growth stages
3 讨论与结论
3.1 在得到相对完备的中药指纹图谱后,应进入研究的高级阶段,即指纹图谱谱效学的研究。本实验利用对照品鉴别出指纹图谱中主要的11个色谱峰,充分体现在强调色谱指纹图谱模糊整体性评价的同时,也应对其主要色谱峰进行鉴别的思路,为进一步的谱效学研究提供参考。
3.2 由HCA的结果可以看出5、10、20、45、60d左右为罗汉果生长的重要时期,是罗汉果化学成分产生和转化的关键时期。这是否表示如果这些时期对罗汉果采取特别的栽培管理方式,更有利于罗汉果化学成分的积累,还有待于研究。
3.3 目前LHG6是罗汉果的主要活性成分,也是控制罗汉果质量的重要指标,由表2、3可以看出,青皮果60d、长滩果65d以后,LHG6的峰面积变化不大,而且其他苦苷也几乎不存在,因此我们认为罗汉果65~70d采收较为适宜。及时采收不仅确保较高的LHG6含量,同时从植物生长的角度来看,还能减少果实对植株养分的消耗,有利于其他未成熟果实的生长。
3.4 近二十年来,黄酮类化合物日益引起人们的重视。国内外已经发现的黄酮类化合物有数千种,大多数具有显著生理药理活性,在医药上已经广泛应用,在功能食品开发方面越来越受到重视。由指纹图谱可以看出罗汉果中含有的黄酮类种类及含量都不少。而且实验证明罗汉果黄酮具有一定的抗血栓形成、抗血小板聚集、降血脂、抗凝血等活血化瘀药理作用[16]。因此,罗汉果黄酮类物质具有很大的开发潜力。本研究为开发罗汉果潜在的活性成分以及罗汉果新药的研发提供了化学信息研究资料,对指导罗汉果的生产与深入开发具有重要意义。
[1]江苏新医学院. 中药大辞典[M]. 上海: 上海科学技术出版社, 1977: 1356-1357.
[2]TAKEMOTO T, ARIHARA S, NAKAJIMA T, et al. Study on the constituents of fructus momordicae.I-III[J]. Yakugaku Zasshi, 1983, 103: 1151-1173.
[3]KASAI R, NIE R L, NASHI K, et al. Sweet cucurbitane glycosides from fruits of Siraitia siamensic (chi-zi Luo-han-guo): a Chinese folk medicine [J]. Agric Biol Chem, 1989, 53: 3347-3349.
[4]MATSUMOTO K, KASAI R, OHTANI K, et al. Minor cucurbitane glycosides from fruits of Siraitia grosvenorii (cucurbitancaae)[J]. Chem Pharm Bull, 1990, 38: 2030-2032.
[5]CHANG Q, CHEN D H, SI J Y, et al. The studies on the NMR spectra of mogrosides V[J]. Chin J Mag Res, 1994, 11: 43-48.
[6]SI J Y, CHEN D H, SHEN L G. Isolation and determination of cucurbitaneglycosides from fresh fruits of Siraitia grosvenorii[J]. Acta Botanica Sinica, 1996, 38: 489-494.
[7]ZHANG J Y, YANG X W. Assignment of1H and13C NMR signals of mogroside IV[J]. Chin Pharm Sci, 2003, 12: 196-200.
[8]SI J Y, CHEN D H, CHANG Q, et al. Isolation and strcture determination of flavonol glycosides from the fresh fruits of Siraitia grosvenorii[J]. Acta Pharm Sinica, 1994, 29: 158-160.
[9]李峰, 李典鹏, 蒋水元.罗汉果栽培与开发利用[M]. 北京: 中国林业出版社, 2003.
[10]陈全斌, 义祥辉, 余丽娟, 等.不同生长周期的罗汉果鲜果中甜甙Ⅴ和总黄酮含量变化规律研究[J]. 广西植物, 2005, 25(3): 274-277.
[11]LI Dianpeng, IKEDA T, HUANG Yonglin, et al. Seasonal variation of mogrosides in Lo Han Kuo (Siraitia grosvenori) fruits[J]. Nat Med, 2007, 61: 307-312.
[12]LI Dianpeng, IKEDA T, MATSUOKA N, et al. Cucurbitane glycosides from unripe fruits of Lo Han Kuo (Siraitia grosvenori)[J]. Chem Pharm Bull, 2006, 54(10): 1425-1428.
[13]LI Dianpeng, IKEDA T, NOHARA T, et al. Cucurbitane glycosides from unripe fruits of Siraitia grosvenori[J]. Chem Pharm Bull, 2007, 55 (7): 1082-1086.
[14]CHEN Chu, ZHANG Hao, XIAO Wei, et al. High-performance liquid chromatographic fingerprint analysis for different origins of sea buckthorn berries[J]. Journal of Chromatography A, 2007, 1154: 250-259.
[15]LIU Aihua, LIN Yanhua, YANG Min, et al. Development of the fingerprints for the quality of the roots of Salvia miltiorrhiza and its related preparations by HPLC-DAD and LC-MSN[J]. Journal of Chromatography B, 2007, 846: 32-41.
[16]陈全斌, 沈钟苏, 韦正波, 等. 罗汉果黄酮的活血化瘀药理作用研究[J]. 广西科学, 2005, 12(4): 316-319.
HPLC Fingerprints of Siraitia grosvenorii at Different Growth Stages
LU Feng-lai,LIU Jin-lei,HUANG Yong-lin,LI Dian-peng*
(Guangxi Institute of Botany, Chinese Academy of Science, Guilin 541006, China)
In order to explore quality change of Siraitia grosvenorii, confirm the crucial growth stage and the best harvesting season, guide the production of Siraitia grosvenorii according to GAP, and establish a method of quality control, high performance liquid chromatography (HPLC) was used to analyze the fingerprints of characteristic chemical components in Siraitia grosvenorii at different growth stages. Meanwhile, quality change of Siraitia grosvenorii at different growth stages was investigated through hierarchical cluster analysis and identification of characteristic peaks. Results showed that characteristic chemical components in Siraitia grosvenorii exhibited an obvious difference at various growth stages and different cultivated varieties. Therefore, fingerprinting of characteristic chemical components was an effective and all-directional quality control strategy for traditional Chinese herbal materials and promising application values for the guidance of herbal cultivation.
Siraitia grosvenorii;chromatogram fingerprint;HPLC;hierarchical cluster analysis
O621.1
A
1002-6630(2010)18-0283-05
2010-01-14
桂林市科技经费项目(20070304-2);广西植物研究所基本科研业务费资助项目(桂植业09010)
卢凤来(1979—),女,助理研究员,硕士,主要从事植物资源开发与利用研究。 E-mail:lufenglai@gxib.cn
*通信作者:李典鹏(1968—),男,研究员,博士,主要从事植物资源开发与利用研究。E-mail:ldp@gxib.cn

