高效液相色谱法测定果蔬中7种植物激素的残留量
周艳明,忻 雪
(沈阳农业大学分析测试中心,辽宁 沈阳 110866)
高效液相色谱法测定果蔬中7种植物激素的残留量
周艳明,忻 雪
(沈阳农业大学分析测试中心,辽宁 沈阳 110866)
建立高效液相色谱法测定果蔬中7种植物激素残留的方法。选择10种果蔬样品,经体积分数80%甲醇提取后、过C18柱净化,用带有紫外检测器的液相色谱仪测定,外标法定量。通过对该方法的精密度和加标回收实验,所有激素的添加回收率均在70.23%~98.10%之间,回收率的变异系数在3.34%~10.12%之间,方法的最低检出限为0.004~0.02mg/kg、最低定量限为0.01~0.1mg/kg,所建立的果蔬中植物激素残留量的测定方法满足国家标准对食品中农药残留测定的要求,可提供给相关部门用于对相关农产品、食品的质量监控。
高效液相色谱法;果蔬;植物激素
植物激素是植物体内合成的对植物生长发育有显著作用的集中微量有机物质,其生理效应非常复杂、多样。植物激素影响细胞的分裂、伸长、分化及植物发芽、生根、开花、结实、性别的决定、休眠和脱落等[1-2],所以植物激素对植物的生长发育有重要调节控制作用。
在进行高效液相色谱法测定时选择合适的植物激素提取纯化方法和色谱条件极为重要。如果提取纯化方法不当,样品中含有的杂质较多,将难以对目的组分进行有效分离,不能达到检测目的[3-4];如果没有合适的色谱条件,测定时会出现分离差、峰型不良及严重拖尾现象。目前,大多液相色谱法只能同时测定3~5种植物激素。本方法旨在建立高效液相色谱法同时分离测定果蔬中7种植物激素含量。
1 材料与方法
1.1 材料与试剂
番茄、黄瓜、辣椒、萝卜、茄子、葡萄、苹果、桃子、梨、西瓜 沈阳农业大学果园。
甲醇、乙酸乙酯(纯度大于99%) 国药集团化学试剂有限公司;无水甲酸(纯度大于99%) 沈阳化学试剂厂;甲醇(色谱纯)、吲哚乙酸(IAA)、玉米素(ZTK)、萘乙酸(NAA)、脱落酸(ABA)、吲哚丁酸(IBA)、烯效唑(Uniconazole)、调吡脲(Forchlorfenuron)(纯度均大于99%) Dikma公司。
1.2 仪器与设备
1100高效液相色谱仪(配有DAD紫外检测器) 美国Agilent公司;C18固相萃取柱 Waters公司;C18色谱柱(250mm×46mm,5μm) Dikma公司;1602电子分析天平(万分之一精度) 德国Satorius公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 色谱条件
色谱柱:C18色谱柱(250mm×46mm,5μm);流动相:A:0.2%甲酸,B:甲醇;柱温:35℃;进样量20μL。
1.3.2 样品处理
提取:称取切碎后的样品5g放入称量瓶中,加入10mL体积分数80%甲醇提取剂,超声振荡15min,抽滤,用2×5mL的提取剂洗涤残渣,抽滤,合并3次滤液,倒入鸡心瓶中,用少量的甲醇冲洗布什漏斗内壁,由旋转蒸发仪(40℃)浓缩至水相[5]。
净化:将浓缩后的水相调pH7.0,用乙酸乙酯进行液液萃取(3×5mL),挥干乙酸乙酯,用5%甲醇1mL定容,过SPE-PAK C18固相萃取小柱,用4mL 40%甲醇溶液洗脱,收集上样液和洗脱液(共5mL),过0.45μm滤膜,即为待测液[6-11]。
2 结果与分析
2.1 色谱条件的选择
2.1.1 流动相的选择
以甲醇-水溶液作为流动相7种激素不能完全分开,而且色谱峰拖尾严重,峰形较差。甲酸可以抑制样品的电离,改善拖尾现象,因此在流动相中加入甲酸。在甲醇-水溶液中分别加入体积分数为1%、0.5%和0.2%的甲酸进行实验,进样质量浓度1μg/mL,结果见图1。
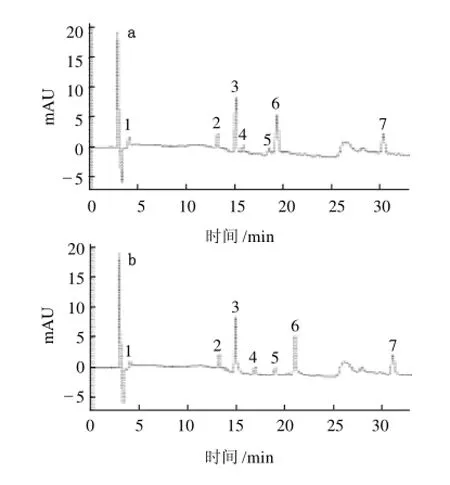
图1 不同流动相7种植物激素色谱图Fig.1 Chromatograms of 7 kinds of plant hormone using a 1%, 0.5% and 0.2% formic acid solution/methanol mixture as the mobile phase
由图1可知,当加入甲酸体积分数为1%时,部分峰重叠,没有完全分开;当加入甲酸体积分数为0.5%时,激素峰有拖尾现象;因此确定水相中的甲酸体积分数为0.2%,既能保证7种激素完全分开,又有效去除拖尾现象,使峰形最佳,并且可避免酸度过大损伤色谱柱填料。
2.1.2 梯度洗脱条件的确定
影响分离的最主要因素是梯度洗脱的选择[12],根据7种植物激素的性质,分别对以下3种洗脱条件进行实验,洗脱条件见表1,色谱图见图2。

表1 不同梯度洗脱条件的选择Table 1 Screening of gradient elution program
由图2可见,条件1中吲哚乙酸和脱落酸的色谱峰不能完全分开且α-萘乙酸的峰形不佳;条件3中吲哚丁酸和α-萘乙酸的色谱峰相隔较近且脱落酸稍有拖尾现象;相比之下条件2时,7种植物激素不但能够得到较好的分离,且保证了出峰时间和峰形都较为适宜,故选择条件2的梯度洗脱。
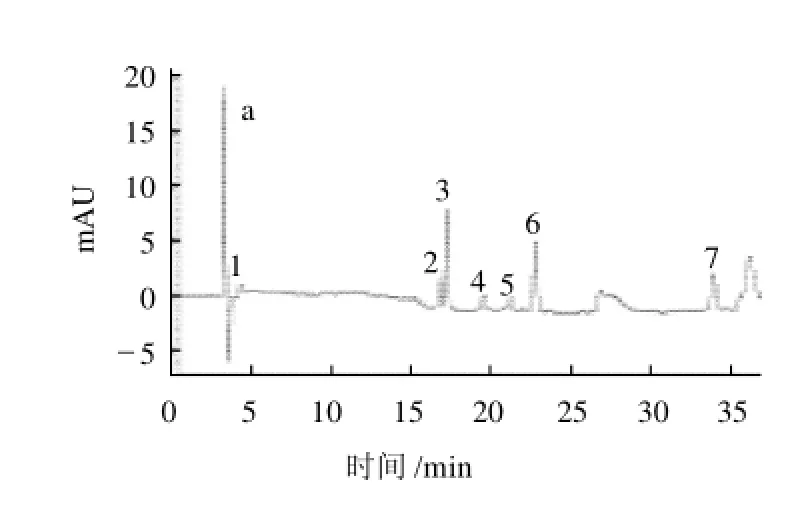
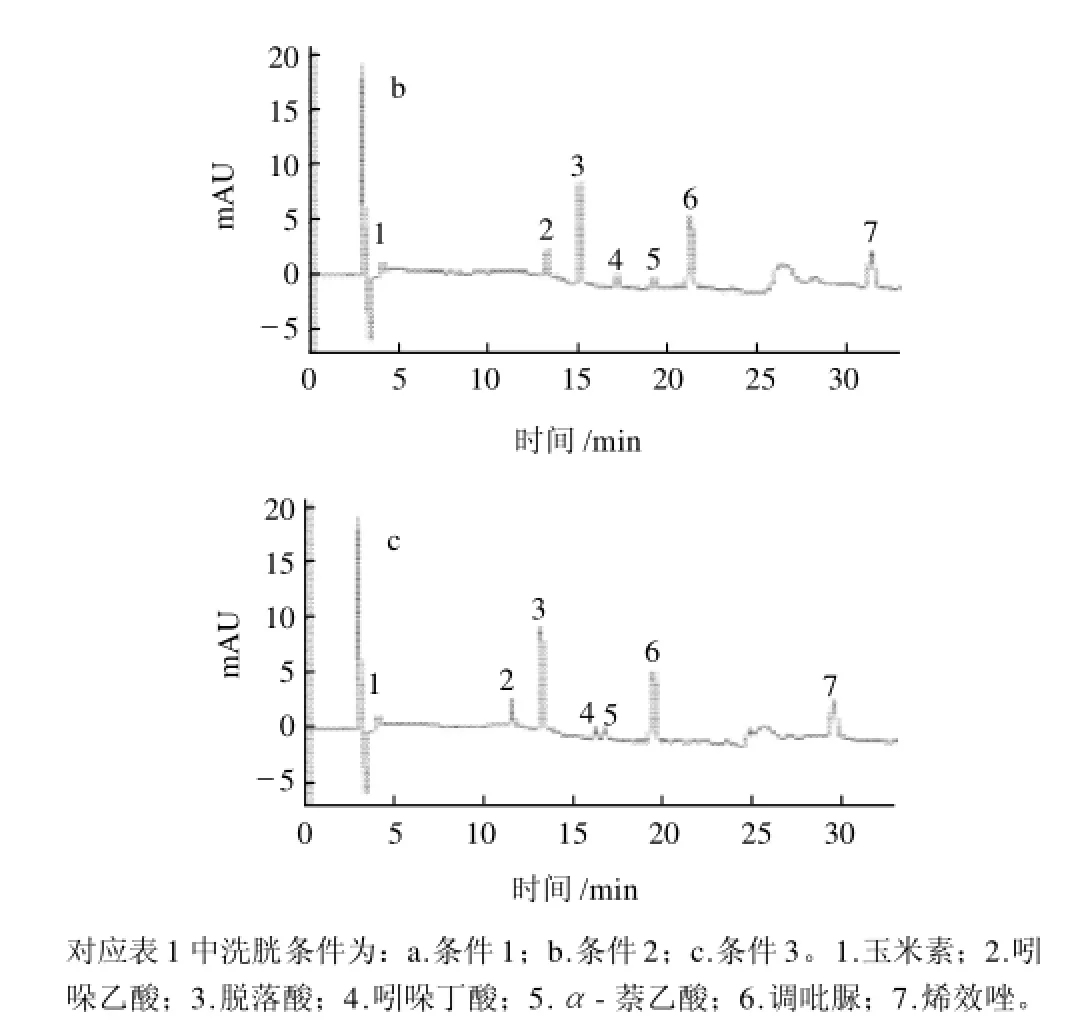
图2 不同梯度洗脱条件7种植物激素的色谱图Fig.2 Chromatograms of 7 kinds of plant hormone under gradient elution protocol No. 1, No. 2 and No. 3
2.27 种植物激素的线性范围
配制10、5、2、1、0.5、0.1μg/mL质量浓度的7种植物激素标准混合溶液,得出其线性方程及相关系数见表2,在0.5~10μg/mL线性关系良好。
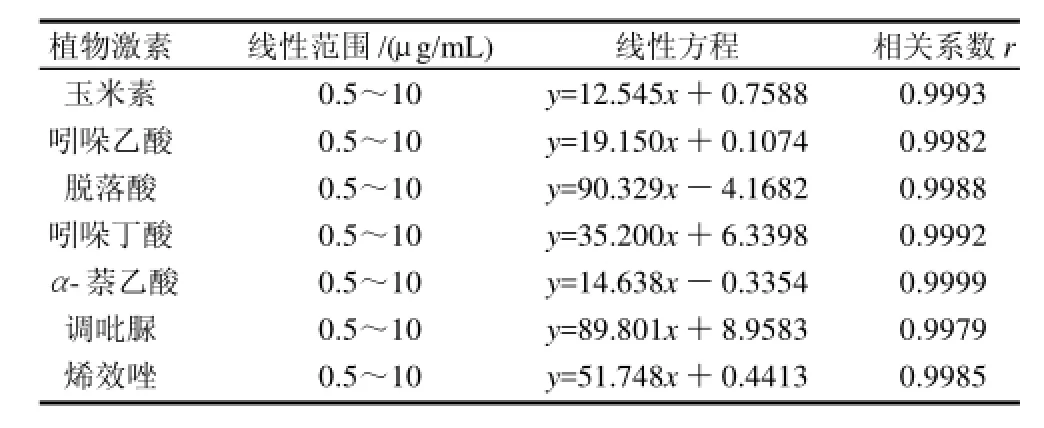
表2 7种植物激素的线性范围、线性方程及相关系数Table 2 Linear ranges, regression equations and correlation coefficients for the determination of 7 kinds of plant hormone
由表2可知,标准溶液质量浓度在0.5~10μg/mL之间,质量浓度与其色谱响应间呈线性,7种植物激素的线性方程的相关系数均大于0.997,呈现出良好的线性关系。
2.3 检出限
在本实验选定的色谱条件下,黄瓜添加0.2mg/kg植物激素标准品的色谱图见图3。

式中:C为样品添加水平0.2mg/kg;信噪比RSN分别为玉米素24.5、吲哚乙酸39.3、脱落酸169.2、吲哚丁酸30.3、α-萘乙酸22.4、调吡脲105.1、烯效唑88。
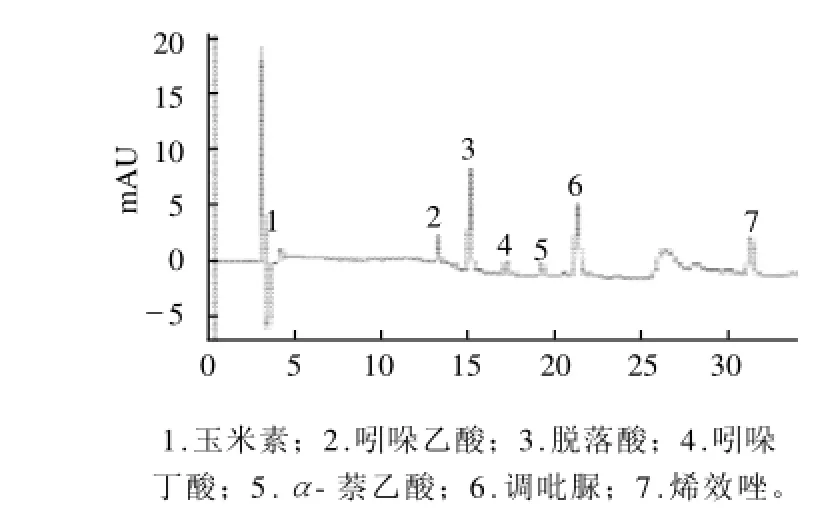
图3 添加0.2mg/kg的黄瓜样品的色谱图Fig.3 Chromatogram of cucumber sample with the addition of 0.2 mg/kg plant hormone
由式(1)计算得7种植物激素的最低检出限分别为:玉米素0.02mg/kg、吲哚乙酸0.02mg/kg、脱落酸0.004mg/ kg、吲哚丁酸0.02mg/kg、α-萘乙酸0.02mg/kg、调吡脲0.006mg/kg、烯效唑0.007mg/kg。7种植物激素的最低检出限范围在0.004~0.02mg/kg之间。
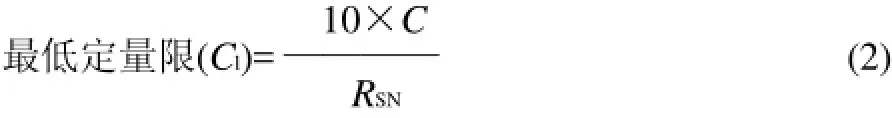
式中:C为样品添加水平0.2mg/kg;信噪比RSN分别为玉米素24.5、吲哚乙酸39.3、脱落酸169.2、吲哚丁酸30.3、α-萘乙酸22.4、调吡脲105.1、烯效唑88。
由式(2)计算得7种植物激素的最低定量限分别为玉米素0.1mg/kg、吲哚乙酸0.1mg/kg、脱落酸0.01mg/kg、吲哚丁酸0.1mg/kg、α-萘乙酸0.08mg/kg、调吡脲0.02mg/kg、烯效唑0.02mg/kg。7种植物激素的最低定量限范围在0.01~0.1mg/kg之间。
2.4 精密度
以苹果为例,在苹果中添加3个水平的7种植物激素,测定的回收率和变异系数结果见表3。
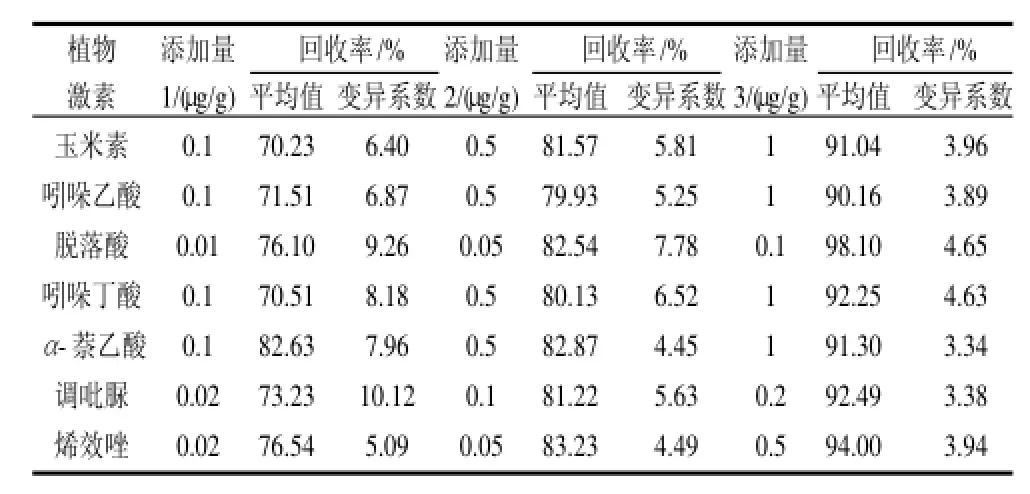
表3 苹果中7种植物激素加标回收率及精密度(n=5)Table 3 Recovery and RSD of 7 plant hormones in apple (n=5)
由表3可见,所有激素的添加回收率均在70.23%~98.10%之间,回收率的变异系数在3.34%~10.12%之间,回收效果较好,精密度较高。
3 结 论
实验数据和图谱表明该方法快速,灵敏度高、精密度好、准确度高。7种植物激素的最低检出限分别为:玉米素0.02mg/kg、吲哚乙酸0.02mg/kg、脱落酸0.004mg/kg、吲哚丁酸0.02mg/kg、α-萘乙酸0.02mg/ kg、调吡脲0.006mg/kg、烯效唑0.007mg/kg;所有激素的添加回收率均在70.23%~98.10%之间,回收率的变异系数在3.34%~10.12%之间。该方法的最低检出限为0.004~0.02mg/kg、最低定量限为0.01~0.1mg/kg,可满足农药测定的要求,给相关部门对农产品、食品的质量监控。
[1]谈锋. 植物激素的高效液相色谱[J]. 植物生理学通讯, 1986(5): 15-23.
[2]仲维科, 郝戬, 樊耀波, 等. 食品农药残留分析进展[J]. 分析化学, 2000, 28(7): 904-910.
[3]谢君. 高效液相色谱测定多种植物内源激素方法研究[J]. 四川农业大学学报, 1997, 15(2): 297-299.
[4]丁静, 沈镇德, 方亦雄. 植物内源激素的提取分离和生物鉴定[J]. 植物生理学通讯, 1979(2): 27-39.
[5]程雪梅. 色谱分析样品前处理技术-固相萃取法[J]. 热带农业工程, 2002(1): 14-16.
[6]CAO J, MURCH S J, O'BRIEN R, et al. Rapid method for accurate analysis of melatonin, serotonin and auxin in plant samples using liquid chromatography tandem mass spectrometr[J]. Journal of Chromatography A, 2006, 1134(1/2): 333-337.
[7]陈建华, 曹阳, 李昌珠, 等. 板栗内源激素的高效液相色谱测定方法[J]. 中南林学院学报, 2004, 24(5): 39-41.
[8]吴耕西, 陈美霞, 付蕾, 等. 高效液相色谱法分析苹果新根中的细胞分裂素[J]. 山东农业大学学报, 1996, 27(3): 341-345.
[9]张卫炜, 杨永珍. 氯吡脲的研究及应用进展[J]. 农药科学与管理, 2006, 27(5): 36-40.
[10]陈长龙, 李建中, 王会利, 等. 氯吡脲在土壤和西瓜中的残留分析[J].环境化学, 2006, 25(6): 789-792.
[11]DOBREV P I, HAVLEK L, VGNER M, et al. Purification and determination of plant hormones auxin and abscisic acid using solid phase extraction and two dimensional high performance liquid chromatography[J]. Journal of Chromatography A, 2005, 1075: 159-166.
[12]徐爱军, 高桂枝, 汤莉莉. 梯度洗脱测定植物源调节剂中内源激素方法探讨[J]. 分析试验室, 2007, 26(9): 51-55.
Determination of Plant Hormone Residues in Vegetables and Fruits by High Performance Liquid Chromatography
ZHOU Yan-ming,XIN Xue
(Analysis and Testing Center, Shenyang Agricultural University, Shenyang 110866, China)
A high performance liquid chromatography (HPLC) method for determining plant hormone residues in vegetables and fruits was established. Sample preparation was accomplished after extraction with 80% methanol and clean-up on a C18 column prior to analysis using a HPLC system equipped with a UV detector and subsequent quantification by external standard method. The average spike recoveries for 10 species of vegetables or fruits such as tomato, cucumber, capsicum, etc were between 70.23% and 98.10%, with a variation coefficient ranging from 3.34% to 10.12%. The limit of detection of this method was between 0.004 mg/kg and 0.02 mg/kg, and the limit of quantification between 0.01 mg/kg and 0.1 mg/kg. This method meets the national requirements for pesticide determination and is applicable to food quality supervision and control.
high liquid chromatography;fruits and vegetables;plant hormone
TS207.53
A
1002-6630(2010)18-0301-04
2009-11-07
周艳明(1955—),女,教授,硕士,研究方向为食品质量与控制。E-mail:syauzym@163.com

