番茄叶色黄化突变体的遗传分析及SSR分子标记
郭 明 张 贺 李景富
(东北农业大学园艺学院,黑龙江 哈尔滨 150030)
叶色突变是自然界比较常见的一种突变,由于突变基因往往是直接或间接影响叶绿素的合成和降解,改变叶绿素含量,所以叶色突变体也称为叶绿素突变体(何冰 等,2006)。对叶色突变的研究开始得较早,在20世纪30年代就有报道,在水稻(吴殿星 等,1997)、大豆(Honeycutt et al.,1990;马国荣 等,1994)、大麦(史俊通 等,1998)、小麦(苏小静 等,1990)、棉花(肖松华 等,1995)、西瓜(Whitaker,1952)等多种作物中获得了此类突变体。研究表明,叶色突变体作为一种特殊的材料,对研究高等植物的光合机理(Fambrini et al.,2004)、叶绿素的生物合成、叶绿体的结构、功能与发育以及它们的分化和遗传控制(Parks & Quail,1991)、分析鉴定基因功能(Hansson et al.,1999)、了解基因间互作(Lopez-Juez et al.,1998)有特殊价值,同时在育种工作中,叶色突变作为标记性状用于简化良种繁育和杂交制种,在生产实践中具有重要的意义。国内外关于叶色突变体的研究主要集中在水稻、小麦等大田作物,而关于番茄(Lycopersicon esculentum Mill.)叶色突变的报道较少。Terry和Kendrick(1999)报道番茄黄叶突变体au和yg-2为核隐性基因突变,分别是血红色素加氧酶和植物光敏色素合酶基因发生突变。王彦杰等(2007)以叶黄素缺失的番茄突变体为材料,研究叶黄素合成突变与光能分配和抗氧化酶活性的关系,结果表明叶黄素缺失体主要通过降低光能吸收和提高抗氧化能力来避免过剩光能导致光氧化胁迫的产生。
东北农业大学番茄课题组于1998年在田间露地种植的中蔬 4号中发现自然突变的番茄叶色突变株,该突变株叶色黄化,成株苗叶片有黄斑,结果前期果实发白,转色慢,但果实能正常转为红色,果实硬度大。将该突变株单独留种,经过多代自交形成遗传稳定的黄叶突变系。发现初期以果实颜色命名该突变体为番茄“白化”突变体(李景富 等,2006),后更名为番茄叶色黄化突变体。本试验对该番茄叶色黄化突变体的遗传和相关基因的初步定位进行研究,旨在为今后该基因的精细定位、克隆及其在育种中的应用奠定基础。
1 材料与方法
1.1 供试番茄材料及遗传分析和定位群体的构建
突变体材料:番茄叶色黄化突变体06883,系番茄中蔬4号06884中发现的自然突变株,经6 a观察,突变性状能够稳定遗传。常规材料:中蔬4号06884,栽培品种04973。以上材料均由东北农业大学番茄研究所提供。利用番茄叶色黄化突变体06883与中蔬4号配制正反杂交组合,F1自交获得F2。F2群体用于番茄叶色黄化性状的遗传分析。将番茄叶色黄化突变体06883与04973杂交。F1自交获得F2,该群体用于相关基因的分子定位。
1.2 遗传分析方法
利用人工去雄、授粉的常规有性杂交法,将叶色黄化突变体与中蔬4号进行正反交试验。F1单粒留种,单株收获并贮藏。在苗期分别观察统计 F1、F2表型和植株数,并对统计结果进行χ2检测。
1.3 DNA的提取
取番茄鲜嫩叶片,采用CTAB法提取亲本和群体单株DNA,参照王关林和方宏筠(2002)的方法略作修改。用 Eppendouf蛋白核酸测定仪测定 DNA浓度,然后用去离子水将其稀释至 50ng·μL-1。
1.4 番茄黄化突变基因的SSR分子标记
共选用339对SSR引物用于筛选与叶色黄化突变基因连锁的标记,SSR引物序列分别来自SOL Genomics Network(http://www.sgn.cornell.edu/index.pl)及文献(Suliman-Pollatschek et al.,2002;He & Poysa,2003),覆盖番茄的12条染色体,能够对叶色黄化突变基因进行初步定位。引物由上海生工生物工程有限公司合成。反应体系:模板 DNA 20ng,1×PCR Buffer,dNTP 0.2 mmol·L-1,MgCl22.0mmol·L-1,引物 0.3 μmol·L-1,Taq DNA polymerase 1 U,加 ddH2O 补至20μL。在BiometraPCR仪上进行扩增,反应条件为:94 ℃下预变性5 min,94 ℃下变性1 min,Tm值(45~55 ℃)下退火1 min,72 ℃下延伸2 min,38个循环;最后72 ℃下延伸10min后保存在4 ℃条件下。反应产物加入5 μL变性液,在PCR仪中95 ℃变性5 min后立即置于冰水混合物中。用6 %的变性聚丙烯酰胺凝胶电泳,100V电泳约1 h。最后银染显色分析。
1.5 数据分析
SSR为共显性标记,分离后代同父本04973的纯和带型记为“1”,同母本06883的纯和带型记为“2”,两亲本的杂合带型记为“3”,带型模糊或缺失记为“0”。利用Mapmaker/EXP 3.0构建分子标记连锁图谱,应用Mapchart 2.1软件绘制遗传图谱。
2 结果与分析
2.1 叶色黄化突变体的表型特征
06883叶色黄化突变体经连续6 a观察,群体均表现出黄化,无分离现象,性状稳定。该突变体子叶颜色展平时与正常植株一样为绿色,约10d后,突变体子叶颜色渐渐变黄,且颜色均匀。随着苗龄的延长,新出的真叶为正常绿色,至四叶一心期,第一片真叶从叶尖边缘向叶基部开始失绿,直至整个叶片变黄,最后衰老、死亡的叶片颜色几乎为白色。在植株生长过程中,叶片变黄的同时,主茎颜色也由绿色慢慢变成黄色,且靠近土壤的植株茎部颜色呈淡紫红色。叶色黄化突变体与正常植株叶色有明显差异,表现出不同程度的黄化现象,由下至上,黄化程度依次减弱,仅新出叶片为绿色,而突变体与正常植株在生长势上没有显著差异。突变体果实呈白色,转色非常慢,但成熟后期能够转为红色,且果实产量与中蔬4号06884差异不显著,硬度大,耐贮藏。
2.2 叶色黄化突变体的遗传分析
叶色黄化突变体06883与中蔬4号的正反交试验显示,F1群体均表现为正常植株叶色,观察结果说明叶色黄化性状为隐性性状。其F2群体均分化出叶色黄化突变株和正常绿色株两种类型,说明叶片黄化性状受主效基因控制。F2中绿叶和黄化叶的分离比值都接近3∶1(表1),卡方测验差异均不显著。说明该性状是受1对隐性主效核基因控制。

表1 中蔬4号与叶色黄化突变体06883正反交后代的分离表现
2.3 番茄叶色黄化基因的定位
用SGN上已经公布在1~12条染色体上的159对SSR标记和相关文献上的188对SSR引物,对突变体和普通栽培品种04973进行多态性分析,经过初步筛选,发现共有20对SSR标记在两亲本之间表现出多态性。再利用BSA法在F2中建立混合基因池,对这20对引物进行再次筛选,最终发现有13对引物表现与分离群体表现一致。进一步用这13对多态性SSR标记对F2群体225个单株进行连锁分析,最终有3对引物与该突变基因连锁。3对引物的名称及序列见表2。

表2 与突变基因连锁的SSR引物名称及序列
结果发现番茄叶色黄化基因位于第11条染色体上,与LEaat006、LEtat002和Tom196-197连锁,与它们的连锁距离分别为8.9、16.3和18.7cM(图2)。Tom196-197在分离群体黄绿叶个体中的表现见图1。

图1 SSR引物Tom196-197在两亲本质检的多态性及其在F2部分分离群体中的分离情况
3 讨论
叶色突变是自然发生突变频率较高的一种变异,造成叶色突变的原因很多,突变的类型也较多(苗晗 等,2007)。目前报道比较常见的是温敏型叶色突变体,如温敏型水稻叶色突变体W1在高温下幼苗为正常绿色,而在低温(15~20℃)下表现白化(崔海瑞 等,2001);小麦返白系在苗期表现正常,但春季小麦返青时,返白系自心叶基部白化,后自下而上逐叶白化面积加大,随温度升高,又自心叶基部复绿(郭蔼光 等,1991)。而另一类常见的叶色突变体的表现不受环境影响,如国艳梅等(2003)从黄瓜雌性系9110G中发现能够稳定遗传的叶色突变体;在水稻品种武运粳7号中发现黄绿叶自然突变体(王军 等,2006);曹莉等(2006)在小麦西农 1718高代品系中发现自发黄化突变体等。此类突变体的叶色突变性状能够稳定遗传,不受环境影响,能够作为叶色指示性状的标准,可以应用于苗期标记辅助选择育种中。本课题组发现的叶色黄化突变体是自然诱发的叶色突变体,经连续多代自交后发现是能稳定遗传不受环境影响的叶色突变体。遗传分析表明,该叶色黄化性状受1对隐性核基因控制,田间特征表现为子叶展开15 d后变为黄色,真叶于四叶一心期开始转色,茎为黄色而茎根部为淡紫红色,这些性状都可以作为苗期标记性状应用于育种工作中。
某些叶色突变体具有特殊的优良性状,为作物遗传育种提供了优秀的种质资源。Gan和Amasino(1995)曾用转基因技术诱发了1个烟草常绿突变体,此种突变体的生物学产量和种子产量分别增加了40%和52 %。陆地棉黄绿苗突变体浙12-12N幼苗期真叶叶绿素含量仅为常绿苗泗棉2号的66 %,其各叶位叶片的水分利用率、光能利用率及净光合速率却高于泗棉2号,其子棉产量和皮棉产量较泗棉2号有所提高(戴日春 等,1995)。张贺(2008)对番茄叶色黄化突变体的光合特性进行研究发现,在高光照强度下突变体的净光合速率降低的幅度高于正常叶色植株,但在低光照强度(200μmol·m-2·s-1)下突变体净光合速率却高于正常叶色植株,说明该突变体是较好的耐弱光材料。同时,孟凡娟等(2006)对番茄叶色黄化突变体果实的研究发现,突变体果实内色素含量低于正常品种,耐贮性和硬度都优于正常品种,但与一般耐贮品种品质相比,突变体果实的品质与正常品种相差不大。
番茄叶色突变体报道研究较深入的是au和yg-2突变体(Terry & Kendrick,1996;van Tuinen et al.,1996),Balint-Kurti等(1995)应用RFLP技术将au基因定位在第11条染色体上,van Tuinen等(1997)同样应用 RFLP技术验证了 Kerr(1979)提出的 yg-2基因可能在第12条染色体上的结论。本课题组前期已经对该叶色黄化突变体的形态、生理性状等进行了系统的研究。本试验中,应用SSR分子标记技术对番茄叶色黄化突变体进行了初步定位,将相关突变基因定位在第11条染色体上两个标记LEaat006和LEtat002之间,后续的工作将对LEaat006和LEtat002区段进行新标记的开发及精细作图,并为最终图位克隆该基因奠定基础。
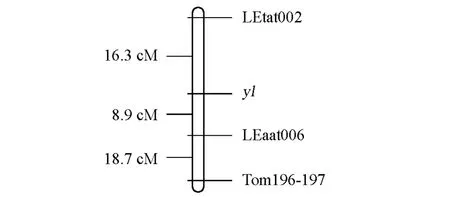
图2 番茄叶色黄化控制基因的遗传定位
曹莉,王辉,孙道杰,冯毅.2006.小麦黄化突变体光合作用及叶绿素荧光特性研究.西北植物学报,26(10):2083-2087.
崔海瑞,夏英武,高明尉.2001.温度对水稻突变体W1叶色及叶绿素生物合成的影响.核农学报,15(5):269~273.
戴日春,薛建明,朱军.1995.陆地棉新的黄绿苗突变体浙12-12N叶绿体含量与净光合速率研究.棉花学报,7(3):145-149.
郭蔼光,王振镒,汪沛洪.1991.小麦返白系的白化特征及其与环境因素的关系.西北植物学报,11(5):122-126.
国艳梅,顾兴芳,张春霞,方秀娟,张圣平,徐彩青.2003.黄瓜叶色突变体遗传机制的研究.园艺学报,30(4):409-412.
何冰,刘玲珑,张文伟,万建民.2006.植物叶色突变体.植物生理学通讯,42(1):1-9.
李景富,孟凡娟,许向阳,康立功.2006.番茄“白化”突变体的发现及作为育种材料的鉴定.园艺学报,33(2):384.
马国荣,刘佑斌,盖钧镒.1994.大豆细胞质遗传芽黄突变体的发现.作物学报,20(3):334-337.
孟凡娟,许向阳,李景富.2006.番茄“白化”突变体果实的几个生理生化特性检测.植物生理学通讯,42(1):109-110.
苗晗,顾兴芳,张圣平,王晓武.2007.蔬菜叶色突变体研究进展.中国蔬菜,(6):39-42.
史俊通,宋璐,高如嵩.1998.大麦叶色转换突变系转色机理及其调控研究.西北农业学报,7(2):28-31.
苏小静,汪沛洪,陈毓荃.1990.小麦突变体返白系返白机理的研究:Ⅱ、返白阶段叶绿素代谢变化研究.西北农林科技大学学报:自然科学版,18(3):80-84.
王关林,方宏筠.2002.植物基因工程.北京:科学出版社.
王军,王宝,周丽慧,徐洁芬,顾铭洪,梁国华.2006.一个水稻新黄绿叶突变体基因的分子定位.中国水稻科学,20(5):455-459.
王彦杰,夏晓剑,周艳虹,喻景权.2007.番茄叶黄素合成突变与光能分配和抗氧化酶活性的关系.园艺学报,34(5):1301-1304.
吴殿星,夏英武,舒庆尧,张耀洲,刘贵付.1997.利用RAPD技术检测转绿型白化突变系W25基因组的变化.核农学报,11(2):89-92.
肖松华,张天真,潘家驹.1995.陆地棉芽黄突变体的遗传及在杂种优势上的利用.南京农业大学学报,18(3):28-33.
张贺.2008.番茄突变体叶片黄化生理机制及相关基因克隆〔博士论文〕.哈尔滨:东北农业大学.
Balint-Kurti P J,Jones D A,Jones J D G.1995.Integration of the classical and RFLP linkage maps of the short arm of tomato chromosome 1.Theor Appl Genet,90:17-26.
Fambrini M,Castagna A,Vecchia F D,Degl’ Innocenti E,Ranieri A,Vernieri P,Pardossi A,Guidi L,Rascio N,Pugliesi C.2004.Characterization of a pigment-deficient mutant of sunflower(Helianthus annuus L.)with abnormal chloroplast biogenesis,reduced PS Ⅱactivity and low endogenous level of abscisic acid.Plant Sci,167:79-89.
Gan S,Amasino R M.1995.Inhibition of leaf senescence by auto regulated production of cytokinin.Science,270:1986-1988.
Hansson A,Kannangara C G,van Wettstein D,Hansson M.1999.Molecular basis for semidominance of missense mutations in the XANTHA-H(42-kDa)subunit of magnesium chelatase.Proc Nat Acad Sci USA,96(4):1744-1749.
He C V,Poysa K Y.2003.Development and characterization of simple sequence repeat(SSR)markers and their use in determining relationships among Lycopersicon esculentum cultivars.Theor Appl Genet,106:363-373.
Honeycutt R J,Newhouse K E,Palmer R G.1990.Inheritance and linkage studies of a variegated leaf mutant in soybean.Journal of Heredity,81(2):123-126.
Kerr E A.1979.Yellow-green-2(yg-2)may be on chromosome 12.Tomato Genet Coop Rep,29:27.
Lopez-Juez E,Jarvis R P,Takeuchi A,Page A M,Chory J.1998.New Arabidopsis cue mutants suggest a close connection between plastid and phytochrome regulation of nuclear gene expression.Plant Physiol,118:803-815.
Parks B M,Quail P H.1991.Phytochrome-deficient hy1 and hy2 long hypocotyls mutants of Arabidopsis are defective in phytochrome chromophore biosynthesis.Plant Cell,3:1177-1186.
Suliman-Pollatschek S,Kashkush K,Shats H,Hillel J,Lavi U.2002.Generation and mapping of AFLP,SSRs and SNPs in Lycopersicon esculentum.Cellular & Molecular Biology Letters,7:583-597.
Terry M J,Kendrick R E.1996.The au and yg-2 mutants of tomato are deficient in phytochrome chromophore synthesis.Biol Chem,271:21681-21686.
Terry M J,Kendrick R E.1999.Feedback inhibition of chlorophyll synthesis in the phytochrome chromophore-deficient aurea and yellow-green-2 mutants of tomato.Plant Physiol,119:143-152.
van Tuinen A,Hanhart C J,Kerckhoffs L H J,Nagatani A,Boylan M T,Quail P H,Kendrick R E,Koornneef M.1996.Analysis of phytochrome-deficient yellow-green-2 and aurea mutants of tomato.Plant,9:173-182.
van Tuinen A,Cordonnier-Pratt M M,Pratt LH,Verkerk R,Zabel P,Koornneef M.1997.The mapping of phytochrome genes and photomorphogenicmutants of tomato.Theor Appl Genet,94:115-122.
Whitaker T W.1952.Genetic and chlorophyll studies of a yellow-green mutant in muskmelon.Plant Physiol,27:263-268.

