不同样品制备方法对RP-HPLC法测定附子生物碱含量的影响Δ
侯大斌,赵祥升
(西南科技大学生命科学与工程学院,绵阳市 621010)
附子为毛茛科乌头Aconitum carmichaeli Debx.的子根,有效成分为乌头类生物碱:乌头碱(aconitine)、中乌头碱(mesaconitine)与次乌头碱(hypaconitine)等,是我国常用的中药和四川道地药材,具有抗炎、镇痛、强心、抗心律失常、降血糖、毒性等药理作用,有回阳救逆、补火助阳、散寒除湿的功效。近年来现代药理学研究证明,附子提取液还具有抗癌、抗衰老和增强免疫机能等作用[1~3]。附子中单一生物碱的检测最常用的是高效液相色谱(HPLC)法,并具有高温、高速、高灵敏度、高分辨度等优点,乌头碱类分子极性较强,比较适合用HPLC分析[4]。目前,附子中3种二萜生物碱HPLC法测定的样品制备方法比较多,本文主要比较不同附子样品制备方法的提取效果,选择合适的样品制备方法,优化3种生物碱的分离效果和出峰时间,为附子中3种生物碱含量的测定和附子质量控制提供科学的依据。
1 材料
1.1 仪器
1200LC-MS型液相色谱-质谱联用仪(包括紫外检测器,美国Varian公司);紫外-可见近红外光谱仪(日本岛津公司);旋转蒸发仪(瑞士Buchi公司);BP211D型电子分析天平(德国Sartorius公司);超纯水制造系统(上海优普实业有限公司);超声波清洗器(昆山市超声仪器有限公司);中草药粉碎机(天津泰斯特仪器有限公司);电热恒温鼓风干燥箱(上海福玛实验设备有限公司)。
1.2 试药
甲醇、乙腈、乙二胺为色谱纯,水为超纯水,其余试剂均为分析纯;乌头碱(批号:110797-200404)、新乌头碱(批号:110799-200404)、次乌头碱(批号:110798-200404)对照品(中国药品生物制品检定所);试验材料为2007年12月在四川江油附子GAP基地收获的新鲜附子,经西南科技大学侯大斌教授鉴定为A.carmichaeli Debx.的子根。附子先用自来水清洗干净,再用蒸馏水漂洗2次,切成0.3 cm厚的片状,装入牛皮纸袋放入烘箱,在105℃烘30 min,在60~70℃下烘干至恒重,粉碎过60目筛,4℃冰箱保存,备用。
2 方法与结果
2.1 样品制备方法
方法1:按2005年版《中国药典》(一部)方法[1]操作。方法2:将附子药材粉碎,过60目筛,取药材粉末0.5 g,加浓氨试液2 mL润湿,加乙醚20 mL,超声处理50 min,过滤,用乙醚洗涤3次,每次10 mL,收集、合并所有滤液,于水浴上挥干溶剂,加入甲醇溶解残渣,过滤,定容至10 mL的容量瓶中,作为供试品溶液。方法3:精密称取样品0.5 g,滴加浓氨水2 mL浸润,再加入20 mL二氯甲烷,超声处理50 min,过滤,浓缩,用二氯甲烷定容至10 mL的容量瓶中。方法4:精密称取样品0.5 g,加95%乙醇50 mL,加热回流2 h,回收溶剂,残渣用20 mL、pH值2~3的盐酸溶液溶解,用10 mL氯仿萃取3次,除去氯仿层,用NaOH溶液调节水溶液的pH值为9~10,再用氯仿萃取3次,蒸干氯仿,用甲醇定容至10 mL的容量瓶中,作为供试品溶液。方法5:精密称取样品0.5 g,滴加浓氨水2 mL浸润,加入95%的乙醇20 mL,超声处理50 min,以下步骤与方法4相同。
2.2 对照品溶液的制备
分别精密称取新乌头碱、乌头碱、次乌头碱对照品适量,分别置于10 mL容量瓶中,用乙腈溶解并定容,摇匀,得各单一成分对照品贮备液;其它不同浓度的对照品溶液由贮备液稀释得到。
2.3 色谱条件
色谱柱:Zorbax extend-C18(150 mm×4.6 mm,5.0 μm);流动相:乙腈-0.1%乙二胺(梯度洗脱:0→15→30→35→60种min,乙腈体积分数为35%→50%→75%→35%→35%);流速:1 mL·min-1;柱温:30 ℃;检测波长:240 nm。
2.4 试验条件的选择
2.4.1 检测波长的选择 已有文献报道,3种生物碱混合溶液的最大吸收波长有230、235、240 nm 3种[5~8]。将3种生物碱的3种溶液适量混合后检测,最大的吸收波长为240 nm。同时,在此波长下峰面积最大,达到基线分离,基线也更稳定,故确定检测波长为240 nm。
2.4.2 流动相的选择 新乌头碱、乌头碱、次乌头碱的极性由强到弱。在RP-HPLC中,由于醇-水系统热力学和可压缩性因素,在梯度洗脱时,易导致基线漂移[9],同时甲醇的洗脱能力不强。因此,在试验中选择了洗脱能力较强的乙腈作为流动相。流动相中加入乙二胺可以防止分离过程出现拖尾现象,达到改善色谱峰形和提高分离度的目的。比较不同配比乙腈-0.1%乙二胺溶液对新乌头碱、乌头碱、次乌头碱保留时间、分离度及峰形的影响,当乙腈的比例过大时,出峰虽然早,但是3个峰的分离效果不好。最后确定流动相为上述色谱条件时,3种生物碱的分离效果最优。色谱见图1。
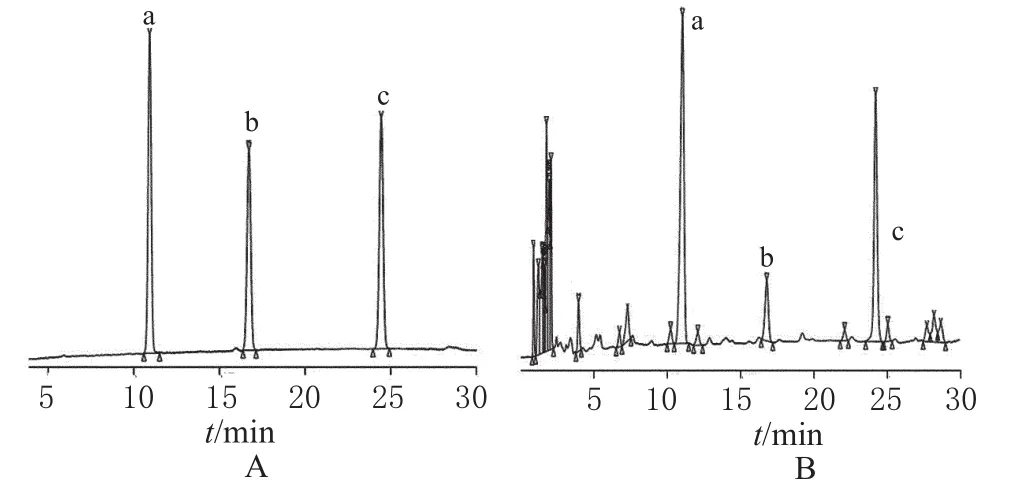
图1 高效液相色谱图A.对照品;B.供试品;a.新乌头碱;b.乌头碱;c.次乌头碱Fig 1 HPLC chromatogramsA.reference substance;B.test sample;a.mesaconitine;b.aconitine;c.hypaconitine
2.5 线性关系的考察
准确吸取新乌头碱、乌头碱、次乌头碱贮备液适量,分别置于10 mL容量瓶中,用乙腈稀释至刻度,振荡均匀,作为对照品稀释液。在同一色谱条件下分别进量20 μL,确定标准物质的保留时间。然后各取一定体积的贮备液配成不同浓度的混合对照品溶液,分别平行测定3次(均进样20 μL),以平均峰面积(Y)为纵坐标,质量浓度(X,μg·mL-1)为横坐标,进行线性回归。各物质的回归方程、相关系数和线性范围见表1。
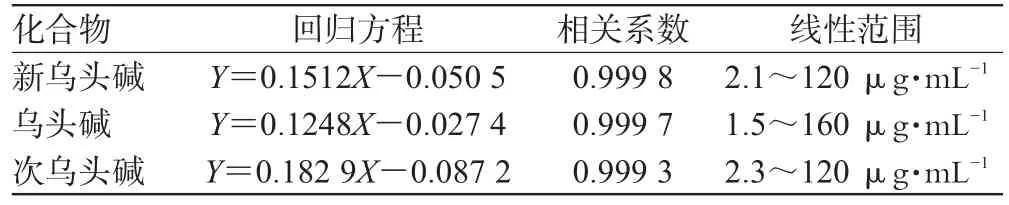
表1 3种生物碱的回归方程、相关系数和线性范围Tab 1 Regression equations,correlation coefficients and linear ranges of 3 kinds of alkaloids
2.6 不同样品制备方法的生物碱含量测定
在上述色谱条件下,取不同方法制备处理的供试品溶液适量,用0.45 μm微孔滤膜滤过,取20 μL为进样量,分别平行进样3次,以平均峰面积按回归方程计算浓度。不同处理方法测得3种生物碱的含量见表2。结果,“方法2”的提取率最高,3种生物碱的含量在各处理方法中均是最高。
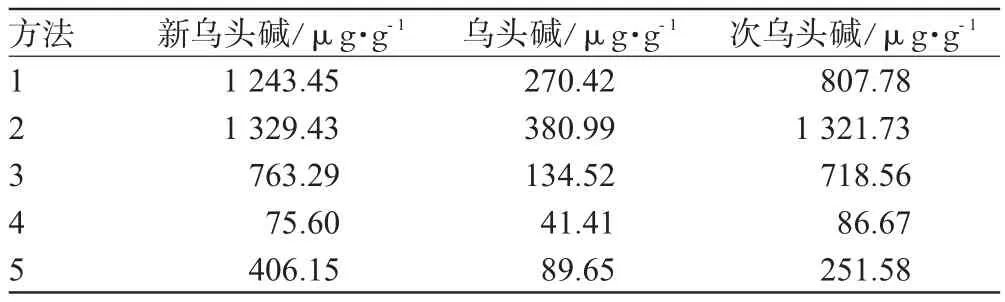
表2 不同处理方法的生物碱含量(n=3)Tab 2 Content of alkaloids prepared by different sample preparations(n=3)
2.7 精密度试验
精密吸取“方法2”的供试品溶液20 μL,重复进样5次,进行测定。结果,新乌头碱、乌头碱、次乌头碱峰面积RSD分别为1.04%、1.47%、1.01%,表明方法的精密度良好。
2.8 稳定性试验
对“方法2”供试品溶液在8 h之内每隔1 h进行1次考察。结果,新乌头碱、乌头碱、次乌头碱峰面积的RSD分别为1.60%、1.72%、1.23%(n=9),表明供试品溶液在8 h内稳定。
2.9 重复性试验
精密称量干燥附子粉末0.5 g共5份,按照“方法2”制备后进行测定。结果,新乌头碱、乌头碱、次乌头碱峰面积的RSD分别为1.35%、2.07%、1.29%,表明方法的重复性较好。
2.10 加样回收率试验
精密称量干燥附子粉末0.5 g共5份,每份分别加入各对照品贮备液,使新乌头碱、乌头碱、次乌头碱的加入量分别为450、200、400 μg。按“2.1”项下方法制备供试品溶液后进行测定,结果见表3。

表3 加样回收率试验结果(n=5)Tab 3 Results of recovery test(n=5)
2.11 含量测定
取干燥的附子粉末0.5 g,按照“2.1”项下“方法2”制备样品,在上述色谱条件下测定附子中3种生物碱的含量。结果,附子中新乌头碱、乌头碱和次乌头碱的含量分别为1.34、0.383、1.33 mg·g-1(n=3)。
3 讨论
HPLC法测定附子中生物碱的含量的样品制备方法主要是超声和加热回流2种。加热回流往往时间长、步骤较多,过程中流失的生物碱较多,“2.1”项下“方法4”和“方法5”就是因为步骤繁多,因此测得含量较低,在HPLC法测定生物碱含量的样品制备中应该尽量减少操作的步骤。药典法的测试样品用量大、时间长,主要是以测乌头碱的含量为主,不是对3种组分同时测定。3种生物碱都是碱性成分,药材粉末的碱化程度会影响到提取率,本试验用氨水湿润,再加入不同的提取试剂,超声使药材分散,易于溶剂渗透,使提取效率提高。超声时间影响到脂溶性生物碱的提取效率,本试验比较了在同一频率及温度条件下的超声时间,发现在50 min时的提取率最高,时间加长后提取率差异不大,因此本试验选择50 min为超声时间。
对照品的溶解在以前人们用的主要是非惰性有机溶剂甲醇、乙醇,但是在试验中发现对照品的混合液放置12 h后,在主峰的附近会出现杂峰,说明生物碱在这些溶剂中可能发生醇解反应。因此,本试验改为乙腈溶解对照品。
本试验的样品处理用乙醚超声法提取,新乌头碱、乌头碱和次乌头碱的分离效果较好、出峰时间短、回收率较高、操作简便,是附子3种生物碱含量测定中样品制备的首选方法。该方法可为附子中3种生物碱的含量测定和成分研究提供科学的依据。
[1]国家药典委员会编.中华人民共和国药典(一部)[S].2005年版.北京:化学工业出版社,2005:28.
[2]国家中医药管理局《中华本草》编委会.中华本草(第3卷)[M].上海:上海科学技术出版社,1999:101.
[3]董兰凤,张英俊,刘京生,等.附子多糖与阿霉素长循环热敏脂质体的抗肿瘤作用及其机制探讨[J].细胞与分子免疫学杂志,2006,22(4):458.
[4]张春水.乌头类生物碱的检测现状[J].刑事技术,1998,3:11.
[5]王朝虹,何 毅,张继宗,等.高效液相色谱法测定草乌中乌头碱含量[J].刑事技术,2003,1:15.
[6]叶震强,张辉珍.高效液相色谱法测定附子中次乌头碱的含量[J].时珍国医国药,2006,17(2):197.
[7]赵英永,崔秀明,张文斌,等.RP-HPLC法测定草乌中乌头碱、中乌头碱和次乌头碱[J].中草药,2006,37(6):940.
[8]刘玉兰,刘世坤,裴 奇,等.高效液相色谱测定附子3组分的含量[J].中国药房,2006,17(16):1255.
[9]项 杰,王阳雪,侯大斌,等.反相高效液相色谱法测定附子有效成分含量的方法研究[J].四川大学学报(自然科学版),2006,43(1):165.