人乙醛脱氢酶2基因在毕赤酵母中的高效表达
目前在人体中已发现的乙醛脱氢酶(Acetaldehyde dehydrogenase,ALDH)有19种,主要分布在肝、胃、心脏等器官中,最常见的有ALDH1~ALDH4四种。其中ALDH2处在线粒体内,表现出基因多态性[1,2],是人体酒精代谢的关键酶[3],在肝脏和胃中有很高的表达量[4]。关于乙醛脱氢酶的研究很多,已报道了该酶的诱导剂、激活剂、抑制剂,并对该酶分离提纯,还通过基因工程在大肠杆菌和植物体内对该酶基因进行表达[5~8],但目前采用基因工程的方法利用微生物发酵生产ALDH2的报道仍较少。利用重组毕赤酵母分泌表达人乙醛脱氢酶2(ALDH2)时,由于在表达过程中失活严重,很难得到大量有活性的人ALDH2。
作者在此研究了人ALDH2在毕赤酵母中的高效表达[9]。
1 实验
1.1 材料、试剂与仪器
含有密码子优化的人ALDH2的质粒pPIC9K-07ALDH2,自行构建。毕赤酵母PichiapastorisSMD1168,武汉大学生命科学院。BamHI、EcoRI、SacI、 Taq酶,上海生工;DNA回收试剂盒,BBI。
1 mL Ni-NTA Agarose预装柱,Invitrogen公司。
1.2 方法
1.2.1 表达载体的构建
(1)用BamHI、EcoRI双酶切质粒pPIC9K-07ALDH2去除信号肽(α-Factor)。将酶切的质粒用DNA回收试剂盒回收,备用。
(2)将两段合成的寡聚核苷酸链(5′-GATCCAAACGATGT-3′, 5′-AATTACATCGTTTG-3′)从90℃逐步降至4℃得到接头。
(3)用T4 DNA Ligase连接回收的质粒和接头,并将连接的产物回收。
(4)为了避免残留的pPIC9K-07ALDH2的干扰,用EcoRI酶切回收产物。
(5)将上一步的质粒转化至E.coliDH5α,并涂布在含氨苄青霉素的LB平板上。
(6)经菌落PCR验证得到E.coliDH5α(pPIC9K-ALDH2-delsign)。
1.2.2 基因工程菌株PichiapastorisSMD1168(pPIC9K-ALDH2-delsign)的构建
参照Invitrogen公司的毕赤酵母表达手册,从E.coliDH5α(pPIC9K-ALDH2-delsign)中提取质粒pPIC9K-07ALDH2,经过SacI线性化,并用DNA回收试剂盒回收线性化质粒,再将回收的线性化质粒用Multiporator型电转仪(Eppendorf公司)电转化入感受态PichiapastorisSMD1168中,电转化条件为:1200 V·mm-1,5 ms。用1 mol·L-1山梨醇悬浮后分别涂于MD平板培养基上,30℃培养2~3 d,筛选具有遗传霉素(G418)抗性的转化子。
1.2.3 诱导表达
参照Invitrogen公司的毕赤酵母表达手册,将PichiapastorisSMD1168 (pPIC9K-ALDH2-delsign)进行摇瓶发酵,用甲醇作诱导物诱导ALDH表达。将PCR验证为阳性的菌株在YPD培养基中30℃、200 r·min-1培养24 h,按1%接种量接种至50 mL BMGY培养基中,在30℃、200 r·min-1下摇床培养18 h左右,离心收集菌体并将菌体接种于50 mL BMMY培养基中。诱导表达条件为:温度28℃,pH值7.0,初始OD600=15,诱导72 h,每24 h补加1.2%甲醇。
1.2.4 分离纯化
由于酵母自身ALDH酶活很高,为了尽量去除干扰,必须先分离纯化后才可测定酶活。取发酵液离心收集菌体并用蒸馏水悬浮后用One shot型高压破碎仪(Constant Systems)破碎,破碎液过Ni柱,经过复合缓冲溶液(含0.5 mol·L-1NaCl、40 mmol·L-1咪唑的20 mmol·L-1磷酸钠缓冲溶液,pH值7.1)和蒸馏水反复洗涤后,再用洗脱缓冲溶液(含0.5 mol·L-1NaCl、 500 mmol·L-1咪唑的20 mmol·L-1磷酸钠缓冲溶液,pH值7.1)洗脱,收集目的蛋白,测定酶活。
1.2.5 酶活力测定
酶液在37℃条件下反应,用UV-2102型紫外可见分光光度计测定体系在340 nm下吸光度变化值,计算人ALDH2的酶活。酶活测定体系:1 mol·L-1Tris-HCl(pH值9.2) 300 μL, 100 mmol·L-1乙醛 200 μL, 3 mol·L-1KCl 100 μL, 1 mol·L-1巯基乙醇 30 μL,蒸馏水 1.07 mL,β-NAD 300 μL,酶液 1 mL。
2 结果与讨论
2.1 表达载体的构建
将质粒pPIC9K-07ALDH2用BamHI、EcoRI酶切,插入有同样粘性末端的接头,得到表达载体pPIC9K-ALDH2-delsign,如图1所示。

图1 pPIC9K-ALDH2-delsign的构建过程
以质粒pPIC9K-07ALDH2为模版,5′AOX1(5′-GACTGGTTCCAATTGACAAGC-3′)、3′AOX1(5′-GCAAATGGCATTCTGACATCC-3′)为引物,进行PCR扩增,得到含α-Factor和人ALDH2基因的片段,理论长度为2053 bp;以α5′(5′-TACTATTGCCAGCATTGCTGC-3′)、3′AOX1为引物,进行PCR扩增,得到含ALDH基因的片段,理论长度为1756 bp。
以质粒pPIC9K-ALDH2-delsign为模版,5′AOX1、 3′AOX1为引物,进行PCR扩增,得到含ALDH基因的片段,理论长度为1782 bp;以α5′、 3′AOX1为引物,因为去掉了信号肽(α-Factor),理论上不会扩增。PCR鉴定结果如图2所示。
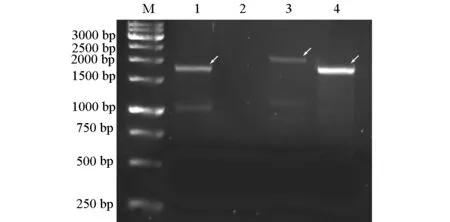
图2 表达载体PCR鉴定
图2中,第1泳道是以5′AOX1、 3′AOX1为引物扩增pPIC9K-ALDH2-delsign,PCR扩增结果1.8 kb;第2泳道是以α5′、 3′AOX1为引物扩增pPIC9K-ALDH2-delsign;第3泳道是以5′AOX1、 3′AOX1为引物扩增pPIC9K-07ALDH2,PCR扩增结果2.0 kb;第4泳道是以α5′、 3′AOX1为引物扩增pPIC9K-07ALDH2,PCR扩增结果1.7 kb。由此可知,实际片断大小与理论值相符。
2.2 分离纯化与酶活测定
收集5 mLPichiapastorisSMD1168诱导表达48 h发酵液,离心得到的菌体经5 mL蒸馏水悬浮后破碎,取3 mL破碎液经Ni柱纯化得到酶液。经酶活测定,纯化的酶液中酵母本身的ALDH残留仅为(0.10±0.06)%,可忽略不计,说明分离纯化能够很好地避免酵母本身ALDH的干扰。
分别在PichiapastorisSMD1168 (pPIC9K-ALDH2-delsign)诱导表达24 h、48 h时取5 mL发酵液,离心得到的菌体经5 mL蒸馏水悬浮后破碎,取3 mL破碎液经Ni柱纯化得到酶液。测定48 h纯化的酶液的酶活力,为0.944 U·mL-1,即发酵液中人ALDH2的酶活为0.315 U·mL-1。
2.3 讨论
(1)作者之前研究毕赤酵母分泌表达人ALDH2的过程中发现,只有在较低的温度下诱导才能检测到酶活(高于28℃完全没有酶活),并且诱导时间超过48 h后,蛋白表达量并没有太大的变化,但是酶活明显下降。因此推测在诱导过程中ALDH失活很严重,为了避免失活,尝试采用胞内表达,即将已构建的质粒pPIC9K-07ALDH2去除信号肽(α-Factor)得到质粒pPIC9K-ALDH2-delsign,然后整合到PichiapastorisSMD1168中诱导表达。去掉信号肽使ALDH在胞质中表达。
(2)利用胞内表达的重组毕赤酵母诱导表达后得到发酵液的人ALDH2酶活为0.315 U·mL-1,而作者以前构建的两株胞外表达的重组PichiapastorisGS115(pPIC9K-07ALDH2)和PichiapastorisSMD1168(pPIC9K-07ALDH2) 诱导表达后得到发酵液的人ALDH2酶活分别是0.110 U·mL-1、0.115 U·mL-1。胞内表达人ALDH2的酶活是胞外的2.7~2.8倍,这说明胞内表达能够明显降低人ALDH2的失活。
(3)本实验表达的人ALDH2含有6×His标签,便于利用亲和色谱分离纯化酶活较高的ALDH。若进一步进行发酵条件的优化,应可以大量制备人ALDH2,为人ALDH2的相关研究和应用打下良好的基础。
3 结论
去除自行构建的质粒pPIC9K-07ALDH2的信号肽(α-Factor)得到质粒pPIC9K-ALDH2-delsign,采用电转化方法将该质粒转化到PichiapastorisSMD1168中构建得到能在胞内高效表达人ALDH2的基因工程菌株PichiapastorisSMD1168 (pPIC9K-ALDH2-delsign)。利用该重组毕赤酵母摇瓶发酵得到的发酵液的人ALDH2酶活为0.315 U·mL-1,明显高于胞外表达时人ALDH2的酶活。经过亲和色谱分离纯化后的人ALDH2酶液的酶活为0.944 U·mL-1。
参考文献:
[1] Vasiliou V,Nebert Daniel W. Analysis and update of the human aldehyde dehydrogenase (ALDH) gene family[J]. Human Genomics, 2005, 2(2): 138-143.
[2] 哈斯图雅,毕力夫,苏秀兰.乙醛脱氢酶2(ALDH2)基因研究进展[J].中国优生与遗传杂志,2007,15(5): 3-4.
[3] 陈维莉.酒与化学[J].化学教学, 1999, (12):38-39.
[4] Yoshida A, Hsu L C, Yasunami M. Genetics of human alcohol-metabolizing enzymes[J].Prog Nucleic Acid Res Mol Biol,1991,40:255-287.
[5] Loike John D, Suzanne Hickman, David Holzer. Mammalian alcohol dehydrogenase and aldehyde dehydrogenase production in plants[P].USP 5 855 881, 1999-01-05.
[6] Tatsuo Hoshino, Taro Miyazaki, Teruhide Sugisawa. Aldehyde dehydrogenase[P].USP 6 242 233,2001-06-05.
[7] Ramanjulu Sunkar, Dorothea Bartels, Hans-Hubert Kirch. Overexpression of a stress-inducible aldehyde dehydrogenase gene fromArabidopsisthalianain transgenic plants improves stress tolerance[J].The Plant Journal,2003,35(4):452-464.
[8] Dickinson F M. Conformational changes and activation of yeast aldehyde dehydrogenase by various agents[J].Chemico-Biological Interactions, 2003,143-144:169-174.
[9] 彭毅,杨希才,康良仪.影响甲醇酵母中外源蛋白表达的因素[J].生物技术通报, 2000,(4):33-36.

