一种酰基高丝氨酸内酯酶筛选方法的建立
许多细菌都能够合成并释放一种或多种被称为自诱导物的信号分子,胞外的信号分子浓度能随细菌菌体密度的增大而增大,细菌利用信号分子在细胞间的扩散,来感知自身和周围环境中其它细菌的数量变化[1]。当信号分子达到一定临界浓度时,就会启动菌体中相关基因的表达,调控菌体的某些生物行为,如生物膜的形成[2]、孢子的生成、荧光的产生、抗生素的生物合成、毒性因子的产生、胞外多糖的合成、细菌丛集、质粒结合转移、稳定生长期的进入等,以适应环境的变化,这种现象被称为群体感应(Quorum sensing,QS)[3]。
近年来,人们逐渐从一些原核生物以及真核生物中鉴定出了一些酰基高丝氨酸内酯酶,能够降解细菌的群体感应信号分子,干扰细菌的群体感应系统,并且破坏其参与调控的生物学功能[4]。更为重要的是,酰基高丝氨酸内酯酶能够降解特定的决定动植物病原菌致病因子产生的群体感应信号分子,减轻或者消除病原菌的致病性。许多能够合成酰基高丝氨酸内酯酶的细菌(如荧光假单胞菌、苏云金芽孢杆菌[5]等)或携带外源酰基高丝氨酸内酯酶基因的工程菌与致病菌欧文氏胡萝卜软腐病菌混合后接种马铃薯,其发病程度远远弱于单独接种病原菌[6]。这表明,群体感应淬灭机制很可能会成为一种新的生防方法。因此,有必要建立一种酰基高丝氨酸内酯酶筛选方法,以满足科研和生产的需求。
1 实验
1.1 菌株、质粒与试剂
紫色色杆菌突变株CV026(Chromobacteriumviolaceum026)报告菌由上海交通大学许煜泉教授、华东理工大学阿华生物工程研究所张元兴教授惠赠,LB培养基,Kan抗性,培养温度为28℃。该报告菌可以指示3OC6-HSL信号分子的存在并产生紫色色素。
大肠杆菌DH5α、BL21(DE3)购自天根生化科技(北京)有限公司,LB培养基,培养温度为37℃。
信号分子降解菌aiiA/pET-28a(+)/BL21(DE3)为本实验室构建,其表达产物AiiA蛋白可以降解3OC6-HSL信号分子,LB培养基,Kan抗性,培养温度为37℃。
pLuxRI2质粒为美国加州理工学院Frances H.Arnold教授惠赠。
rTaq DNA聚合酶、T4 DNA连接酶、XhoⅠ限制性内切酶、EcoRⅠ限制性内切酶、DNA marker,Takara公司;LB培养基,上海捷瑞生物工程有限公司;质粒小提中量试剂盒、普通琼脂糖凝胶DNA回收试剂盒、普通DNA产物纯化试剂盒,天根生化科技(北京)有限公司;其它试剂均为分析纯,国药集团化学试剂有限公司。DNA引物由上海生工生物工程技术服务有限公司合成,测序由上海美季生物技术有限公司完成。
1.2 方法
1.2.1luxI基因的PCR扩增
以pLuxRI2质粒为模板,根据3OC6-HSL信号分子合成酶基因luxI序列设计正向引物luxIFP:GTCGGGAATTCCCGAATAAACGCAAGGGAGGTTGG;反向引物luxIRP:AAGTAATCTCGAGGAAGCT-TAACAACATTAATTTAAGACTGC。下划线部分GAATTC为EcoRⅠ酶切位点、CTCGAG为XhoⅠ酶切位点。luxI基因PCR扩增的反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。luxI基因PCR扩增的反应体系:ddH2O 37.75 μL,10×Buffer(Mg2+)5 μL,dNTP 4 μL,正向引物luxIFP 1 μL,反向引物luxIRP 1 μL,pLuxRI2模板1 μL,rTaq DNA聚合酶0.25 μL,总体系50 μL。
1.2.2luxI/pET-28a(+)/BL21(DE3)的构建
根据luxI基因及pET-28a(+)质粒含有的EcoRⅠ和XhoⅠ酶切位点,做luxI基因和pET-28a(+)质粒的双酶切。双酶切反应条件:37℃水浴2 h。双酶切反应体系:ddH2O 32 μL,10×Buffer 8 μL,luxI基因或pET-28a(+)质粒32 μL,EcoRⅠ 4 μL,XhoⅠ 4 μL,总体系80 μL。将双酶切后的luxI基因和pET-28a(+)质粒按10∶1(用量分别为0.3×10-12mol·L-1和0.03×10-12mol·L-1)的比例连接。连接反应条件:16℃连接过夜。连接反应体系:ddH2O 12.5 μL,luxI基因6 μL,pET-28a(+)质粒3 μL,Buffer 2.5 μL,T4 DNA连接酶1 μL,总体系25 μL。将连接液转化至BL21(DE3)大肠杆菌感受态细胞中,菌落PCR鉴定后挑取阳性克隆送样测序。
1.2.3 3OC6-HSL信号分子的合成
将信号分子合成酶表达菌luxI/pET-28a(+)/BL21(DE3)的过夜培养物按1%接种量接种于TSB液体培养基中,Kan抗性,抗生素工作浓度为50 μg·mL-1,摇床转速为200 r·min-1,37℃培养2~3 h至OD600=0.6,添加终浓度为1 mmol·L-1的IPTG,28℃培养6 h。取紫色色杆菌突变株CV026过夜培养物与诱导后的luxI/pET-28a(+)/BL21(DE3)各200 μL,混合后置于28℃摇床培养16 h,摇床转速为150 r·min-1。观察终培养物颜色,确定3OC6-HSL信号分子合成成功。
1.2.4 筛选体系的建立
LB液体培养基,代替实际筛选体系中用到的信号分子降解菌aiiA/pET-28a(+)/BL21(DE3)的部分。将20 μL LB液体培养基和100 μL产生有3OC6-HSL信号分子的培养液混合后培养90 min,再与50 μL紫色色杆菌突变株CV026的过夜培养物混合,过夜培养后观察终培养物颜色。
1.2.5 筛选体系的优化
将20 μL LB液体培养基分别和诱导了4 h、6 h、8 h的产生有3OC6-HSL信号分子的培养液50 μL、100 μL、150 μL、200 μL混合后培养90 min,经紫外灭活60 min后,分别与紫色色杆菌突变株CV026的过夜培养物20 μL、40 μL、60 μL混合,过夜培养后观察终培养物颜色。筛选体系A~L的组成见表1。

表1 筛选体系(A~L)的组成/μL
1.2.6 酰基高丝氨酸内酯酶的筛选
利用建立的酰基高丝氨酸内酯酶筛选体系,对信号分子降解菌aiiA/pET-28a(+)/BL21(DE3)的活性进行验证。将信号分子降解菌aiiA/pET-28a(+)/BL21(DE3)的过夜培养物按1%接种量接种于LB液体培养基中,Kan抗性,抗生素工作浓度为50 μg·mL-1,摇床转速为200 r·min-1,37℃培养2~3 h至OD600=0.6,添加终浓度为1 mmol·L-1的IPTG,28℃培养6 h。将20 μL诱导后的aiiA/pET-28a(+)/BL21(DE3)分别稀释1倍、2倍后再与50 μL产生有3OC6-HSL信号分子的培养液混合后培养90 min,经紫外灭活后,与20 μL紫色色杆菌突变株CV026的过夜培养物混合,过夜培养后观察终培养物颜色。
2 结果与讨论
2.1 luxI基因的PCR扩增(图1)

M.DL2000 DNA Marker 1.luxI的PCR产物
由图1可以看出,luxI基因的PCR产物条带单一无拖尾,且小于750 bp,与预期的621 bp相符,纯化后用于质粒构建。
2.2 luxI/pET-28a(+)/BL21(DE3)的构建
对luxI基因和pET-28a(+)质粒进行酶切、连接。连接产物转化至BL21(DE3)大肠杆菌感受态细胞中,挑取5个克隆做菌落PCR鉴定。选择其中一个阳性克隆送样测序。测序结果(图2)和luxI基因的标准序列完全一致,表明luxI/pET-28a(+)/BL21(DE3)克隆构建成功。将序列正确的luxI/pET-28a(+)/BL21(DE3)甘油菌保存于-80℃冰箱中。

图2 luxI/pET-28a(+)质粒测序结果
2.3 3OC6-HSL信号分子的合成(图3)
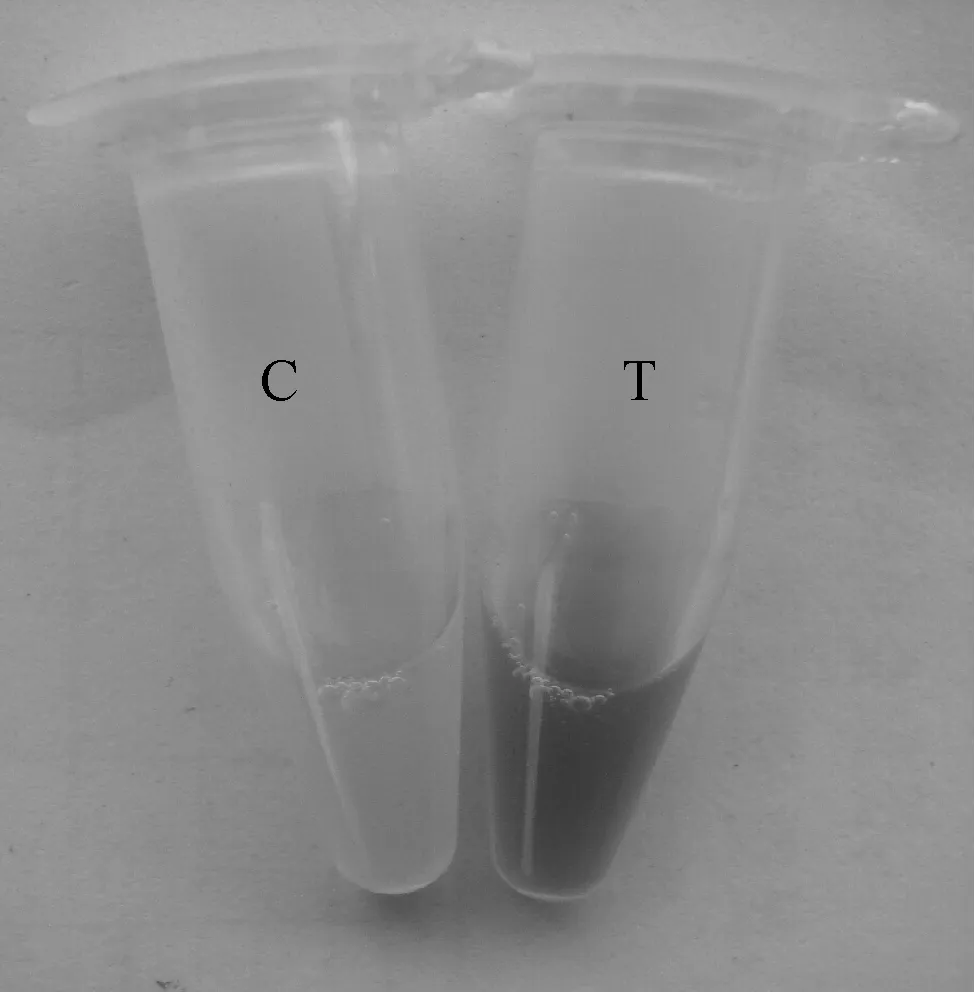
C.对照组 T.实验组
由图3可以看出,对照组信号分子合成酶表达菌luxI/pET-28a(+)/BL21(DE3)未经IPTG诱导,不产生信号分子合成酶,最终无法合成信号分子,CV026报告菌不能产生紫色色素;实验组luxI/pET-28a(+)/BL21(DE3)经IPTG诱导后产生信号分子合成酶LuxI,进而合成3OC6-HSL信号分子,CV026报告菌在信号分子的存在下产生紫色色素,即终培养物显示为紫色,证明3OC6-HSL信号分子合成成功。
2.4 筛选体系的建立
LB液体培养基和产生有3OC6-HSL信号分子的培养液混合后培养,由于体系中不含酰基高丝氨酸内酯酶,因此有3OC6-HSL信号分子存在,与紫色色杆菌突变株CV026的过夜培养物混合后培养,CV026在信号分子存在的情况下产生紫色色素,即终培养物显示为紫色(图4)。若体系中含有酰基高丝氨酸内酯酶存在,则终培养物紫色变浅或消失。由此可以证明该筛选体系建立成功,可以对酰基高丝氨酸内酯酶进行筛选。

图4 筛选体系的建立
2.5 筛选体系的优化(图5)

A~L 各筛选体系从上至下分别为诱导了4 h、6 h、8 h的luxI/pET-28a(+)/BL21(DE3)信号分子合成酶表达菌
由图5可以看出,箭头所指的体系为最佳筛选体系,即50 μL诱导了6 h的luxI/pET-28a(+)/BL21(DE3)信号分子合成酶表达菌与20 μL不含酰基高丝氨酸内酯酶的LB培养基混合后,再与20 μL的CV026报告菌混合并过夜培养,其终培养物所显示出的紫色颜色最深。在有酰基高丝氨酸内酯酶存在的情况下,紫色会变浅或消失。
2.6 酰基高丝氨酸内酯酶的筛选(图6)

1.没有稀释的信号分子降解菌 2.稀释1倍的信号分子降解菌 3.稀释2倍的信号分子降解菌 C1、C2.不含信号分子降解菌
由图6可以看出,加入的信号分子降解菌的菌量不同,酰基高丝氨酸内酯酶的酶量也不同。由于信号分子被部分或全部降解,CV026报告菌在少量信号分子或没有信号分子存在下产生很浅的紫色色素或者完全没有紫色色素产生。由此可见,该筛选体系可以对酰基高丝氨酸内酯酶进行有效的筛选,并对不同酶活性的酰基高丝氨酸内酯酶具有很好的区分度。
2.7 讨论
(1)信号分子3OC6-HSL价格昂贵且易降解。本研究通过构建信号分子合成酶表达菌luxI/pET-28a(+)/BL21(DE3),对其进行诱导表达合成3OC6-HSL信号分子,降低了实验成本,很好地解决了这一难题。
(2)菌种筛选过程工作量大,筛选结果存在一定的偶然性,方法得当可以大大缩短筛选的周期,尽快获得实验结果。菌种筛选中可以用离心管代替摇瓶,如果有条件保证无菌操作,也可以采用96孔板,既节省了培养基,又缩短了操作时间,加快了实验进度。
3 结论
建立了一种酰基高丝氨酸内酯酶筛选方法,并对筛选体系进行优化。最终确定信号分子合成酶的诱导时间为6 h、含有信号分子的培养液的体积为50 μL、CV026报告菌的过夜培养物的体积为20 μL。该方法可用于酰基高丝氨酸内酯酶的筛选,并且对不同酶活性的酰基高丝氨酸内酯酶具有很好的区分度。
参考文献:
[1] Fuqua W C,Winans S C,Greenberg E P.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].J Bacteriol,1994,176(2):269-275.
[2] Hastings J W,Greenberg E P.Quorum sensing:The explanation of a curious phenomenon reveals a common characteristic of bacteria[J].J Bacteriol,1999,181(9):2667-2668.
[3] Salmond G P,Bycroft B W,Stewart G S,et al.The bacterial′ enigma′:Cracking the code of cell-cell communication[J].Mol Microbiol,1995,16(4):615-624.
[4] Sio C F,Otten L G,Cool R H,et al.Quorum quenching by anN-acyl-homoserine lactone acylase fromPseudomonasaeruginosaPAO1[J].Infect Immun,2006,74(3):1673-1682.
[5] Bauer W D,Robinson J B.Disruption of bacterial quorum sensing by other organisms[J].Curr Opin Biotechnol,2002,13(3):234-237.
[6] Dong Y H,Wang L H,Xu J L,et al.Quenching quorum-sensing-dependent bacterial infection by anN-acyl homoserine lactonase[J].Nature,2001,411(6839):813-817.

