薤白EPSP基因对亚麻的转化及检测
李博,黄丽华,蒋向,李育强,张学文*
(1.湖南农业大学 生物科学技术学院,湖南 长沙 410128;2.湖南省棉花科学研究所,湖南 常德 415101)
亚麻是最早取得转基因成功的作物之一,1987年通过愈伤组织转化获得了亚麻转基因植株[1].McHugen等1989年建立了根癌农杆菌介导的亚麻遗传转化系统,将ALS基因导入亚麻,获得了抗除草剂草胺磷的转基因品种,并已经进入商业化生产[2].抗磺隆类除草剂转基因品种CDC Triffid于1996年获得转基因品种登记证书[3]. Zhan Xiangcan等发现利用发根农杆菌浸染亚麻下胚轴和子叶可以形成发根并可发育成再生植株[4].王玉富等以亚麻幼苗下胚轴为外植体,利用抗除草剂Basta的目的基因Barnase和GUS-INT基因,采用农杆菌介导法进行了亚麻转基因[5].王毓美等以几丁质酶基因对亚麻的遗传转化,经抗性小芽生根筛选及叶片抗性检测,推断几丁质酶基因已经整合到亚麻基因组中[6].康庆华等[7]利用农杆菌介导法进行亚麻黑亚11号和黑亚9号转抗除草剂Basta 基因转化,获得了转化的愈伤组织[8].黑龙江省亚麻原料工业研究所与中科院遗传研究所合作进行兔防御素NP-1基因[9]在转基因亚麻中的表达及其对亚麻枯萎病[10]和立枯病[11]的抗性研究,目前已获得了转基因植株.
亚麻作为草本作物,在规模化栽培过程中杂草控制比较困难,抗除草剂的基因工程研究中,最受关注的是抗草甘膦的基因工程.草甘膦是一种环境友好型除草剂,其作用的靶为芳香族氨基酸合成过程的关键酶EPSP合成酶.EPSP催化3-磷酸莽草酸(S3P)与磷酸烯醇式丙酮酸(PEP)合成5-烯醇式丙酮酸-3-磷酸莽草酸(EPSP)[12-14],草甘膦是PEP的类似物,它能与PEP竞争性抑制EPSP合成酶的活性,阻断EPSP的合成,从而阻断植物芳香族氨基酸的合成,导致植物死亡[15].
蒋向等[16]从具有较强草甘膦抗性的葱属植物薤白(Allium macrostemon Bunge)中分离克隆了其EPSP合成酶基因EPSPsA cDNA, 并对该基因的表达进行了分析.笔者利用已克隆的抗草甘膦薤白EPSPsAcDNA,构建植物表达EPSPsA重组载体转化亚麻,以探讨薤白抗草甘膦EPSPsA cDNA的表达及抗草甘膦的作用.
1 材料与方法
1.1 材 料
供试亚麻由中国农科院麻类研究所提供.大肠杆菌InVαF′ 和根癌农杆菌LBA4404,克隆的薤白EPSP基因cDNA (pMD-EPSPsA)质粒、植物表达载体 pWM101由湖南农业大学细胞生物学研究室保存.
亚麻培养采用MS +2 mg/L KT、3.5 mg/L IAA +适量氨基酸进行共培养;共培养基+50 mg/L潮霉素B+500 mg/L 头孢曲松钠进行筛选培养;MS + 0.02 mg/L 6-BA+0.01 mg/L NAA+50 mg/L潮霉素B+500 mg/L头孢曲松钠进行愈伤组织诱导和发芽;MS+0.01 mg/L NAA诱导生根;YEB培养基:0.5 g/L MgSO4+1 g/L酵母提取物+5 g/L胰化蛋白胨+5 g/L牛肉浸膏+5 g/L蔗糖+15 g/L琼脂.
1.2 方 法
1.2.1 表达载体的构建
通过 BioEdit 软件分析 EPSP基因中的酶切位点, 结合植物表达载体pWM101 上的多克隆位点,在克隆载体pMD-EPSPsA上、下游分别引入XbaⅠ和 PstⅠ限制内切酶的酶切位点,设计引物分别为上游引物 P1:5′-AACTGCAGGATGGTTCAGCAAT GCTGAC-3′和下游引物 P2:5′-GCGTCGACCCAT CGAAGCACCTGGTTC-3′,构建表达载体(图 1).用热激法将重组质粒转化大肠杆菌进行 Amp抗性筛选和X-gal/IPTG蓝白斑筛选,选取白色菌落做菌落PCR.将检测为阳性的菌落进行液体培养,强碱法制备质粒DNA,以限制性内切酶XbaⅠ和PstⅠ酶切.检测重组质粒插入目的片段的情况后,采用电击转化法将构建正确的表达载体 pWM-EPSPsA转化农杆菌LBA4404.
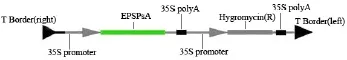
图1 植物表达载体pWM101-EPSPsA的构建Fig.1 Construction of plant expression vector pWM101-EPSPsA
1.2.2 根癌农杆菌的电激转化
将根癌农杆菌LBA4404 单菌落接入5 mL YEB培养基中,28 ℃振荡培养过夜.以10%的接种量转接至50 mL YEB培养液中,28 ℃、150 r/ min 振荡培养至对数生长期(OD600为0. 8~1.2). 4 ℃、8 000 r/min 离心10 min,收集菌体,用预冷的无菌双蒸水洗涤4次,用无菌预冷10%的甘油洗涤,离心,以Bio-Rad电激仪转化农杆菌.
1.2.3 农杆菌共培养法转化亚麻下胚轴
选择饱满度好、有光泽的供试亚麻种子, 用75%的乙醇浸5 min 后,用20%的漂白液浸20 min,再用无菌水冲洗3次,接种到MS培养基上, 在25 ℃黑暗条件下培养5~7 d.在使用前2 d置于22 ℃、每天16 h光照条件下培养备用.工程农杆菌YEB液体培养基加卡那霉素50 mg/L、28 ℃摇瓶培养2 d.将50 mL培养物4 000 g离心收集细菌,用MS液体培养基悬浮细菌,使OD600值0.5~0.6.将备用的亚麻下胚轴剪成0.3~0.5 cm 的小段,用农杆菌悬浮液浸10~20 min,无菌滤纸吸干后分别接种到顶层置滤纸的培养基上.24~26 ℃、每天光照16 h共培养3 d后,用10 mmol/L MgSO4浸10~20 min,控制农杆菌的继续生长.将培养3周的愈伤组织接种到再生植株诱导培养基,24~26 ℃、每天光照14~16 h,诱导再生植株生长.将获得的再生芽接种到含有抗性筛选的抗生素的培养基上继续筛选2次.再生植株3~5 cm 时转接生根培养基上.诱导生根一个月后,大部分苗已长出繁茂的根,将PCR阳性苗移入珍珠岩中培养,当株高达到20 cm左右,根系比较发达以后,移栽至土壤获得转基因亚麻苗,在移栽的同时种植同品种的未转化种子作对照.
1.2.4 转基因亚麻的PCR检测
取转基因亚麻和对照亚麻嫩叶,采用安比奥公司GenoDNA Plant Mini Kit试剂盒提取基因组DNA,作为PCR反应模板.以P1、P2为引物,pWM-EPSPsA质粒为阳性对照,PCR检测转基因情况.
1.2.5 转基因亚麻的草甘膦抗性检测
将通过潮霉素抗性筛选的愈伤组织接种到草甘膦质量浓度为0、200、400、800、1 200、2 000和3 000 mg/L MS培养基上,25 ℃、6 h光照和8 h黑暗交替培养,检测转基因亚麻愈伤组织对草甘膦的抗性.当移栽后的转基因亚麻植株长到10~15 cm时,用质量浓度为200、400、800和1 000 mg/L草甘膦溶液喷洒叶片,喷后10~15 d 调查植株草甘膦抗性.
1.2.6 EPSPsA 基因转录表达分析
随机选取4个PCR检测阳性的转基因植株,进行EPSPsA基因的转录表达分析.取对照亚麻及转基因亚麻叶片,用Trizol(Introgen)抽提总RNA.采用 Fermentas公司反转录试剂盒将 RNA反转录为cDNA,作为半定量 RT-PCR扩增的模板.以亚麻18S rRNA为内参基因,扩增引物,上游引物:5′-ATGATAACTCGACGGATCGC-3′、下游引物:5′-CTTGGATGTGGTAGCCGT-3′,扩增片断大小为189 bp.EPSPsA基因扩增引物,上游引物:5′-GTT AACGTCAACAGCTTTCAATCTC-3′,下游引物:5′-ATCCCGACAGTGCTACATATGAGAG-3′,扩增片段大小为539 bp.
18 SrRNA与目的基因采用同机分管扩增.PCR产物经1%琼脂糖凝胶电泳检测,凝胶照相.
2 结果与分析
2.1 表达载体的构建与鉴定
植物表达载体pWM101-EPSPsA按照重组过程进行构建后转化大肠杆菌InvαF′,在转化平板上随机挑取10个菌,进行菌落PCR检测.提取质粒,用Xba I和Pst I酶切,获得大小约1.5 kb 的预期带(图 2).
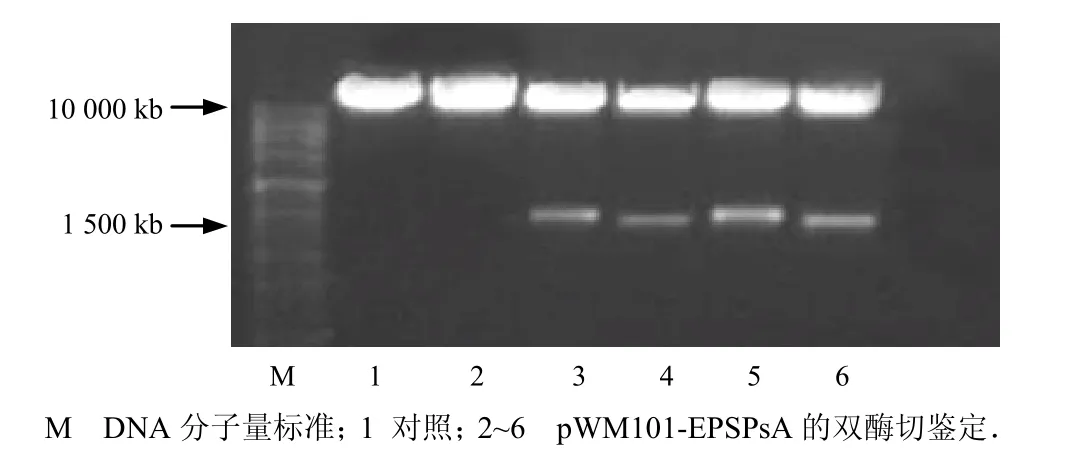
图2 表达载体pWM101-EPSPsA的双酶切检测Fig.2 Identification of the pWM101-EPSPsA digested by Xba I and Pst I
2.2 农杆菌共培养转化亚麻
农杆菌转化后的下胚轴转入含头孢曲松钠(500 mg/L)和潮霉素(50 mg/L)MS固体培养基中,1周后,对照组下胚轴逐渐褐化死亡.转基因亚麻下胚轴培养3周后,分化出不定芽(图3).

图3 转基因亚麻下胚轴愈伤组织诱导与筛选Fig.3 Transgenic hypocotyl callus induced and screened
2.3 转基因亚麻的PCR检测
选取10株转基因植株,分离其叶片基因组DNA,以薤白EPSPsA特异性引物进行扩增,获得了预期大小(1.6 kb)的DNA,证明薤白EPSPs基因已经整合入亚麻基因组中(图4).
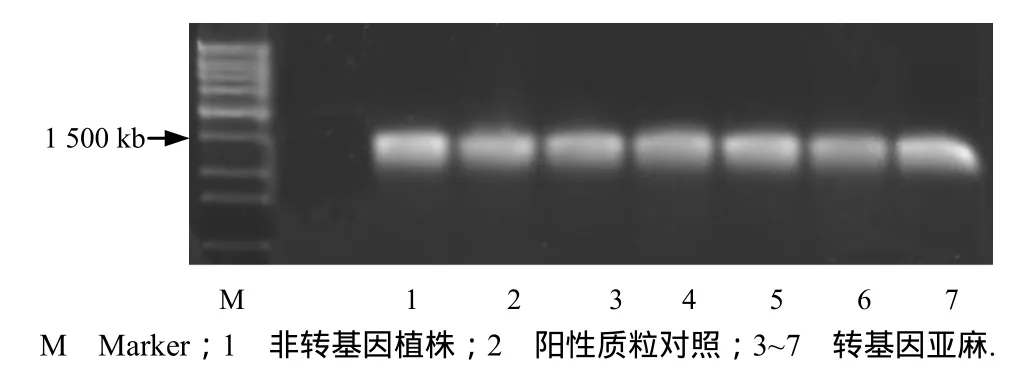
图4 转基因亚麻的PCR检测Fig. 4 PCR analysis of transgenic flax
2.4 转基因亚麻愈伤对草甘膦抗性的检测
将转基因愈伤组织接种到含不同质量浓度的草甘膦培养基上,25 ℃、16 h光照和8 h黑暗交替培养,2周后观察,对照愈伤组织在草甘膦质量浓度为50 mg /L时已全部坏死,而转基因亚麻愈伤组织在800 mg/L时仍可以缓慢生长,当草甘膦质量浓度达到1 200 mg /L时愈伤才逐步坏死(图5).
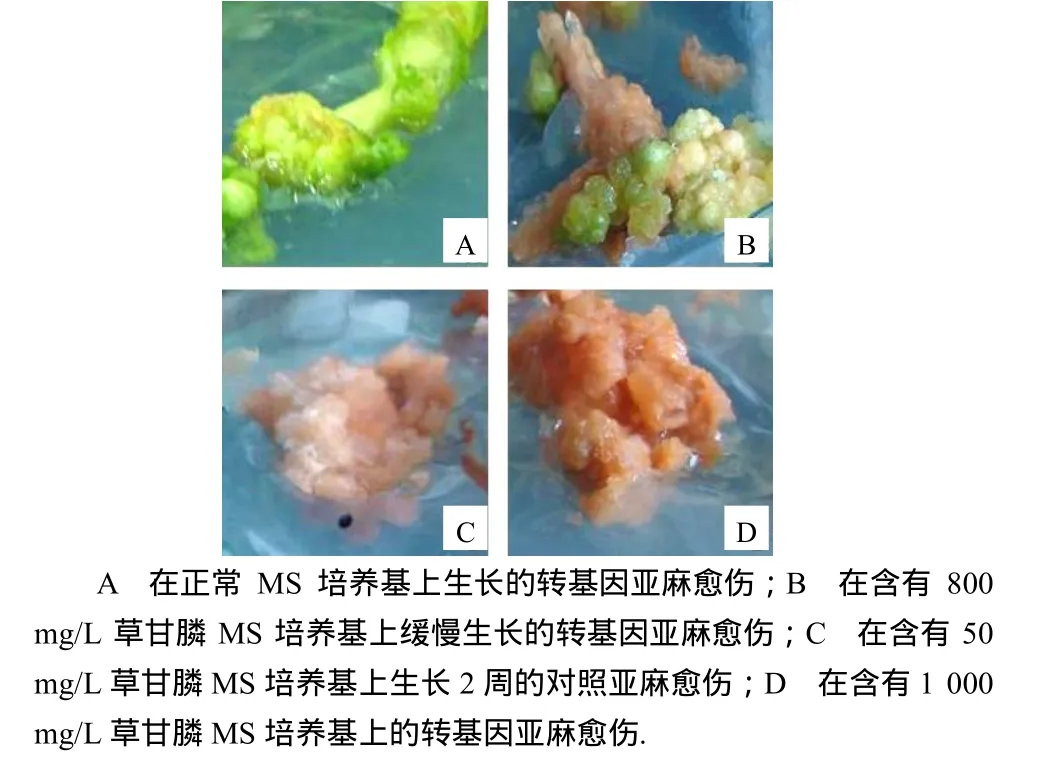
图5 转基因亚麻愈伤组织的草甘膦抗性Fig. 5 Resistance of transgenic tobacco callus to glyphosate
2.5 转基因亚麻植株对草甘膦抗性的检测

图6 抗除草剂试验2周后结果Fig. 6 Transgnic flax resistance to glyphosate
转基因亚麻(图6)炼苗后转入土壤栽培,壮苗后以草甘膦进行喷雾处理,1周后对照植株明显变黄,而经过EPSPA基因转化的亚麻植株并无枯黄变化,2周后未经转化的植株茎叶完全变白并枯死,说明通过转化使被转化的亚麻植株获得了对草甘膦的抗性.
2.6 EPSPsA基因转录表达分析
随机选取3株转基因亚麻进行RT-PCR(图7),在539 bp处扩增出特异的目的条带,表明EPSPsA基因在转基因亚麻中都有一定量的表达.对照中没有检出EPSPsA,说明引物具有较好的特异性,同时EPSPsA基因的表达是获得草甘膦抗性的关键.根据该结果推测转基因亚麻草甘膦抗性的提高是由于EPSPsA基因的导入和过量表达引起的.
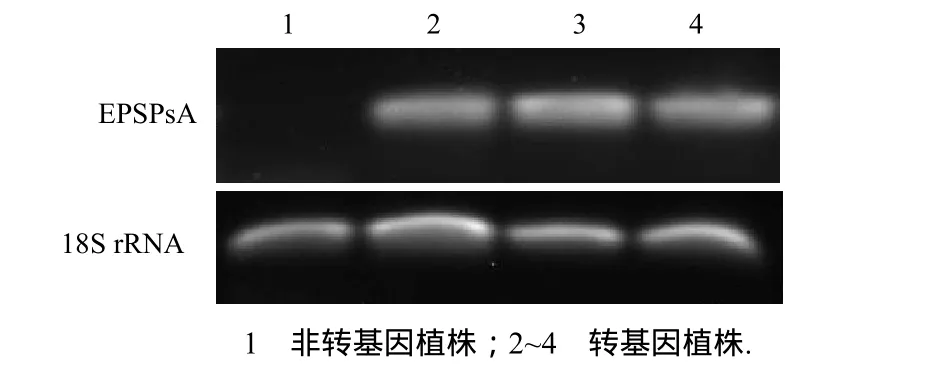
图7 转基因亚麻中EPSPsA 基因的表达Fig.7 Expression of EPSPsA in transgenic flax plants
3 讨 论
抗性EPSP转入植物,提高植物对优良除草剂草甘膦的抗性,是获得抗除草剂农作物的有效方法,但转基因所采用的抗性基因都为来自于细菌的aroA基因[17],其转基因的安全性一直令人担忧.植物来源的抗性基因在安全性方面有一定的优势,但转植物源基因的抗性水平往往达不到生产应用的要求.本研究利用薤白EPSPsA基因进行的亚麻遗传转化,亚麻获得了抗草甘膦的能力,抗性水平达到了800 mg/L.抗性的获得一方面由于薤白EPSPsA具有的一定水平除草剂抗性,也有可能由于基因在高水平启动子的作用下,过量表达导致转基因中靶酶大量的累积所致.
经过分子检测结果证明,目的基因已经整合到亚麻基因组中.通过对转基因亚麻进行草甘膦喷洒试验,也可以看出转基因亚麻植株对草甘膦的抗性明显高于未转基因对照组,证明转薤白EPSPsA基因提高亚麻草甘膦抗性的有效性.
[1]Basiran N,Armitage P,Scott R J,et al.Genetic transformation of flax(Linum usitatissimum)by Agrobacterium tumefaciens regeneration of transformed shoots via a callus phase[J].Plant Cell Repoets,1987(6):396- 399.
[2]Mchughen A.Agrobacterium mediated transfer of chlosulfuron resistance to commercial flax cultivals[J].Plant Cell Report,1989(8):445-449.
[3]Mc Hughen A, Holm F A.Development and preliminary field testing of a glufosinate ammonium tolerant transgenic flax[J].Can J Plant Sci,1995,75:117- 120.
[4]Zhan Xiang-can,David A Jones,Allen Kerr.Regeneration of flax plants transformed by Agrobacterium rhizogenes[J].Plant Molecular Biology,1988,11(5):551-559.
[5]王玉富,周思君,刘燕,等.利用农杆菌介导法进行亚麻转基因培养基的研究[J].中国麻作,2000,22(1):14-16.
[6]王毓美,李武兴,陈曦,等.几丁质酶基因转化亚麻、红豆草、骆驼刺的同工酶研究[J].西北植物学报,2001,21(1):26-31.
[7]康庆华. 亚麻转基因试验中抗菌素效果的研究[J].中国麻业,2005,27(2):94-97.
[8]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:179-185.
[9]Zhang Wen-He,Zhao Qian,Yu Jing-Juan,et al.Obtaining transgenic maize plants expressing the rabbit defensin(NP-1)gene and evaluation of their disease resistance[J].Chinese Journal of Agricultural Biotechnology,2004(1):55-59.
[10]E van Rijn,Termorshuizen A J,A H C van.Bruggen storage method affects disease suppression of flax wilt induced by composts[J].Soil Biology and Biochemistry,2007,39(11):2743-2749.
[11]Aida H,Afify,Ashour As,et al.Biocontrol of flax seedling blight with mixtures of Pseudominas Spp.[J].Pakistan Journal of Biological Scical Sciences,2000,3(3):368-371.
[12]Carlisle S M,Trevors J T.Glyphosate in the environment[J].Water Air and Soil Pollution,1988,39(3):409-420.
[13]Alibhai M F,Stallings W C.Closing down on glyphosate inhibition with a new structure for drug discovery[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98(6):2944-2946.
[14]Du W S,Wa11is N G,Mazzulla M J,et al.Characterization of Streptococcus pneumoniae 5-enolpynevylshikimate-3-phosphate synthase and its actibation by univalent cations[J].Eur J Bioche,2000,267: 222-227.
[15]马向东,黄春华,周俊初.基因体外诱变[J].微生物学通报,2002,29(1):70-72.
[16]蒋向,戴雄泽,李育强,等.薤白EPSPs基因在不同组织表达的半定量分析[J].湖南农业大学学报:自然科学版,2007,33(5):542-545.
[17]姚姝,张保龙,沈新莲,等.分别转 CP4 EPSPS和a roA基因拟南芥对草甘膦的抗性[J].江苏农业学报,2006,22(3):302-304.

