人参皂苷Rg3对人成纤维细胞增殖和凋亡影响的实验研究
刘鹤松,赵自然,兰珊珊,赵伟刚,王 芳
(1.吉林大学第一医院 皮肤科,吉林 长春130021;2.吉林大学第一医院 整形外科,吉林 长春130021;3.白城市医院 骨科,吉林 白城137000)
瘢痕疙瘩是临床中常见的疾病,但治疗是难题。人参皂甙是人参的有效化学成分,具有抑制肿瘤细胞增殖的作用[1-3]。本研究是研究人参皂甙Rg3对人成纤维细胞的影响,探究应用其治疗瘢痕疙瘩和增生性瘢痕的可能性。
1 材料与方法
1.1材料取我科瘢痕疙瘩患者手术切取的瘢痕组织。部位:前胸、耳垂等,年龄7-35岁,瘢痕生长时间1-3年,所有患者均无其它器质性疾病,未做过特殊治疗及激素治疗,均经过临床和病理诊断证实。
1.1.1主要试剂 GS-Rg3由吉林大学基础医学院提供;DMEM培养基美国GIBCO公司;10%灭活小牛血清北京;培养板丹麦;MTT(溴化二甲噻唑二苯四氮唑蓝)北京;二甲基亚砜(DMSO)北京西中化工厂;碘化丙啶(PI)美国Sigma。
1.1.2主要仪器 CO2孵箱美国SHEL LAB;流式细胞仪美国BD;酶标仪美国BIO-RAD。
1.2瘢痕疙瘩成纤维细胞的体外培养和鉴定
1.2.1原代培养 无菌条件下,将手术切除的瘢痕组织放入磷酸盐平衡溶液中漂洗,用眼科剪刀和手术刀将表皮和皮下组织剔除,反复冲洗干净后,将真皮组织剪成1 mm×1 mm×1 mm的组织块,加入2-3滴小牛血清,将组织块均匀置于培养瓶壁,翻转培养瓶使组织块贴壁处朝上加入6 ml含20%胎牛血清的DMEM培养基。每毫升培养液中加入青霉素和链霉素各 100 μ,置入 37℃、5%CO2、95%空气 、饱和湿度的孵箱,孵育12 h,组织块充分贴壁后,轻轻翻转培养瓶,使组织块浸入培养基中,2-3 d换液。
1.2.2传代培养 7-10 d后可见组织块周围有成纤维细胞生长,原代培养的细胞达到80%融合时传代,按1∶2或1∶3的比例传代后继续培养,直至细胞处于对数生长期。
1.3MTT法检测细胞的活性取第三代细胞,调整浓度为6×104/ml,以每孔50 μ l接种于96孔板,待细胞贴壁后加入不同浓度GS-Rg3。放入 37℃、5%CO2孵箱内分别培养24 h、48 h、72 h,GS-Rg3终浓度为25、50、100 和 200 μ g/ml,对照组加入等量的培养液,每组4复孔。培养12 h后用培养液漂洗细胞2次,每孔加入 MTT(5 mg/ml)10 μ l,继续培养 4 h后,弃上清,每孔加入 DMSO 100 μ l,振摇 10 min,用Bio-RAD550型酶联免疫检测仪在570 nm波长下读取A值,并计算抑制率。

1.4流式细胞术测细胞周期
1.4.1取第三代细胞,调整细胞浓度为2×105/ml,加入 24 孔板,每孔加 500 μ l(1×105)个细胞 ,待细胞贴壁后加入不同浓度GS-Rg3,37℃、5%CO2孵育24 h后,收集细胞,用PBS缓冲液洗涤2次。
1.4.2加入 PI染色液 200 μ l、Rnase 50 μ l混匀 ,室温避光作用30 min,孵育。
1.4.3FCM测定细胞周期各时相以及AP区亚峰细胞百分率。
1.5统计学方法用SAS软件对所有数据进行统计学处理,所有数据均表示为s,阳性率资料组间采用单因素方差分析,P<0.05值为有统计学意义。
2 结果
2.1剂量-效应关系GS-Rg3不同浓度:25、50、100和200 μ g/ml分别与对照组相比,72 h对细胞增殖的抑制率依次为 33.1%、55.1%、92.8%、82.95%,抑制强度与药物剂量呈正相关。浓度为100 μ g/ml其抑制率最高,浓度继续增加,抑制率减弱。
时间-效应关系 贴壁的成纤维细胞在给药3 h后可见部分细胞脱落,其抑制效应随时间而明显增强,72 h处于最高水平。
GS-Rg3浓度在25-100 μ g/ml时对细胞增殖有明显的抑制作用,但当浓度过高(200 μ g/ml)时对成纤维细胞的生长无明显的抑制作用,所以选择50和100 μ g/ml的GS-Rg3进行药物干预实验。见表1。
表1 GS-Rg3对体外培养成纤维细胞的抑制率(s,n=4)

表1 GS-Rg3对体外培养成纤维细胞的抑制率(s,n=4)
GS-Rg3(μ g/100ml)抑制率(%)24 h 48 h 72 h F值 P值25 15.57±6.39 16.15±10.6333.1±4.5 1.55 0.269 50 22.3±4.9535.01±3.4455.1±1.1617.518 0.001 100 89.25±2.73 90.05±2.0992.8±1.30 8.924 0.007 200 88.83±2.08 91.45±0.68 82.95±10.228.075 0.010 F值 18.2980 322.987 796.326 P值 0 0 0
2.2体外培养成纤维细胞经GS-Rg3作用24小时后细胞周期变化(s,n=4)G1期细胞比例增多,但S期细胞比例减少,并呈剂量依赖性,G2无明显改变。见表2

表2 GS-Rg3对细胞周期的影响
2.3流式细胞仪检测结果GS-Rg3作用的成纤维细胞核内DNA裂解形成凋亡峰;Rg3浓度50 μ g/ml时 ,凋亡率 18.85%;Rg3 浓度 100 μ g/ml时 ,凋亡率25.26%。细胞凋亡比率在一定药物浓度范围内,随药物浓度的升高而增加。见表3-表5

表3 流式细胞仪测定DNA分布图(与对照组相比,P<0.01)

表4 GS-Rg3 50μ g/ml细胞凋亡率18.85%
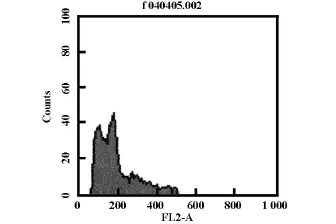
表5 GS-Rg3 100 μ g/ml细胞凋亡率 25.26%
3 讨论
瘢痕疙瘩和增生性瘢痕是两种常见的病理性瘢痕,其特征是大量细胞增生和过度胶原沉积,而成纤维细胞是产生胶原的主要细胞[4]。故成纤维细胞与病理性瘢痕形成有重要关系。Kischer等发现肉芽组织向成熟瘢痕过渡中有凋亡发生[5]。使我们想到病理性瘢痕的形成不仅由于成纤维细胞增殖,可能还有成纤维细胞的凋亡减少共同参与。细胞凋亡与细胞产生一样都是机体自然的生理过程。这种更新是以细胞数量上的恒定为前提的,因此是一种动态平衡;没有细胞生理性死亡,不可能细胞更新。细胞产生与细胞凋亡之间的平衡是机体稳态的基本条件,它们的平衡一旦破坏,就会导致疾病的产生[6]。
瘢痕疙瘩形成的一个重要因素就是成纤维细胞合成分泌大量细胞外基质[7]。细胞外基质主要是由胶原蛋白、蛋白多糖和纤维粘连蛋白等组成。胶原蛋白主要由Ⅰ型和Ⅲ型胶原组成,瘢痕疙瘩Ⅰ、Ⅲ型胶原的合成明显升高,尤以I型胶原为主[8,9]。采用形态学和免疫细胞化学的方法对体外培养的成纤维细胞进行综合分析,所培养的细胞为单一的长梭形细胞,以波形蛋白、I型胶原作为成纤维细胞的标志性蛋白进行鉴定,二者均为阳性表达。证实本研究所采用的培养方法是科学合理的,可获得了高纯度的成纤维细胞。
GS-Rg3加入体外培养成纤维细胞中,浓度分别为 0 、25、50 、100、200 μ g/ml,作用时间为 24h 、48h 、72 h。经MTT法检测发现,GS-Rg3对体外成纤维细胞的抑制率随浓度的增加和时间的延长而增强,最大抑制率为92.8%,最佳抑制浓度为 100 μ g/ml,因此可见GS-Rg3可抑制成纤维细胞的增殖,且抑制作用呈剂量、时间依赖性。
我们还发现贴壁生长的瘢痕成纤维细胞在给药后3-4 h可发生部分细胞脱落。为进一步研究其作用机制,进行流式细胞仪检测GS-Rg3作用的细胞与对照组相比,G1期细胞比例明显增多,S期细胞比例明显减少,并呈明显的剂量依赖性,G2改变无统计学意义。实验表明GS-Rg3能够延长细胞由G1期到S期的进程,使细胞阻滞于G1期。S期是细胞进行大量DNA复制的阶段,组蛋白及非组蛋白也在此期合成,最后完成染色体的复制,说明GS-Rg3对成纤维细胞生长的抑制,主要是通过抑制DNA合成来完成的。同时通过流式细胞仪检测到GS-Rg3作用的成纤维细胞核内DNA裂解形成凋亡峰。Rg3浓度50 μ g/ml 72小时时,凋亡率 18.85%;Rg3浓度100 μ g/ml 72小时时,凋亡率25.26%。表明GS-Rg3在一定浓度范围内可诱导细胞凋亡,并且凋亡比率随药物浓度的升高而增加。以上两个实验结果说明GS-Rg3可以影响成纤维细胞周期,这一作用是通过抑制细胞的DNA合成来实现的,从而达到抑制成纤维细胞增殖并诱导其凋亡,GS-Rg3可能对瘢痕有治疗作用,其机理有待于进一步深入研究。
细胞凋亡时,细胞内DNA裂解,在流式细胞术的DNA图上呈现亚二倍体核型峰的特征。细胞凋亡一个重要特征就是核酸内切酶激活,引起DNA的广泛断裂,这是流式细胞术检测细胞凋亡的理论基础。应用DNA特异性荧光染料染色后,凋亡细胞染色程度下降,因此流式细胞术可对DNA含量进行定量分析。在DNA直方图上,凋亡细胞出现二倍体(G1)峰细胞减少,G1峰左侧呈现特征性的亚二倍体(亚G1)峰。而坏死时,细胞周期中的细胞均出现不同程度的减少,亚二倍体细胞量多少不等。亚G1峰可用于凋亡细胞定量。根据Anodrew等[10]的观点,细胞凋亡是由正常的细胞周期改变引起的,细胞凋亡与细胞周期阻滞有关。应用流式细胞术不仅可以从细胞的形态和特征上分析凋亡细胞,还可以反映细胞发生阻滞的时期。
4 结论
我们的研究表明,GS-Rg3对人成纤维细胞增殖有明显的抑制作用,并能够诱导其凋亡,为临床应用GS-Rg3治疗病理性瘢痕提供了理论依据。由于体内外环境的差异以及瘢痕形成的复杂性,其临床应用价值还有待于进一步研究。
[1]韩 萍,陈拯民.含人参皂甙GS-Rg3的药物可选择性抑制癌细胞[J].国外医学·植物药分册,1994,9(2):89.
[2]马文彬,宋长春,马兴元,等.应用流式细胞光度计研究人参单体Rh1和Rh2对小鼠S180肉瘤细胞周期移行的影响[J].白求恩医科大学学报,1991,17(6):551.
[3]Mochizuki M,Yoo Yc,Matsuzawa K,et al,Inhibitory effect of tumor metastasis in mice by saponins,ginenoside-Rb2,20(R)-and 20(S)-ginsenoside-GS-Rg3.of red ginseng[J].Biol,pharm Bull,1995,18:1197.
[4]Arakawa M,Hatamochi A,Mori Y,et al.Ueduced collagenase gene expression infibroblast from hypertrophic scar tissue[J].British J of Dermatology,1996,134(5):863.
[5]Kischer CW,Pindur J.Characteristics of granulation tissue which promote hypertrophic scaring[J].Scanning Microsc,1990,4(4):877.
[6]Garashi A,Okochi H,Bradham DM,et al.Regulation of connective tissue growth factor gene expression in human skin fibroblasts and during wound repair[J].Mol Biol Sci,1993,4:637.
[7]李世荣,刘剑毅,纪淑兴.体外培养人增生性瘢痕成纤维细胞胶原合成及结缔组织生长因子的表达[J].中华整形外科杂志,2004,20(2):124
[8]Robson MC,Barnetts RA.Prevention and treatment of posburn scars and contracture[J].World J Surg,1992,16:87.
[9]David W,Friedman,Charles,et al.Regulation of collagen gene expression in keloids and hypirtrophic scar[J].Surg Res,1993,55:214.
[10]Anodrew L,Kung S,Anders Z,et al,Cytotoxic effects of cell cycle phase specific angents:result of cell cycle pertur bation[J].Cancer Research,1999,50(4):7307.

